雙分子熒光互補分析法檢測α-突觸核蛋白的聚集及在細胞間的傳播
任曉曦 趙 云 韓玉坤 鄭 焱 楊 慧 張建亮
(首都醫科大學基礎醫學院神經生物學系 北京腦重大疾病研究院 帕金森病研究所 教育部神經變性病重點實驗室,北京 100069)
帕金森病(PD)是一種常見的神經退行性疾病,其主要的病理改變是黑質紋狀體內多巴胺能神經元的選擇性丟失及路易體形成〔1,2〕。α-突觸核蛋白是路易體內的主要成分。證據表明,α-突觸核蛋白可能是一種朊蛋白樣的蛋白質,他可以聚集成有毒的多聚體形式并在細胞間成“種子”樣傳播〔3〕。目前認為α-突觸核蛋白的寡聚體,可能就是“種子”的一種形式,α-突觸核蛋白的寡聚體在被細胞攝取之后,可以使細胞內正常的α-突觸核蛋白錯誤折疊并以它為核心發生聚集,在聚集的過程中不僅會對細胞產生毒性作用,還會有新的α-突觸核蛋白寡聚體形成。新的α-突觸核蛋白寡聚體被細胞排出后,繼續影響周圍細胞,開啟一個惡性循環〔4〕。因此如果能及早檢測出傳播的α-突觸核蛋白,不僅可以為PD的診斷提供重要的證據,而且還能在PD的早期對其進行干預治療,緩解PD病理進程。本文中,我們利用高靈敏的熒光素酶human Gaussiaprinceps luciferase(hGLuc)作為報告蛋白〔5〕,構建了一套可以檢測α-突觸核蛋白聚集及傳播的系統,該方法可以有效地檢測α-突觸核蛋白的聚集及在細胞間的傳播,這為PD的早期診斷提供了思路,為PD的早期干預治療提供了可能。
1 材料與方法
1.1材料 DMEM和胎牛血清(FBS,Gibco),線性聚乙烯亞胺(MW,25 000,PEI)(polysciences,Inc.),腔腸素(Yeasen),α-突觸核蛋白抗體(BD),α-actin抗體(冠星宇),Phusion高保真DNA聚合酶,Dpn1(NEB),Amicon? Ultra-4 3KD離心過濾器(Millipore)。
1.2質粒構建 模板pCDNA3.1(+)-α-突觸核蛋白,hGLuccDNA序列(優寶生物)。構建pCDNA3.1(+)-α-突觸核蛋白-linker-hGLucN,模板上游引物:GGCTTCAGGTTCGTAGTCTTGATAC;模板下游引物:TAACCACTAGTCCAGTGTGGTGG;片段上游引物:CTACGAACCTGAAGCCGGAGGCGGAGGCTCCGGAGGCGGA GGCTCCGCCAAGCCCACCGAGAAC;片段下游引物:CACTGGACTAGTGGTTAGCCTATGCCGCCCTGTG;構建pCDNA3.1(+)-α-突觸核蛋白-linker-hGLucC,模板上游引物:GGCTTCAGGTTCGTAGTCTTGATAC;模板下游引物:TAACCACTAGTCCAGTGTGGTGG;片段上游引物:CTACGAACCTGAAGCCGGAGGCGGAGGCTCCG-GAGGCGGAGGCTCCGAGGCGATCGTCGACATTCC;片段下游引物:CACTGGACTAGTGGTTAGTCACCACCGGCCCCC。
1.3細胞培養及質粒轉染 將SK-N-SH細胞接種于含有10% FBS的DMEM培養基中,置于5%CO2,37℃細胞培養箱中培養,待細胞密度在80%左右時利用PEI對細胞進行轉染。
1.4Western印跡 轉染48 h后收集細胞,使用RIPA裂解液裂解細胞,4℃條件下12 000 r/min離心30 min,取上清液,利用二喹啉甲酸(BCA)法測量蛋白質濃度。12%十二烷基硫酸鈉聚丙烯酰胺凝膠(SDS-PAGE)電泳,聚偏二氟乙烯(PVDF)膜半干轉1h,封閉后孵育抗體。
1.5Dot印跡 轉染48 h后,收集培養基,使用3 kD離心過濾器將3 500 μl培養基濃縮至100 μl,取1 μl滴與硝酸纖維素(NC)膜上,晾干后用5%脫脂牛奶封閉,隨后孵育抗體。
1.6α-突觸核蛋白預制原纖維制備 將人源重組α-突觸核蛋白單體溶于0.1 mol/L 磷酸鹽緩沖液(PBS)中,終濃度為5 mg/ml。隨后1 000 r/min,37℃震搖7 d。100 000 r/min離心30 min,分離出聚集成纖維狀態的α-突觸核蛋白,分裝后-80℃保存。
1.7熒光素酶活性檢測 將SK-N-SH細胞接種到96孔板中,轉染48 h后,棄掉培養基用0.01 mol/L PBS洗3遍,加入Coelenterazine,native,20 μmol/L,酶標儀檢測。
1.8統計學方法 采用Graph Pad Prism 6 軟件進行單因素方差分析。
2 結 果
2.1BiFC分析法原理及質粒構建 為了構建BiFC分析法〔6〕,首先要將hGLuc的N端(1~93)和hGLuc的C端(94~169)分別與α-突觸核蛋白的C端融合〔5,7,8〕,記作L1和L2。為了降低蛋白質空間構象產生的空間位阻,我們在α-突觸核蛋白和hGLuc的N端/C端之間插入了一段由10個氨基酸(GGGGSGGGGS)組成的連接子(linker)〔6〕,以使hGLuc的N端/C端可以相對自由的轉動(圖1)。這樣,在同時表達L1和L2的細胞中,如果α-突觸核蛋白發生聚集,那么hGLuc的N端和C端就會隨之相互靠近,使hGLuc恢復酶活力。恢復酶活力的hGLuc可以催化底物Coelenterazine分解,產生可以被探查到的熒光信號,見圖1。

圖1 質粒結構圖及BiFC分析法原理圖
2.2融合蛋白可以在SK-N-SH細胞中表達 質粒構建完成后,我們接下來在SK-N-SH細胞中驗證融合蛋白是否表達。我們利用轉染試劑將質粒瞬時轉入SK-N-SH細胞中,48 h后利用Western印跡檢測質粒表達情況。結果顯示,兩種質粒均可在SK-N-SH細胞中表達,見圖2。
2.3BiFC分析法可以檢測α-突觸核蛋白的聚集 在SK-N-SH細胞系中同時表達L1和L2,48 h后,加入底物Coelenterazine,利用酶標儀讀數。結果顯示,共同轉染組(171.33±14.27)與轉染空載質粒組(48.50±5.41)熒光強度差異顯著,這說明L1和L2隨著α-突觸核蛋白聚集而相互靠近,從而使hGLuc恢復了酶活性。為排除L1或L2單獨就具有酶活性的情況,將L1或L2分別轉染入SK-N-SH細胞系中,48 h后,加入底物Coelenterazine,利用酶標儀讀數,結果顯示,單獨轉染L1組(42.33±6.13)和單獨轉染L2組(44.83±8.51)與轉染空載質粒的細胞組沒有明顯差別,這說明L1或L2單獨不具有酶活性。

圖2 Western印跡檢測融合蛋白L1和L2在SK-N-SH 細胞中表達
2.4結果特異性驗證 體外通過GST蛋白純化的方式得到人源重組α-突觸核蛋白單體。隨后將α-突觸核蛋白單體在體外震搖7 d,獲得α-突觸核蛋白預制原纖維(PFF)。因為當α-突觸核蛋白聚集成纖維狀態時,會在溶液中形成沉淀,所以通過超速離心的方式可以將未聚集成纖維狀態的α-突觸核蛋白,即上清液與聚集成纖維狀態的α-突觸核蛋白,即沉淀分離開來,見圖3。最后將纖維狀態的α-突觸核蛋白經過超聲處理后,利用BiFC分析法檢測,結果顯示,熒光強度隨著PFF濃度的增高而增高,當體系中PFF濃度為0.03 μg/μl時,熒光強度明顯增高(1.27±0.08),這說明利用BiFC分析法可以很好地表征α-突觸核蛋白的聚集,同時也說明了該方法可以檢測到α-突觸核蛋白聚集體的存在。
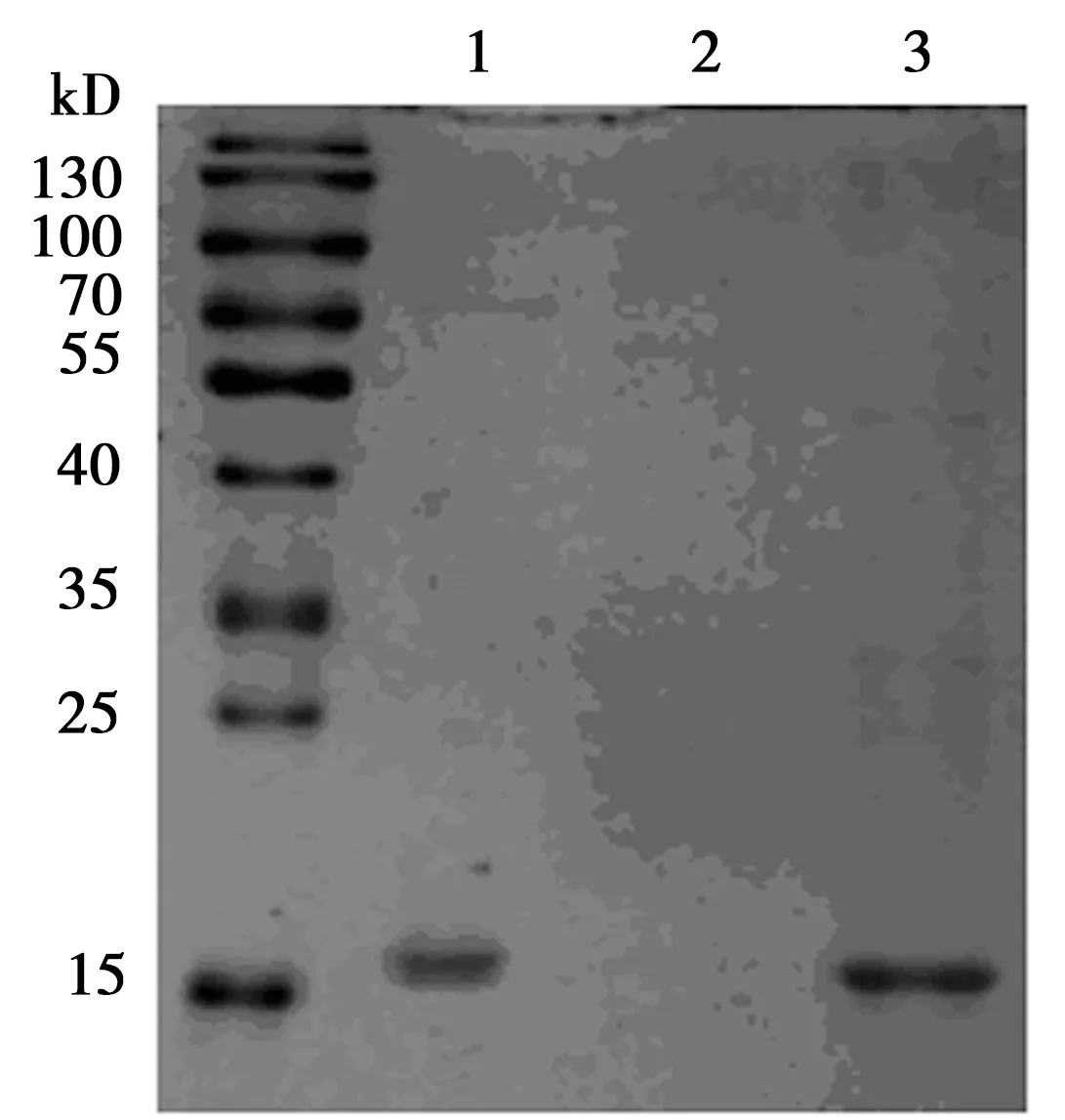
1:α-突觸核蛋白單體;2:上清液;3:沉淀圖3 人源重組α-突觸核蛋白SDS-PAGE
2.5BiFC分析法可以檢測到α-突觸核蛋白的傳播 將L1或L2及空載質粒分別轉染入SK-N-SH細胞中,48 h后收集培養基,記為L1(m)、L2(m)和空載質粒(m)。Dot印跡結果證明了L1(m)和L2(m)中有α-突觸核蛋白的存在,而空載質粒(m)中沒有(圖4)。隨后將L2(m)和空載質粒(m)分別加入到已經轉染了L1的SK-N-SH細胞中(轉染36 h后),記為L1+L2(m)組和L1+空載質粒(m)組;L1(m)和空載質粒(m)分別加入到已經轉染了L2的SK-N-SH細胞中(轉染36 h后),記為L2+L1(m)組和L2+空載質粒(m)組。繼續培養12 h后,加入底物Coelenterazine,利用酶標儀讀數。結果顯示,L1+L2(m)組的熒光強度(26.25±2.17)要明顯高于L1+空載質粒(m)組(21.00±0.89),同樣L2+L1(m)組的熒光強度(29.20±5.00)要明顯高于L2+空載質粒(m)組(19.00±2.28)。而L1+L2(m)組和L2+L1(m)組的熒光強度沒有統計學差異,L1+空載質粒(m)組與L2+空載質粒(m)組的熒光強度也沒有統計學差異。以上結果說明BiFC分析法可以檢測到α-突觸核蛋白在細胞間的傳播。

圖4 Dot印跡檢測培養基中的α-突觸核蛋白
3 討 論
在本研究中,我們利用高靈敏的熒光素酶hGLuc作為報告蛋白,將其N端(1~93)與C端(94~169)分別與α-突觸核蛋白的C端融合,并將L1和L2在SK-N-SH細胞中共同表達,結果顯示L1和L2隨著α-突觸核蛋白聚集而相互靠近,從而使hGLuc恢復了酶活性。隨后我們加入PFF,誘導內源性α-突觸核蛋白的聚集,結果顯示熒光強度隨著PFF濃度的增高而增高,當體系中PFF濃度為0.03 μg/μl時,熒光強度明顯增高,這說明利用BiFC分析法可以很好地表征α-突觸核蛋白的聚集,同時也說明了該方法可以檢測到α-突觸核蛋白聚集體的存在。最后將L1和L2分別在SK-N-SH細胞中表達,結果表明BiFC分析法可以檢測到α-突觸核蛋白在細胞間的傳播。
α-突觸核蛋白是PD中的關鍵蛋白質,它可以聚集成有毒的多聚體形式,α-突觸核蛋白可以在細胞與細胞之間傳播〔9,10〕。不僅如此,其寡聚體猶如一顆種子,在進入細胞后可以誘導細胞內正常的α-突觸核蛋白發生聚集并釋放到細胞外從而影響周圍細胞,開啟一個惡性循環。而這個惡性循環無疑是PD發生發展的關鍵因素。但是傳統方法,如非變性聚丙烯酰胺凝膠電泳,密度梯度離心法,排阻色譜或者原子力顯微鏡觀察等,不僅費時費力,而且也很難檢測到α-突觸核蛋白的聚集和在細胞間的傳播。本研究中的BiFC分析法為檢測α-突觸核蛋白的聚集和在細胞間的傳播提供了新的解決思路。這不僅為PD的早期診斷提供了思路,為PD的早期干預治療提供了可能,而且也為抑制α-突觸核蛋白聚集的藥物篩選提供了幫助。

