非洲豬瘟K205R蛋白的原核表達及多抗的制備
杜方原,馮春燕,仇松寅,王彩霞,張永寧,林祥梅,吳紹強
(中國檢驗檢疫科學研究院動物檢疫研究所,北京 大興 100176)
非洲豬瘟病毒(Africanswinefevervirus,ASFV)是具有二十面體結構的DNA病毒,是非洲豬瘟病毒科的唯一成員,能引起豬的急性、熱性、高度接觸性傳染疾病[1]。疣豬等野生哺乳動物在感染ASFV后并不一定會發病,為發現及預防ASFV增加了更大的難度[2]。目前ASFV并沒有有效的疫苗進行防控,因此,建立快速準確的診斷方法是防控該病的重要手段。
ASFV基因組全長約170 kb,含有150多個開放閱讀框。K205R蛋白由未分配的開放閱讀框編碼[3],Reis等人的研究表明,K205R蛋白誘導豬只能產生較強的免疫反應,是ASFV主要的抗原之一[4]。K205R主要在動物的感染初期表達,這對ASFV的早期診斷具有重大意義[5]。為此,本研究利用大腸桿菌原核表達系統表達ASFV K205R蛋白,在其基礎上制備多抗,以期為建立該病的血清學檢測方法提供生物材料。
1 材料與方法
1.1 材料 大腸桿菌BL21細胞,pET-21a載體,pMD18-T載體、限制性內切酶BamHI、XhoI,T4 DNA連接酶,購自寶生物工程(大連)有限公司; 普通TaqDNA聚合酶,購自北京全式金生物技術有限公司。
IPTG、蛋白質Marker和 Western Blot 發光液等,購自北京全式金生物技術有限公司;鎳離子金屬螯合(Ni-NTA)預裝柱,購自QIAGEN公司;辣根酶標記豬IgG二抗,購自Abcam公司;辣根酶標記兔IgG 二抗,購自北京中杉金橋生物技術有限公司;引物合成及測序由英濰捷基(上海)貿易有限公司完成。
1.2 方法
1.2.1 K205R基因的擴增和質粒構建 參考ASFV的BA71V毒株(GeneID:22220430)的K205R基因序列,合成K205R基因,該基因編碼框全長615 bp,其編碼蛋白全長205個氨基酸,分子量約為23.7 kDa。合成的K205R基因插入pMD-18-T 質粒,即為pMD18T-K205R質粒。
根據K205R的基因序列,用Primer 5.0設計引物,并在上、下游引物分別引入酶切位點BamHI和XhoI,上游引物ASFV-205-R:5′-CCGCTCGAGCTTCTTCATCATCTCTTTG-3′(Xho I),下游引物ASFV-205-F:5′-CGCGGATCCATGGTTGAGCCACGCGAA-3′(BamH I)。利用上述引物,以pMD18T-K205R質粒為模板,進行PCR擴增。25 μL 的PCR反應體系為,2× PCR Mix 12.5 μL,ddH2O 10 μL,ASFV-205-21a-F 1 μL,ASFV-205-21a-R 1 μL,模板 0.5 μL。反應條件為96 ℃預變性60 s,94 ℃ 40 s,56 ℃ 60 s,72 ℃ 140 s,共30個循環;72 ℃延伸10 min。擴增的片段經過BamHI和XhoI酶切純化后,和經酶切純化的pET-21a載體DNA,在T4 DNA 連接酶作用下,于16 ℃過夜,連接產物轉化大腸桿菌DH5α感受態細菌,篩選抗卡那霉素菌落,對pET21a-K205R 的K205R 蛋白基因進行測序,鑒定重組表達質粒。
將pET-21a-K205R 重組質粒轉化感受態大腸桿菌BL21(DE3)細菌,所獲得的轉化細菌即為pET-21a-205R-BL21 菌株,該菌株用于表達非洲豬瘟的K205R蛋白。
1.2.2 蛋白的誘導表達與可溶性分析 將pET21a-K205R載體轉化至大腸桿菌BL21(DE3)感受態細胞。挑取單菌落至LB液體培養基中,37 ℃ 振蕩培養至OD600nm值為0.8~1.0,以1∶100(體積比)的比例將培養菌液加至LB液體培養基中,37 ℃振蕩培養至OD600nm值為0.4~0.6,加入IPTG,16 ℃、37 ℃分別誘導培養,收集菌體進行SDS-PAGE凝膠電泳,用考馬斯亮藍染色,觀察表達結果。
1.2.3 蛋白的純化 將3 L陽性菌液誘導6 h后,離心收集菌體。加入50 mL的PBS重懸菌體洗滌,離心去上清,重復3次,冰上放置進行超聲破碎,將裂解液離心收集上清液,用0.22 μm的濾器去除雜質,將上清加入到預處理好的QIAGEN Ni-NTA beads的操作進行純化。用20 mmol/L的咪唑洗去雜蛋白,用200 mmol/L的咪唑洗脫目的蛋白。跑膠。
對不純的蛋白進行陰離子交換柱的純化,取蛋白的峰,進行蛋白質電泳,保證蛋白的純度在80%以上。
1.2.4 K205R蛋白的抗原性分析 將純化后的K205R蛋白進行SDA-PAGE,半干轉法將蛋白轉印至PVDF膜上,5%脫脂乳封閉1 h;將PVDF膜放入1∶50稀釋的非洲豬瘟陽性血清中,4 ℃孵育過夜;TBST洗3次,每次5 min;將膜放入稀釋好的HRP-山羊抗豬IgG(1∶5 000);TBST洗5次,每次5 min;DAB顯色10 min。
1.2.5 多抗的制備 免疫程序為初次免疫劑量為每只兔子1 mg K205R蛋白,將蛋白與等體積的弗氏完全佐劑充分乳化后,在兔背部皮下分多點注射;2周后加強免疫4次,每次間隔1周,前3次劑量為每只兔子0.5 mg,K205R蛋白改用不完全弗氏佐劑乳化,背部皮下多點注射;末次免疫劑量為每只兔子2 mg,耳緣靜脈注射,3 d后采血。于免疫前采集5 mL兔血液分離血清,作為陰性血清對照。
1.2.6 多抗的純化與保存 采用Protein A親和層析法純化多抗,參照試劑說明書進行純化。將兔抗血清過柱2遍,用TBS徹底洗滌純化柱,再用甘氨酸洗脫液(pH值2.7)進行洗脫,并用Tris-HCl 緩沖液(pH值8.0)將洗脫液pH值調至7.4 。最后,用TBS過夜透析純化后的多抗,并用超濾管濃縮后,加入50%甘油和1‰疊氮鈉,置-20 ℃保存。
1.2.7 多抗效價的測定 以K205R蛋白作為檢測抗原,通過間接ELISA法測定多抗效價。將抗原稀釋為濃度為1 μg/mL包被ELISA板,每孔加入100 μL,4 ℃包被過夜;PBST清洗3次;每孔加入100 μL 封閉液(5% BSA,PBST稀釋),37 ℃封閉1 h;PBST清洗3次;每孔加入100 μL 不同稀釋度的多抗(1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000、1∶64 000、1∶128 000),37 ℃孵育1 h,同時設同等稀釋度的非免疫兔血清為陰性對照;PBST清洗3次;每孔加入100 μL稀釋的HRP-山羊抗兔IgG(1∶10 000),37 ℃孵育1 h;PBST清洗4次;每孔加入100 μL TMB底物溶液,室溫反應10 min,每孔加入50 μL 2 mol/L的H2SO4終止液終止反應。用酶標儀在450 nm處測定OD值。
2 試驗結果
2.1K205R基因的擴增和質粒構建 將K205R基因克隆至原核表達載體pET-21a-c(+)中,成功構建了pET-21a-K205R。對重組質粒進行PCR及測序鑒定,結果顯示,重組質粒pET-21a-K205R構建成功。
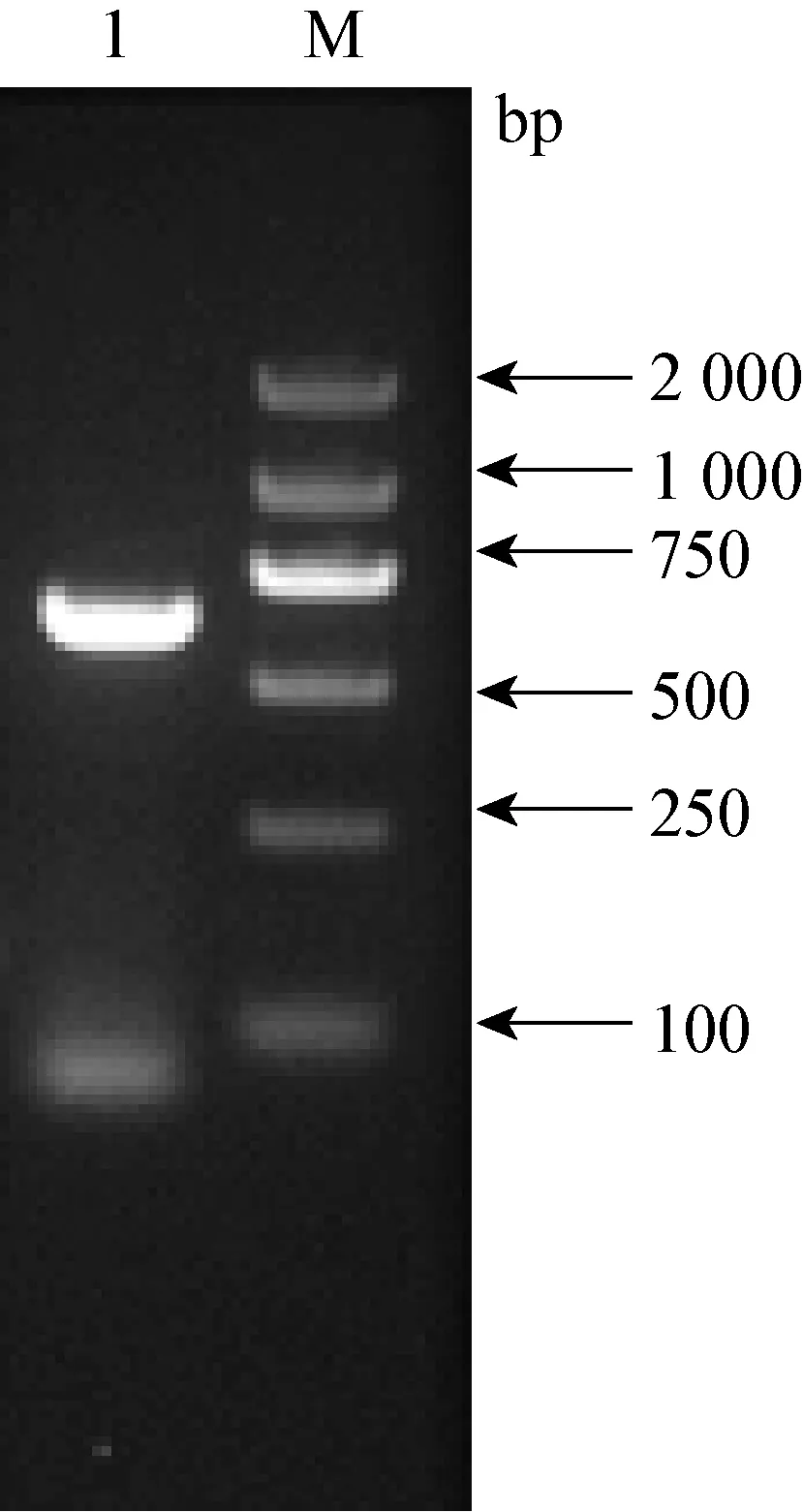
圖1 pcr擴增圖
2.2 蛋白的誘導表達與可溶性分析 將pET-21a-K205R 重組質粒轉化感受態大腸桿菌BL21(DE3)細菌,獲得pET-21a-205R-BL21 菌株,pET-21a-K205R-BL21 菌株經誘導表達后,在分子量為31 kDa的附近出現了一條明顯的表達蛋白。K205R 蛋白報道分子量約為23.7 kDa,其融合蛋白兩端均有6×組氨酸,根據DNA序列推算該融合蛋白分子量為30.3 kDa。結果表明,在37 ℃誘導后培養6 h后,蛋白表達量最高,說明重組質粒pET-21a-K205R在BL21細胞中成功表達。通過對菌體裂解液的上清和沉淀分析發現,K205R蛋白在上清和包涵體中均有表達。圖2中表達蛋白泳道偏后,可能與蛋白親水性有關。
2.3 蛋白的純化 在非變性條件下,利用Ni-NTA預裝柱對菌體裂解產物上清中的重組K205R蛋白進行純化。收集beads上的洗脫蛋白,經陰離子交換柱純化,收集蛋白,濃縮至1.5 mg/mL。
2.4 K205R蛋白的抗原性分析 取純化后的重組K205R蛋白做SDA-PAGE,以ASFV陽性血清作為一抗、豬陰性血清作為對照進行Western Blot檢測。結果表明,重組K205R蛋白可以與ASFV陽性血清發生特異性反應,具有良好的抗原性(圖5)。
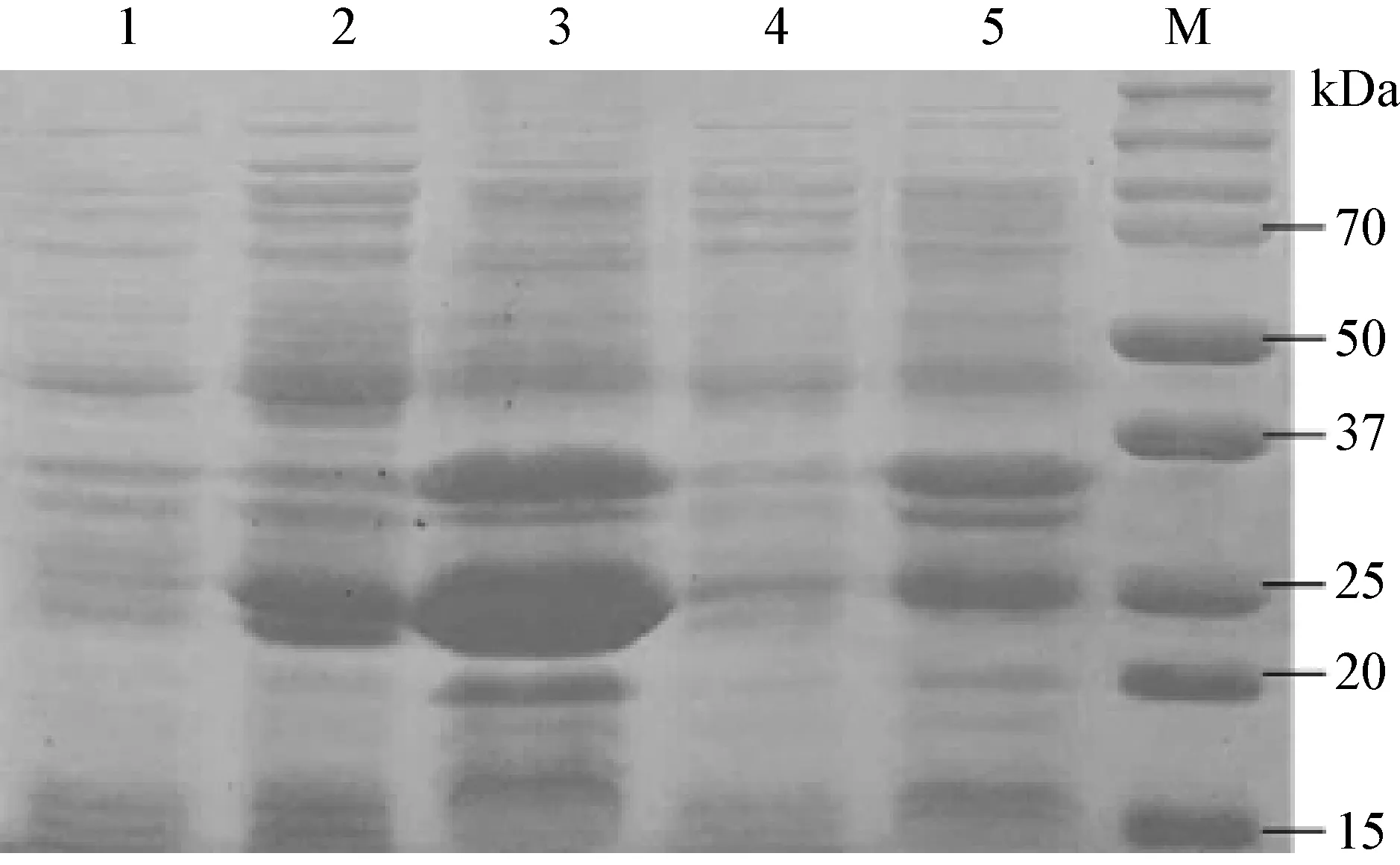
圖2 重組K205R蛋白在E.coli BL21(DE3)中誘導表達情況的SDS-PAGE分析
1:未誘導的BL21空菌菌體蛋白全菌; 2:37 ℃誘導6 h的pET-21a-K205R-BL21菌體裂解產物的上清; 3:37 ℃誘導6 h的pET-21a-K205R-BL21菌體裂解產物的沉淀; 4:16 ℃誘導6 h的pET-21a-K205R-BL21菌體裂解產物的上清; 5:16 ℃誘導6 h的pET-21a-K205R-BL21菌體裂解產物的沉淀;M:蛋白質相對分子質量標準
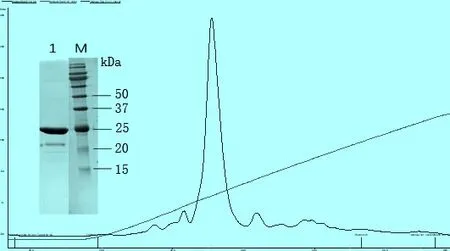
圖3 純化后的K205R蛋白的SDS-PAGE分析及AKTA 陰離子柱純化圖1:純化后的K205R蛋白; M:蛋白質相對分子質量標準
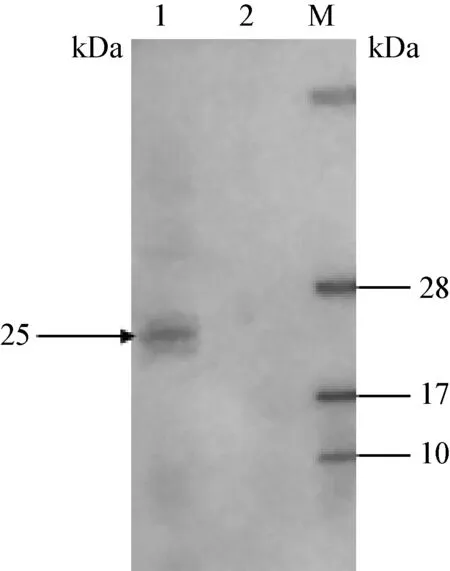
圖4 Western Blot檢測K205R蛋白抗原性
2.5 多抗效價測定 以純化的重組K205R蛋白為包被抗原,利用間接ELISA法測定純化后的多抗效價,以多抗孔的OD值與陰性對照孔的OD值的(P/N)大于2.1時為多抗的最高稀釋度,即為多抗效價。結果表明,純化后的多抗效價為1∶128 000。
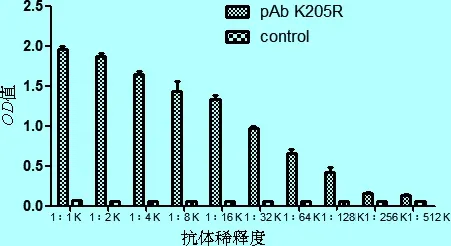
圖5 ELISA檢測多抗效價
3 討論
非洲豬瘟(African swine fever,ASF)是一種極為復雜的傳染性疾病,病死率高達100%,被OIE列為通報疫病[6]。ASF最早于1909年在非洲發現,目前,大約有49個國家曾流行或正在流行該病,包括亞洲、非洲、歐洲等國家[7-8]。2007年俄羅斯報道發生ASFV疫情,截止到2016年,俄羅斯境內暴發ASF疫情共831起[9]。迄今為止,我國并沒有發生ASF,但隨著進出口貿易的發展及人員的頻繁流動,我國形勢嚴峻,毫無疑問,該病一旦傳入,必將對我國的養殖業以及國家經濟構成嚴重威脅。目前并沒有有效的疫苗,因此建立準確有效的檢測方法勢在必行。
目前OIE確診ASF的方法是以活病毒為抗原對疑似病例進行ELISA檢測其是否含有ASFV特異性抗體,并利用免疫印跡法對疑似陽性樣品進行確診。由于該方法對實驗室級別要求很高,且對于活病毒的處理也有一定的風險,所以研究一種方便、簡潔、安全的檢測方法顯得尤為重要[10]。有研究表明,在檢測歐洲血清中,重組病毒蛋白可以提高檢測的靈敏度與特異性[11]。K205R基因是ASFV的保守特異性基因,Gallardo等人利用ASFV的Ba71v毒株感染Vero細胞,發現在病毒感染早期K205R蛋白在整個細胞中呈彌散性表達,但在純化的病毒中并未發現K205R蛋白,這提示我們K205R蛋白可能有助于區分持續感染的動物和免疫過的動物[5]。重組的K205R蛋白具有很強的免疫原性,能誘導機體產生強烈的免疫應答。
K205R蛋白是可溶性蛋白,方便制備與純化,且原核表達操作簡單,成本低。本研究利用原核表達載體pET-21a構建重組質粒pET-21a-K205R,IPTG 37 ℃誘導6 h獲得大量表達重組K205R 蛋白的菌體,通過鎳柱及陰離子交換柱純化蛋白,經ASFV陽性血清檢測,重組K205R蛋白抗原性較好。利用重組K205R蛋白為抗原免疫兔子,制備兔多克隆抗體,間接ELISA法結果顯示,該抗體效價較高。ASFV重組K205R蛋白及其多克隆抗體的成功制備,為非洲豬瘟ELISA檢測方法的建立提供了良好的生物材料。

