豬圓環病毒2型Taqman探針法實時熒光定量PCR檢測方法的建立
石 林,吳 瑗,巴少波,劉正奎,陳 琳,王 磊,邵春艷,孫 靜,周瑩姍,王曉杜,宋厚輝
(1.浙江農林大學 動物科技學院,浙江 杭州311300;2.金華職業技術學院 農業與生物工程學院,浙江金華 321007)
豬圓環病毒2型(porcine circovirus type 2,PCV2)是引起豬Sus scrofa圓環病毒相關綜合征(PCVAD)的主要病原體之一,主要引起斷奶仔豬多系統衰竭綜合征(PMWS)、母豬繁殖障礙、豬呼吸道疾病綜合癥(PRDC)、豬皮炎與豬腎病綜合癥(PDNS)、腸炎和先天性震顫等疾病[1-2]。PCV2對外界和一般消毒劑的抵抗力較強,在酸性環境及氯仿中可以存活較長時間甚至在高溫環境(72℃)也能存活一段時間。PCV2易通過胎盤垂直傳播,感染豬群的免疫功能下降后發病,常與豬繁殖與呼吸綜合癥病毒(PRRSV)或豬細小病毒(PPV)混合感染,也易繼發豬副嗜血桿菌或豬鏈球菌2型感染[3]。PCV2主要感染哺乳期和育成期的仔豬,尤其5~12周齡仔豬特別易感,常并發或繼發細菌感染而導致死亡率大大增加[4]。PCV2最早發現于加拿大,后蔓延至美國、西班牙、英國、丹麥、德國、荷蘭、比利時、日本和韓國等,發病率為10%~80%,死亡率為15%~30%[5]。PCV2在中國豬群中早已存在,2002年后發病豬群逐漸增多,死亡率為20%~30%[6-7]。臨床上防控該病主要采用疫苗接種方法,雖然控制了大規模流行的趨勢,但是一些飼養管理不當的養殖場仍然存在較高的發病率。為及時診斷該疾病,及早接種疫苗和加強生物安全措施,亟需建立起一種高靈敏性、快速高效的檢測方法,以減少疾病所導致的損失。實時熒光定量聚合酶鏈式反應(PCR)技術是一種簡單、快速、靈敏度高的檢測技術,應用到動物疫病診斷上,主要采用基于SYBR Green I和Taqman探針的2種熒光定量檢測方法,相比而言,Taqman探針靈敏性更高。因此,本研究擬利用針對PCV2的ORF1基因特異引物和TaqMan探針,建立一種實時熒光定量PCR檢測技術,為PCV2的實驗室診斷和疫病預警預報提供檢測工具。
1 材料和方法
1.1 病毒
豬圓環病毒(PCV2)、豬瘟病毒(CSFV)、豬繁殖與呼吸障礙綜合征病毒(PRRSV)均由浙江農林大學動物預防醫學與公共衛生實驗室保存,豬流行性腹瀉病毒(PEDV)-豬傳染性胃腸炎病毒(TGEV)-輪狀病毒(RV)三聯疫苗購自哈爾濱維科生物技術有限公司。
1.2 實驗方法
1.2.1 引物與探針的設計 從GenBank中下載PCV2特異性的ORF1基因(Genbank:MF616438.1)序列,利用Beacon Designer 7軟件找出該基因上的高保守序列,設計1對特異引物和1條帶有FAM(6-羧基熒光素)標記和碎滅為MGB(Minor Groove Binder,小溝結合物)的Taqman探針。上游引物(ORF1-F)序列:5′-TAGATCTCAAGGACAACGGAGTGA-3′; 下游引物(ORF1-R)序列:5′-GTTACAGGGTGCTGCTCTGCA-3′;探針序列:5′-FAM-CAGACTCCCGCTCTC-MGB-NFQ-3′。所有序列均由上海金唯智生物科技有限公司合成。
1.2.2 陽性質粒標準品的構建 應用特異引物(ORF1-F/R),以PCV2的DNA為模板進行PCR擴增。反應條件為94℃ 5 min;98℃ 10 s,60℃30 s,72℃ 30 s,40個循環;72℃ 10 min,15℃ 5 min。利用DNA凝膠回收試劑盒(上海生工生物有限公司)純化回收PCR產物,連接至pMD18-T(大連寶生物工程有限公司)克隆載體后,轉化大腸埃希菌Escherichia coli(DH5α)感受態細胞。經藍白斑篩選得到陽性克隆,用菌落PCR和質粒PCR鑒定獲得陽性重組質粒(命名為pSL1353),送生物公司(上海金唯智生物科技有限公司)測序驗證。所獲質粒經核酸蛋白濃度測定儀測定濃度和純度,置于-20℃備用。
1.2.3 實時熒光定量PCR反應條件的優化 配制實時熒光定量PCR的反應體系,其中上、下游引物各0.4 μL, SYBRPremix EXTaq10.0 μL, 模板(pSL1353) 2.0 μL, 超純水補足至 20.0 μL。 對反應條件進行優化,分別設置退火溫度為54,56,58,60和62℃,以獲得該方法的最佳退火溫度。分別采用0.2,0.3,0.4和0.5 μmol·L-1的引物濃度,構建PCR反應體系,確定該方法的最佳引物濃度。采用0.1, 0.2, 0.3, 0.4 和 0.5 μmol·L-1的探針濃度, 上、 下游引物各 0.4 μL, rTaq酶和 dNTP 混合物 10.0μL,模板(pSL1353,超純水為空白對照)2.0 μL,超純水補足至20.0 μL,確定最佳Taqman探針濃度。
1.2.4 實時熒光定量PCR反應標準曲線建立及線性范圍 將1.2.2得到的pSL1353質粒以10倍梯度稀釋成 1013, 1012, 1011, 1010, 109, 108, 107和 106拷貝·L-1; 以 1.2.3 得到的優化條件進行熒光定量 PCR擴增,重復3次·濃度-1;以陽性重組質粒拷貝數為橫坐標,以各濃度下的循環數(Ct)值為縱坐標,建立Taqman探針實時熒光定量PCR 標準曲線。 其中拷貝數計算公式: 拷貝數(拷貝·L-1)=質粒濃度(g·L-1)×阿弗加德羅常數/重組質粒分子量[8]。
1.2.5 實時熒光定量 PCR敏感性試驗 將 pSL1353質粒稀釋成 1 000×106,100×106,50×106,20×106, 5×106和 106拷貝·L-1, 設置 6 重復·濃度-1, 測定各濃度下的循環數(Ct), 用 PODLOD calculation program(version 8)[9]計算本檢測方法的最低檢測限值。
1.2.6 實時熒光定量PCR重復性試驗 以空白模板對照,檢測已知的PCV2 DNA樣品,間隔1周做重復試驗, 重復 3 次·樣品-1(組間); 檢測已知的 3 個 PCV2 DNA 樣品(1013, 1012, 1011拷貝·L-1), 重復 6個·樣品-1(組內)。 計算組內和組間變異系數(CV),驗證該方法的重復性。其中SCt為Ct的標準差,為Ct的平均值。
1.2.7 實時熒光定量PCR特異性試驗 以1.2.3建立的PCV2 Taqman探針實時熒光定量方法同時對CSFV,PRRSV,PEDV/TGEV/RV進行檢測,以空白模板為對照,確定該方法的特異性。
1.2.8 臨床樣品的檢測 以1.2.3建立的PCV2 Taqman探針實時熒光定量方法檢測2016-2017年杭州市周邊地區規模化生豬養殖場送檢的50份疑似病料(腹股溝淋巴結)。
2 結果與分析
2.1 PCV2陽性標準品的制備
以PCV2疫苗毒株所提取的DNA為模板,利用特異性引物(ORF1-F/R)擴增出大小約100 bp的片段;擴增產物回收后借助T/A克隆技術,構建pMD18-T-PCV2-ORF1載體(pSL1353),經菌落PCR和質粒PCR鑒定為陽性克隆(圖1)。測序驗證其序列,發現與NCBI上PCV2的序列(GenBank:KY940521.1)同源性達 100%。提取pSL1353質粒作為本研究方法的陽性質控,可以作為判斷試驗成立與否的陽性模板。
2.2 實時熒光定量PCR反應體系及反應程序的優化
依據1.2.3,發現退火溫度為60℃時擴增效率最高。在PCV2質粒濃度1013拷貝·L-1時進行反應條件優化,根據有典型擴增曲線且Ct值最小的原則, 發現上、 下游引物濃度 0.2 μmol·L-1(圖 2A)和探針濃度 0.2 μmol·L-1(圖 2B)時擴增效果最佳。 該結果可作為試劑盒開發及成本控制的理論依據。
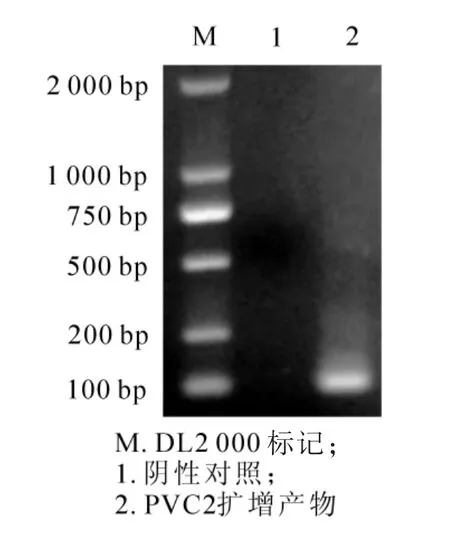
圖1 陽性標準質粒的PCR鑒定Figure 1 Identification of positive standard plasmids by PCR
2.3 實時熒光定量PCR標準曲線的建立
將稀釋(1013, 1012, 1011, 1010, 109, 108, 107, 106拷貝·L-1)后的重組質粒作為模板, 在 2.2 的 Taqman探針實時熒光定量PCR優化條件下進行擴增(圖3A),得到標準曲線如圖3B所示,其線性回歸方程為Ct=-0.671 4×lgA+38.16,其中A為模板濃度。相關系數(R2)為0.974 5,表明本研究所建立的方法在模板為2.1×1013~2.1×106拷貝·L-1時,檢測到Ct值和模板之間具有較好的線性關系。
2.4 實時熒光定量PCR的重復性
選取2.3中1013,1012,1011拷貝·L-1陽性質粒為模板,在2.2優化條件下進行重復試驗。結果表明:組內樣品擴增曲線重復性較好(圖4),組內與組間Ct值的變異系數較小(表1),表明該檢測方法有較好的重復性。
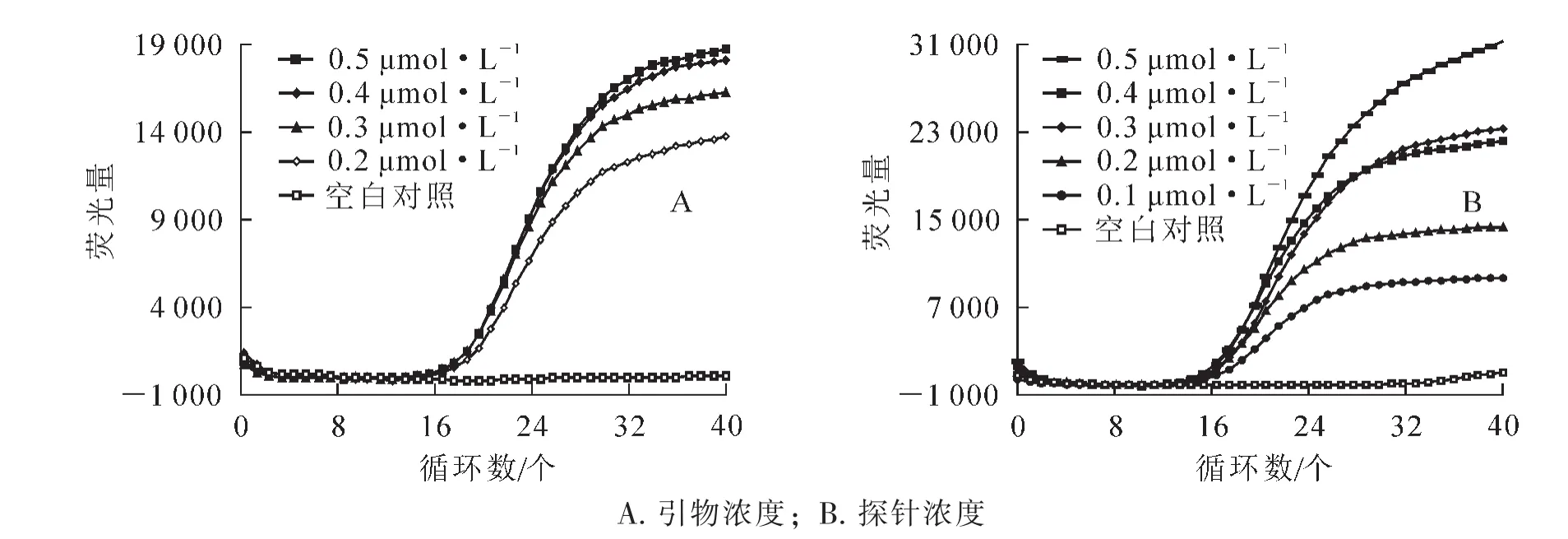
圖2 反應體系和反應條件的優化Figure 2 Optimized system and conditions of reaction of PCV2

圖3 實時熒光定量PCR標準曲線的建立Figure 3 Standard curve of the real-time quantitative PCR of PCV2
2.5 實時熒光定量PCR的靈敏性
陽性標準質粒 pSL353分別按照 1 000×106,100×106, 50×106, 20×106, 5×106和 106拷貝·L-1, 重復 6 次·濃度-1,進行實時熒光定量 PCR擴增,有典型的擴增曲線且Ct值小于38時判斷為陽性。結果表明:每個濃度均具有較好的重復(圖5)。PODLOD V8軟件[9]公式計算,得到該方法的最低檢測線為 8.828×106拷貝·L-1(95%的檢測限)(表 2)。

圖4 PCV2實時熒光定量PCR重復性試驗擴增曲線Figure 4 Amplification curve of repetitive assay PCV2
2.6 實時熒光定量PCR的特異性
分別以 PCV2的基因組 DNA,PEDV,TGEV,PEDV/TGEV/RV三聯疫苗的cDNA為模板,利用1.2.3構建的檢測方法進行實時熒光定量PCR擴增。結果表明:PCV2病毒組有特征性擴增曲線,其他各組則沒有,說明該方法具有較好的特異性(圖6),為臨床疾病混合感染情況下準確檢測PCV2提供了工具。
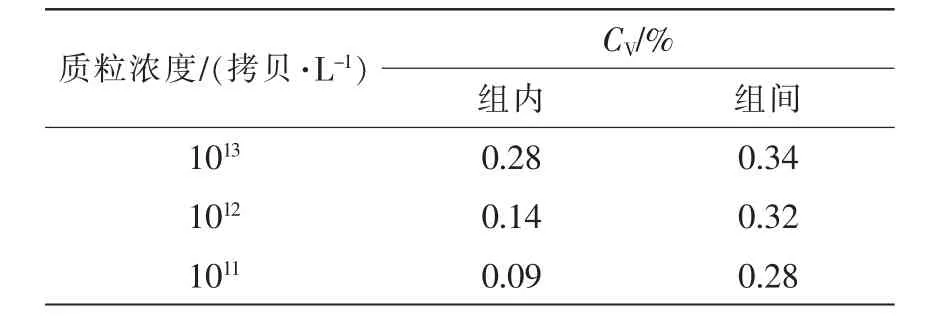
表1 實時熒光定量PCR的重復性驗證Table 1 Repetitive assay of the real-time quantitative PCR
2.7 臨床樣品的檢測
以實驗室收集到的2016-2017年杭州市周邊地區規模化生豬養殖場的50份PCV2疑似病料(腹股溝淋巴結)為檢測樣本,提取樣本中的DNA,利用本研究的PCV2實時熒光定量PCR檢測方法進行檢測。結果表明:送檢50份樣品中該方法檢出40份陽性,待檢樣品的PCV2陽性率達80%(表3),與普通PCR檢測結果基本一致。
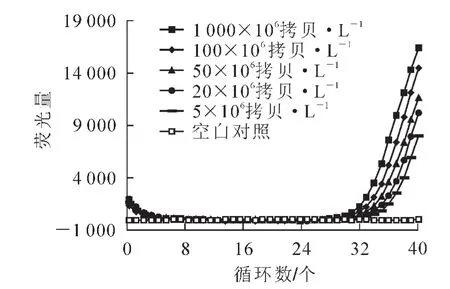
圖5 PCV2的實時熒光定量PCR靈敏性擴增曲線Figure 5 Amplification curve of sensitivity assay of PCV2
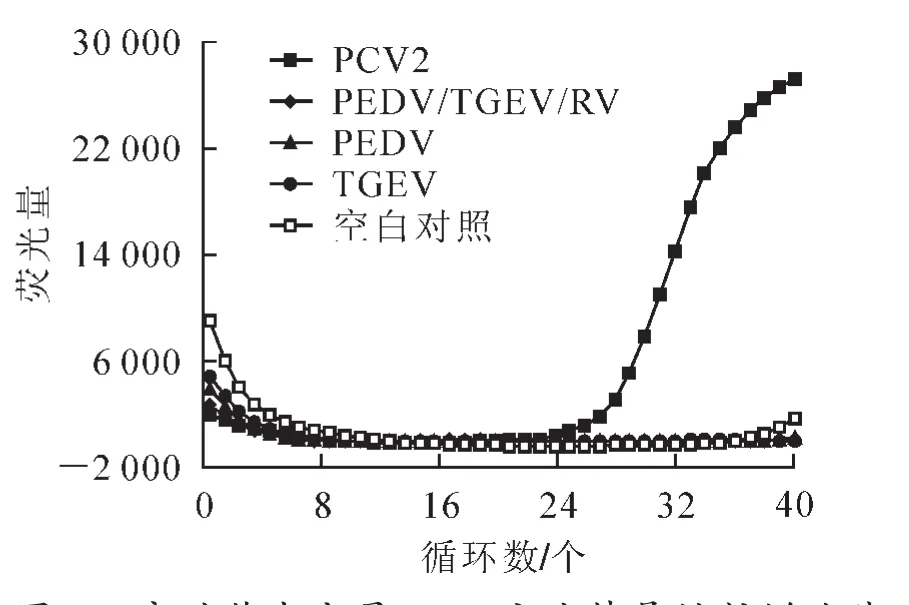
圖6 實時熒光定量PCR方法特異性擴增曲線Figure 6 Amplification curve of specificity analysis
3 討論
PCV2是目前規模化豬場疾病防控中最重要的病原體之一,通常伴隨細菌感染[10],因此要檢定出PCV2,需要建立高度靈敏的檢測方法。YANG等[11]建立的基于SYBR Green I檢測 PCV2 的方法檢測范圍是 109~1017拷貝·L-1, 鄭蘭蘭等[12]建立的PCV2和PRV二重SYBR Green I熒光定量PCR方法對PCV2的檢測靈敏度是215×106拷貝·L-1;本研究建立的方法能檢測PCV2病毒基因組DNA最低濃度達到為8.825×106拷貝·L-1,比常規PCR和基于SYBR Green I的熒光定量PCR更加靈敏。影響實時熒光定量PCR方法的靈敏度涉及許多因素,如樣品來源的復雜程度,引物和探針特異性,體系及擴增條件等,其中引物和探針的設計是最重要的關鍵點。SYBR Green I法是基于熒光染料與雙鏈DNA結合后檢測熒光值來判斷產物的量,而Taqman探針法則是基于DNA酶的5′外切酶活性對探針的切割后,熒光信號的強弱判斷擴增產物的量,因而探針的特異結合使得該方法具有更高的特異性。本研究針對PCV2的ORF1保守區域設計特異引物,有利于擴增PCV2所有基因型的毒株,其探針則是基于15堿基的特異序列,具有較高結合效率;普通Taqman探針一般為25~35 bp, 而MGB探針由于在普通Taqman 3′端特殊的設計,長度更短,一般為10到15 bp,因而靈敏性更高,同時還具有淬滅無熒光、背景低等特點。所以本研究采用的淬滅基團為MGB的Taqman探針,提高了檢測靈敏度,降低了背景值。
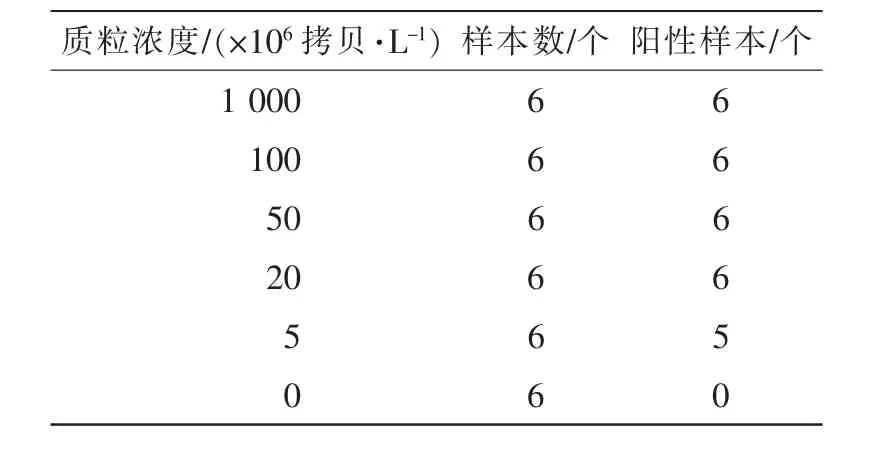
表2 實時熒光定量PCR的靈敏度Table 2 Sensitivity of the real-time quantitative PCR
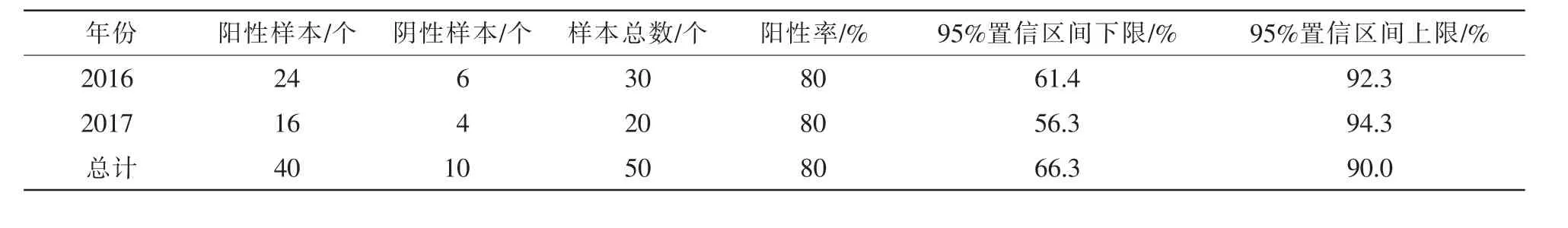
表3 實時熒光定量PCR方法檢測臨床樣品PCV2的結果Table 3 Results of detecting PCV2 from clinical samples by fluorescent quantitative PCR
基于ORF2(Cap)基因分類方法,分子流行病學分析認為PCV2在臨床上流行主要為 PCV2a,PCV2b 2個基因型[13],且后者的流行明顯超過前者;近期發現還存在PCV2c,2d,2e等基因型[14-15]。本研究在設計引物時針對相對保守的ORF1(Rep)基因,因此能夠檢測PCV2的所有基因型,為臨床診斷提供了可靠的檢測工具。

