超聲心動圖測量心外膜脂肪組織預測腦梗死
朱小虎,黃 楊,徐向東,賀亞群*
(1.成都醫學院第一附屬醫院超聲科,四川 成都 610500;2.成都醫學院臨床醫學院,四川 成都 610500)
中國2016年腦卒中防治報告[1]指出,我國每年約188萬人死于腦卒中。腦梗死是腦卒中的常見類型,占60%~80%;而血脂異常及不穩定性頸動脈粥樣硬化斑塊均是發生腦梗死的重要危險因素。如何早期防治動脈粥樣硬化的發生及發展,進而預防腦梗死,具有重要意義。心外膜脂肪組織(epicardial adipose tissue, EAT)是指心包膜壁層的脂肪組織,屬于內臟脂肪,受限于心包膜,其分布范圍較為局限,便于超聲觀察和測量。研究[2]發現EAT厚度的變化與代謝綜合征的發生率呈正相關,且與動脈粥樣斑塊形成和發展相關[3]。本研究探討EAT與腦梗死的相關性,以期為預測腦梗死提供影像學參考。
1 資料與方法
1.1 一般資料 收集2016年4月—2017年4月于我院住院的腦梗死患者133例(病變組),男70例,女63例,年齡60~74歲,平均(67.8±4.1)歲;根據《中國急性缺血性腦卒中診治指南2010》[4],其中腔隙性腦梗死(lacunar infarction, LI;LI亞組)[5-6]57例,男27例,女30例,年齡60~74歲,平均(66.8±3.9)歲;非腔隙性腦梗死(non-lacunar infarction, NLI;NLI亞組)76例,男43例,女33例,年齡60~74歲,平均(68.5±4.2)歲。選取同期年齡、性別與病變組相匹配,無臨床癥狀并經CT或MR確診無腦梗死的61例患者為對照組,男33例,女28例,年齡61~74歲,平均(66.7±3.5)歲。排除標準:自身免疫性疾病、心包積液、先天性心臟病、腦出血、腦外傷、顱腦動脈介入治療術后等疾病。記錄所有受檢者甘油三酯(triglyceride, TG)、總膽固醇(total cholesterol, TC)、高密度脂蛋白膽固醇(high-density lipoprotein cholesterol, HDL-C)、低密度脂蛋白膽固醇(low-density lipoprotein cholesterol, LDL-C)、脂蛋白及同型半胱氨酸(homocysteine, HCY)。本研究經我院倫理委員會批準,受檢者均簽署知情同意書。
1.2 儀器與方法 采用GE Vivid E9彩色多普勒超聲診斷儀,心臟探頭M5Sc,頻率1~5 MHz。測定EAT厚度:囑患者左側臥,將探頭置于胸骨旁及心尖搏動點,顯示胸骨旁左心室長軸切面及心尖四腔心切面,存儲5個心動周期動態圖像。由2名主治以上職稱醫師分別調取留存圖像,于左心室長軸切面及心尖四腔心切面分別測量右心室前壁及心尖切跡處EAT厚度,在收縮末期垂直測量心肌外側和心包臟層間的相對低回聲區(圖1、2);連續測量3個心動周期;取平均值。
1.3 統計學分析 采用SPSS 19.0統計分析軟件,對數據行正態性和方差齊性檢驗,符合正態分布的計量資料以±s表示,非正態分布的數據以中位數(上下四分位數)表示。采用單因素方差分析比較病變組各亞組與對照組間一般資料、右心室前壁EAT厚度及心尖部EAT厚度的差異,兩兩比較采用SNK檢驗。以Spearman相關性分析評價TG、TC、HDL-C、LDL-C、脂蛋白、HCY、右心室前壁EAT厚度、心尖部EAT厚度與腦梗死的相關性;∣r∣≤0.3時為低度相關,0.3<∣r∣≤0.6為中度相關,0.6<∣r∣≤0.8時為相關性較高,∣r∣≥0.8時為高度相關。繪制右心室前壁EAT厚度的ROC曲線,計算AUC,評價右心室前壁EAT厚度診斷腦梗死的價值,并確定診斷閾值:AUC<0.5為無診斷價值,0.5~0.7為診斷價值較低,>0.7~0.9為診斷價值較好,AUC>0.9為診斷價值好。P<0.05為差異有統計學意義。
2 結果
病變組各亞組與對照組一般資料比較差異均無統計學意義(P均>0.05,表1)。
病變組各亞組與對照組右心室前壁EAT厚度差異有統計學意義(P=0.037),其中NLI亞組右心室前壁EAT明顯厚于LI亞組及對照組(P均<0.05),而LI亞組與對照組之間差異無統計學意義(P>0.05)。病變組各亞組與對照組心尖部EAT厚度差異無統計學意義(P=0.772,表2)。
表1 病變組各亞組與對照組一般資料比較(±s)
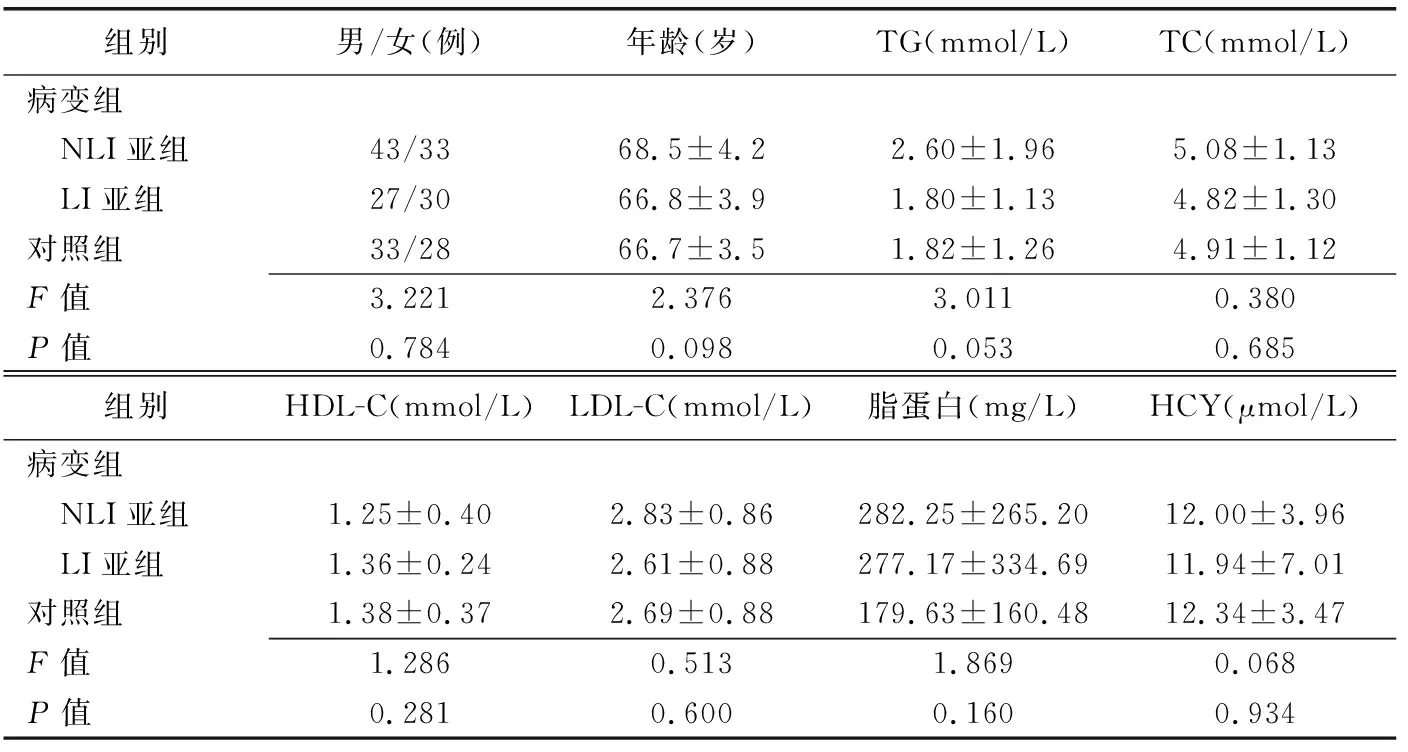
表1 病變組各亞組與對照組一般資料比較(±s)
組別男/女(例)年齡(歲)TG(mmol/L)TC(mmol/L)病變組 NLI亞組43/3368.5±4.22.60±1.965.08±1.13 LI亞組27/3066.8±3.91.80±1.134.82±1.30對照組33/2866.7±3.51.82±1.264.91±1.12F值3.2212.3763.0110.380P值0.7840.0980.0530.685組別HDL-C(mmol/L)LDL-C(mmol/L)脂蛋白(mg/L)HCY(μmol/L)病變組 NLI亞組1.25±0.402.83±0.86282.25±265.2012.00±3.96 LI亞組1.36±0.242.61±0.88277.17±334.6911.94±7.01對照組1.38±0.372.69±0.88179.63±160.4812.34±3.47F值1.2860.5131.8690.068P值0.2810.6000.1600.934
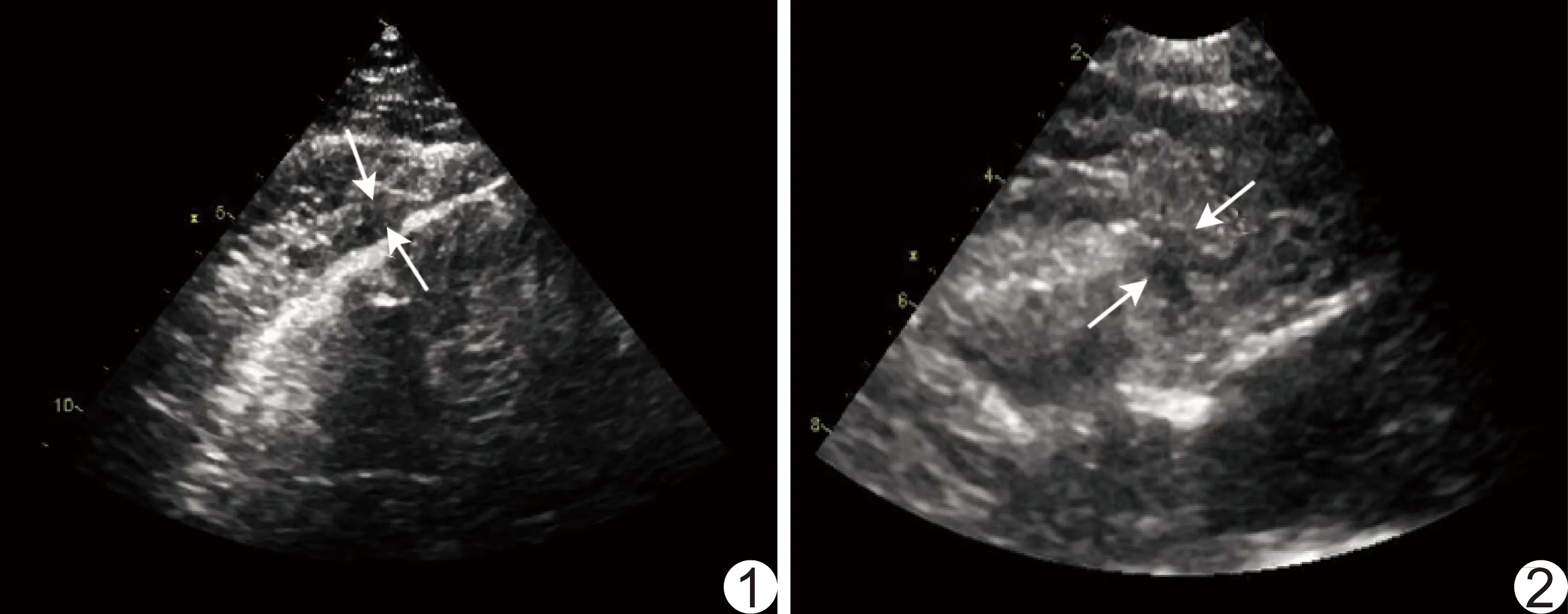
圖1 心尖切跡處EAT厚度測量示意圖 箭示四腔心切面心尖切跡處心肌與臟層心包之間的低回聲區 圖2 右心室前壁EAT厚度測量示意圖 箭示左心室長軸切面右心室前壁心肌與臟層心包之間的低回聲區
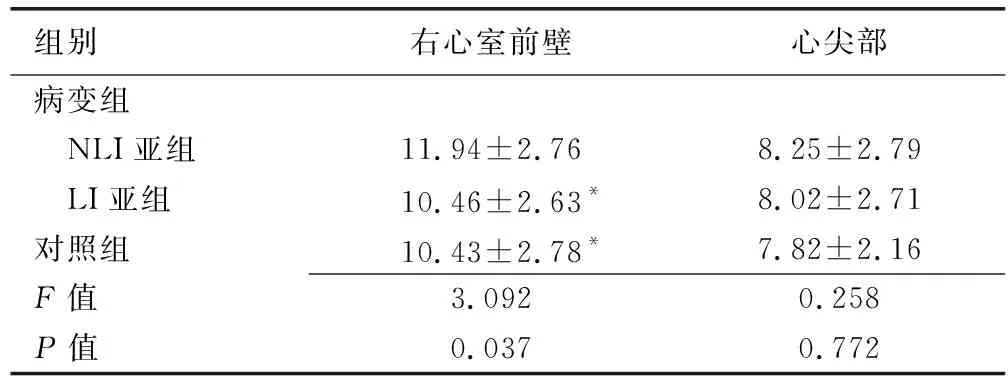
組別右心室前壁心尖部病變組 NLI亞組11.94±2.768.25±2.79 LI亞組10.46±2.63*8.02±2.71對照組10.43±2.78*7.82±2.16F值3.0920.258P值0.0370.772
注:*:與NLI亞組比較,P<0.05
右心室前壁EAT增厚與NLI發生呈低度正相關(r=0.277,P=0.006),與LI發生無明顯相關性(r=0.056,P=0.679);而TG(r=0.184、0.052)、TC(r=0.059、0.556)、HDL-C(r=0.167、0.099)、LDL-C (r=0.048、0.477)、脂蛋白(r=0.192、0.639)、HCY (r=0.048、0.059)及心尖部EAT(r=0.072、0.481)與NLI及LI均無明顯相關性(P均>0.05)。
右心室前壁EAT診斷NLI的AUC為0.690(P=0.006),診斷閾值為11.54 mm,敏感度63.94%,特異度76.32%(圖3)。
3 討論
動脈粥樣硬化是發生腦梗死的重要危險因素,其發生、發展與體內脂代謝異常、多種抗炎及促炎因子的釋放密切相關[7-8]。內臟脂肪不僅具有儲能作用,同時也是活躍的代謝器官,具有內分泌功能,可通過分泌及釋放多種生物活性蛋白、抗炎因子及促炎性脂肪因子影響局部乃至全身動脈粥樣硬化[9-11]。既往研究[12-13]發現,動脈粥樣硬化斑塊患者EAT體積明顯大于無斑塊者,且EAT與非鈣化斑塊具有相關性。EAT為內臟脂肪的一部分,由于位置局限,便于超聲觀測,且可重復性較好,故被認為是一種新的心血管監控指標而受到關注。
EAT增厚可在一定程度上代表內臟脂肪含量增加[14],而內臟脂肪增加表明體內脂肪代謝出現異常,繼而相應的各類生物活性蛋白以及各類炎癥因子等的數量和活性也相應增加,從而導致動脈粥樣硬化發生率增高,腦梗死發生率也相應增加。本研究中,病變組各亞組與對照組右心室前壁EAT厚度差異有統計學意義,其中NLI亞組右心室前壁EAT明顯厚于LI亞組及對照組,而LI亞組與對照組間差異無統計學意義,且右心室前壁EAT厚度增加與NLI發生呈低度正相關,提示觀察EAT厚度的變化可在一定程度上為臨床預防和監控NLI提供影像學信息。
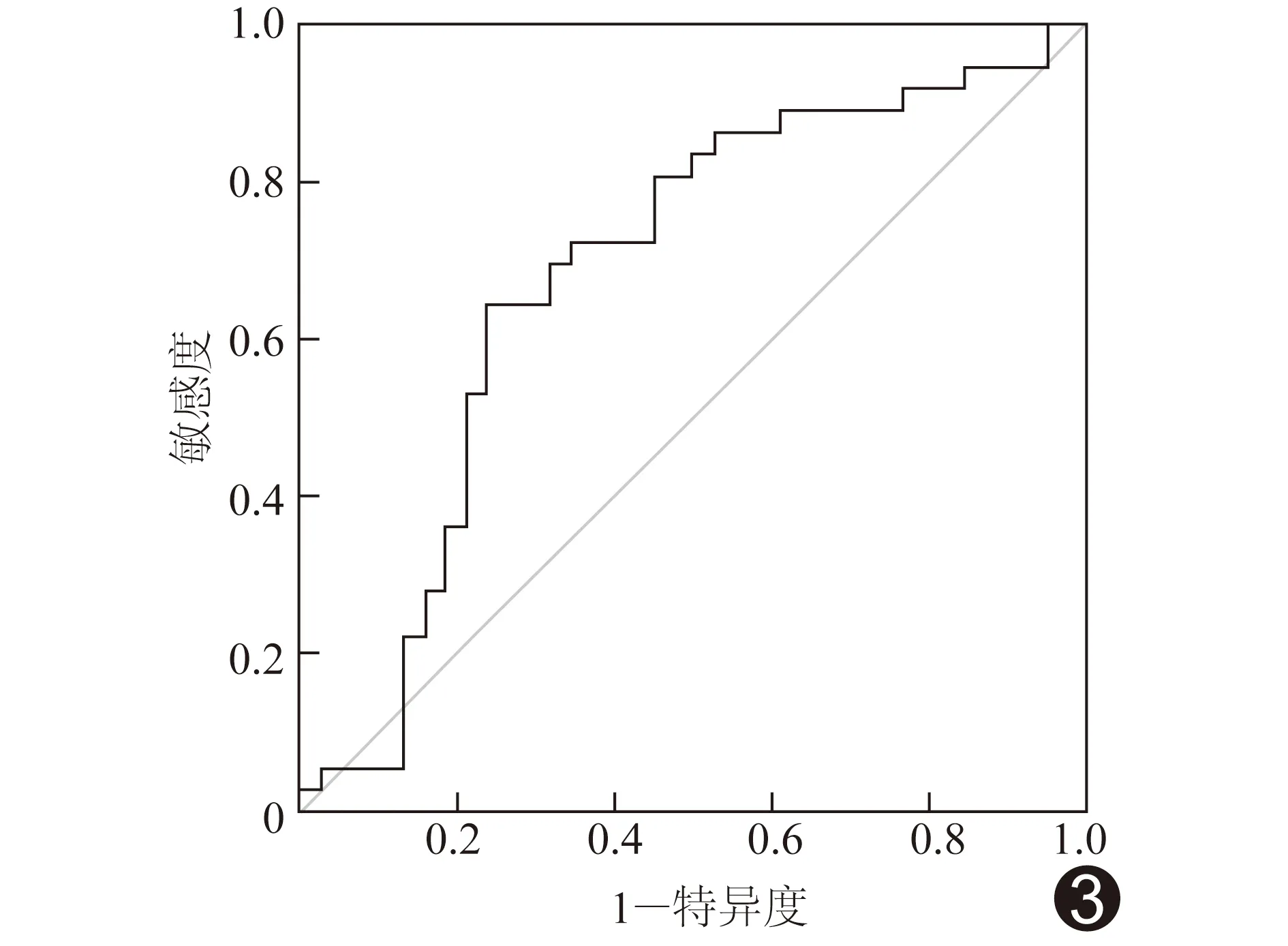
圖3 右心室前壁EAT厚度診斷NLI的ROC曲線
EAT厚度增加是基于形態學的變化,其發生晚于血脂等血生化指標變化,理論上其預測價值應不及血生化指標。本研究中TG、TC、HDL-C、LDL-C、脂蛋白及HCY與腦梗死無明顯相關性(P均>0.05),分析原因,可能在于部分患者使用了降脂類藥物,導致對于血脂與腦梗死的統計結果存在偏差,而右心室前壁EAT厚度增加則與NLI發生呈低度正相關。
本研究中,病變組各亞組與對照組心尖部EAT厚度差異無統計學意義,分析原因,可能在于:①與EAT分布不均有關,EAT解剖結構以右心室前壁厚度最大,左心室下壁厚度最小,故超聲心動圖對右心室前壁EAT顯示清晰,測量脂肪厚度更精確[15];②樣本量較小;③不同測量者對EAT厚度的主觀判斷也會對數據及結果造成一定影響。LI亞組與對照組右心室前壁EAT差異無統計學意義,可能是由于LI本身的發病因素與NLI存在一定差別,如糖尿病史、纖維蛋白原水平升高、心房顫動和頸動脈斑塊以及過量吸煙或飲酒史發生NLI的風險高于LS[16-17]。
綜上所述,右心室前壁EAT增厚與NLI發生呈低度正相關,當右心室前壁EAT厚度大于11.54 mm時,NLI的發生風險增高。超聲心動圖測量EAT可為臨床預防NLI提供有價值的影像學信息。

