鈣、鋅離子存在下萬古霉素與牛血清白蛋白的作用機制研究
任列香, 馬建春, 霍宇平, 楊 斌
(呂梁學院化學化工系,山西 離石 033000)
萬古霉素(vancomycin,以下簡稱VAC)屬于一種強勁藥效的糖肽類大分子抗生素物質,主要用于葡萄球菌(包括耐青霉素和耐新青霉素株)、難辨梭狀芽孢桿菌等所致的系統感染和腸道感染性疾病的治療,如,心內膜炎、偽膜性腸炎、敗血癥等。
蛋白質是人類生命的物質基礎,約占人體總質量的18%,是一種具有生理功能的生物有機大分子,是構成細胞的基本有機體,是人體細胞和組織的重要組成部分,同時也是藥物發揮藥效的靶分子和重要載體物質[1-4]。血清白蛋白(serum albumin)是一種脊椎動物血液血漿中最豐富、最容易純化的蛋白質,主要是在肝臟中合成,它在維持血液滲透壓、體內代謝物質的運輸和營養方面起著極其重要的作用,同時還能影響動脈血管的通透性。牛血清白蛋白(BSA),相對分子質量為66 000,其中,氮的含量約為16%,脂的含量約為0.2%,糖的含量約為0.08%。其組成成分主要包括581個氨基酸殘基基團,其結構中還包含有特殊的二硫鍵基團和自由巰基基團,這種自由巰基基團極易與某些小分子物質結合。牛血清白蛋白可以作為一種穩定劑、限制酶或修飾酶的保護溶液和反應液。一些酶在添加了牛血清白蛋白后可顯著提高其反應活性,所以也常將其作為負載型載體用于一些復合材料的制備和合成。牛血清白蛋白較容易得到,因此常被用作各種生化研究中人血紅蛋白的替代物質。牛血清白蛋白同時也是藥物發揮藥效的靶分子和承載性物質,它可以在藥物進入到生物有機體后直接參與藥物在機體內的有效代謝和吸收。迄今為止,藥物與機體內各種蛋白質的結合機制尚沒有明確的解釋。因此,在模擬生理條件下,經常在體外進行藥物蛋白結合的測定。在研究藥物與蛋白質相互作用時,牛血清白蛋白已經成為現階段最熱門的研究課題[5-10]。
當血清白蛋白與小的生物分子結合后,其性質會發生改變。分析彼此結合的兩者性質的變化,能夠判斷其結構信息。與各種內源性或外源性物質的相互作用,對于了解這些小生物分子在體內和代謝途徑中發揮作用具有重要意義,它為小生物分子的藥理學和毒理學的研究提供了一定的基礎。
鑒于此,本文通過熒光光譜法,考察研究了萬古霉素與牛血清白蛋白在Ca2+和Zn2+存在下的相互作用機制,結果表明,其相互作用機制為靜態猝滅機制,并通過計算得到在Ca2+、Zn2+存在下二者的結合常數,結果顯示,Ca2+、Zn2+兩種金屬離子的存在對于萬古霉素與牛血清白蛋白的相互作用基本無影響。
1 試劑及儀器
牛血清蛋白(BSA),濃度為1.1×10-5mol·L-1,sigma公司;萬古霉素(VCM),濃度為1×10-3mol·L-1,合肥博美生物科技有限公司,用時稀釋為5×10-4mol·L-1;氯化鈣溶液,濃度為1.0×10-3mol·L-1;Tris-HCl緩沖溶液,pH=7.4。
本實驗過程中所用水均為二次蒸餾水。
pHS-3C酸度計,上海佑科儀器儀表有限公司;F-380型熒光分光光度計,天津港東。
2 實驗方法
主要采用熒光光譜法:設置激發波長為280 nm,發射波長為290 nm~450 nm,狹縫寬度為2.5 nm,在F-380型熒光分光光度計上記錄290 nm~450 nm范圍內的發射光譜。
準確移取1.5 mL 1.0×10-5mol·L-1的BSA于1 cm×1 cm四通比色皿中,測量其熒光發射光譜,在此基礎上逐漸加入5.0×10-4mol·L-1的VCM溶液,繼續測量BSA的熒光發射光譜。
準確移取1.5 mL 1.0×10-5mol·L-1的BSA和15 μL 1.0×10-3mol·L-1的CaCl2溶液,反應30 min后按照上述方法依次加入VCM溶液繼續實驗。
準確移取1.5 mL 1.0×10-5mol·L-1的BSA和15 μL 1.0×10-3mol·L-1的ZnCl2溶液,同上述方法進行實驗。
3 結果與討論
3.1 VCM及其在Ca2+、Zn2+存在下與BSA猝滅機制的確定
熒光猝滅是指溶液中猝滅體分子和熒光物質分子之間的相互作用導致熒光物質的激發態壽命縮短或熒光量子產率和熒光強度降低的一種相互作用機制。圖1~圖3分別為VCM與BSA相互作用的熒光發射猝滅圖以及分別在Ca2+和Zn2+存在下VCM與BSA的相互作用熒光發射猝滅圖。對比圖1~圖3可知,隨著VCM濃度的增加,BSA的內源熒光強度有規律的降低,表明VCM與BSA之間發生了猝滅作用,并且,隨著VCM濃度的增大,作用增強。從圖2~圖3中還可以看到,金屬離子Ca2+、Zn2+的存在基本不影響VCM與BSA的作用,同時,BSA的最大發射峰值對應的波長基本不變,表明VCM對BSA的構象基本無影響。
根據Stern-Volmer方程[11-12]:F0/F=1+Kqτ0[Q]=1+KSV[Q],分別得到VCM與BSA以及在Ca2+和Zn2+存在下VCM與BSA作用的Stern-Volmer圖,見第17頁圖4~圖6。由圖4可知,VCM與BSA作用的猝滅常數是KSV=2.4×104L·mol-1,因為生物分子的熒光壽命為10-8s,所以,VCM對BSA的動態猝滅速率常數Kq=2.4×1012L·mol-1·s-1。同理,由圖5得到鈣離子存在下VCM與BSA作用的猝滅速率常數為Kq=2.05×1012L·mol-1·s-1,由圖6可得鋅離子存在下VCM與BSA作用的猝滅速率常數為Kq=2.32×1012L·mol-1·s-1。而猝滅劑和各種生物分子的最大猝滅常數是2.0×1010L·mol-1·s-1,而這3個猝滅常數均遠大于2.0×1010L·mol-1·s-1。因此,VCM在有、無金屬離子的存在下,與BSA的作用均屬于靜態猝滅機制。

圖1 萬古霉素與BSA的熒光光譜猝滅圖

圖2 鈣離子存在下萬古霉素與BSA的熒光光譜的猝滅圖

圖3 鋅離子存在下萬古霉素與BSA的熒光光譜的猝滅圖
3.2 VCM及其在Ca2+、Zn2+存在下與BSA結合位點數和結合常數的確定
研究大分子蛋白質與小分子藥物結合時,測定其結合位點和結合常數非常重要,可以利用這些信息了解蛋白質與藥物的最佳結合方式。當大分子蛋白質與小分子藥物結合時,其結合位點數n與結合常數KA可以由式(1)求出[13]。
lg[(F0-F)/F]=lgKA+nlg[Q]
(1)
按照公式lg[(F0-F)/F]—lg[Q]作雙對數曲線,擬合后可得第17頁表1。由表1可知,金屬離子Ca2+和Zn2+的存在,基本對VCM與BSA的結合作用無影響。表明金屬離子Ca2+和Zn2+的存在不影響人體對藥物VCM的吸收。
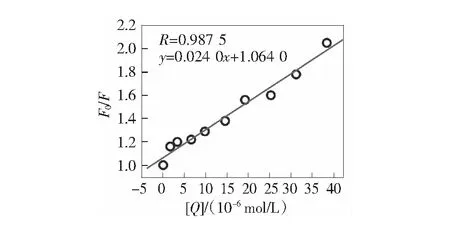
圖4 萬古霉素與BSA熒光猝滅的Stern-Volmer圖

圖5 鈣離子存在下萬古霉素與BSA

圖6 鋅離子存在下萬古霉素與BSA
4 結論
綜上所述,萬古霉素VCM與牛血清白蛋白BSA以及在金屬離子Ca2+和Zn2+存在下,VCM與BSA作用的熒光均猝滅,且猝滅過程屬于靜態猝滅。實驗過程中VCM與BSA以絡合比0.6∶1.0結合,結合常數為3.61×105L·mol-1。此外,還可得到金屬離子Ca2+和Zn2+的存在基本對VCM與BSA的結合能力無影響,即不影響人體對藥物VCM的吸收能力。

表1 VCM與BSA以及VCM+Mn++BSA的結合常數、結合位點、線性相關系數

