二價陽離子在低鹽水改變砂巖潤濕性中的作用
楊 杰, 董朝霞, 向啟貴, 雷 宇, 胡金燕, 彭 鋒, 王興睿
( 1. 中國石油西南油氣田分公司 安全環保與技術監督研究院,四川 成都 610000; 2. 中國石油大學(北京) 科學技術研究院,北京 102249; 3. 頁巖氣評價與開采四川省重點實驗室,四川 成都 610000 )
0 引言
巖心驅替實驗和現場礦場試驗等表明,向砂巖油藏中注入低濃度鹽水(一般注入水的礦化度低于5.0 g/L),能夠提高砂巖油藏采收率[1-6]。在低鹽水驅提高砂巖油藏采收率過程中,注入低鹽水可以改變巖石表面的潤濕性[7-9]。地層水中的二價陽離子通過低鹽水驅改變砂巖表面潤濕性,從而提高砂鹽油藏采收率[10-12]。當用精制模擬油(不含極性組分的油)進行實驗時,潤濕性沒有發生改變,Tang G Q等[13]提出,原油中的極性組分(尤其是酸性組分)在低鹽水改變砂巖表面潤濕性過程中具有重要作用。Ligthelm D J等[14]提出低鹽水效應(低鹽水提高采收率)的機理為雙電層擴散機理,即地層水中存在較多的二價陽離子(Ca2+),能夠充當橋梁作用,將原油中帶負電的酸性物質與負電性的砂巖表面連起來,使酸性物質吸附于砂巖表面,由于酸性組分另一端為石油烴,將導致砂巖表面親油性更強;注入低鹽水時,鹽水/石油(酸性組分)界面、礦物/鹽水界面之間的陽離子數量減少,兩個界面的負電性增強且靜電斥力增大,雙電層——酸性組分層、礦物表面發生擴散,當鹽水礦化度減小到一定程度時,靜電斥力超過二價陽離子架橋的力,酸性組分從礦物表面脫落,巖石表面親水性增強,從而提高砂巖油藏采收率。
Nasralla R A等[15]測試鹽水—原油—砂巖體系中鹽水接觸角,高鹽水在砂巖礦物表面的接觸角較大,表明砂巖表面親水性較弱,低鹽水在砂巖表面的接觸角較小,表明砂巖表面的親水性較強;Zeta電位測試結果表明,在高鹽環境下,油/水界面、砂巖表面的負電性很弱,Zeta電位的絕對值很小;隨鹽水礦化度降低,兩個界面負電性逐漸增強,Zeta電位的絕對值增大。Nasralla R A等[16]測試鹽水—原油—砂巖體系中鹽水接觸角和Zeta電位,鹽水濃度增大使巖石礦物表面、油/水界面的負電性減弱,也使巖石表面親油性增強。Rueslatten H G等[17]提出,當鹽水濃度較高時,原油中的酸性組分能與鹽水中的陽離子形成有機金屬配合物,配合物吸附于砂巖礦物表面,導致砂巖礦物表面油潤濕性增強。
Suijkerbuijk B等[18]提出,地層水中的二價陽離子(Ca2+)為“活性離子”,對原油中的酸性組分在巖石表面的吸附起主要作用,即酸性組分主要通過二價離子而非一價離子架橋吸附于巖石表面。當低鹽水注入地層時,鹽度較低,酸性油組分與巖石之間陽離子減少,兩者“雙電層”發生擴散,架橋的Ca2+斷裂,酸性油組分從巖石表面脫落,巖石潤濕性發生改變。Lager A等[11]發現,當初始水中不含二價陽離子(Ca2+)時,降低注入水鹽度,沒有低鹽水效應,且不含二價陽離子的巖心比初始水中含二價陽離子的巖心親水性更強。由于初始水中的Ca2+具有較強的正電性,原油酸組分能通過Ca2+吸附于巖石表面,導致油潤濕性增強,注入低鹽水時,酸性組分脫附使巖石表面潤濕性發生改變;由于Na+正電性小,原油極性組分不能通過Na+吸附于帶負電的巖石表面而改變潤濕性。
在不同鹽水中,Feng X J等[19]研究腐植酸在礦物表面的吸附,探索鹽水離子強度及離子種類對腐植酸吸附的影響。腐植酸在礦物表面的吸附基本隨離子強度增加而增大,鹽水中的二價陽離子Ca2+比一價陽離子Na+更能顯著增加腐植酸的吸附,表明Ca2+橋對巖石表面和腐植酸之間作用貢獻更大。Liu Q等[20]研究鹽水離子/原油/砂巖體系的潤濕性,在堿性條件下,鹽水中的二價陽離子能與電離的酸性組分結合,大量吸附于砂巖界面,降低兩個界面的負電性,從而增加油、砂巖表面相互作用的可能性。筆者將從宏觀及微觀上研究低鹽水效應,為低鹽水改變砂巖表面潤濕性、提高砂巖油藏采收率的機理提供指導。
1 實驗材料及方法
1.1 材料
巖心:選用同一批次Berea砂巖露頭巖心,水測滲透率為(50~100)×10-3μm2,孔隙度約為20%,直徑為3.8 cm,長度為14.0 cm,黏土總質量分數為10%。
原油:所用Bakken原油各類參數見表1。Bakken原油酸值為1.3 mg(KOH)/g,屬于高酸值原油[21]。

表1 Bakken原油性質
石英砂:選用325目石英顆粒,用去離子水清洗石英顆粒3次;再將清洗后的石英顆粒放入800 ℃溫度的馬弗爐煅燒,除去石英表面的有機物,得到干燥、干凈的石英顆粒。
模擬鹽水:配制用于自滲吸實驗的模擬鹽水(NaCl或CaCl2鹽水)(見表2)。
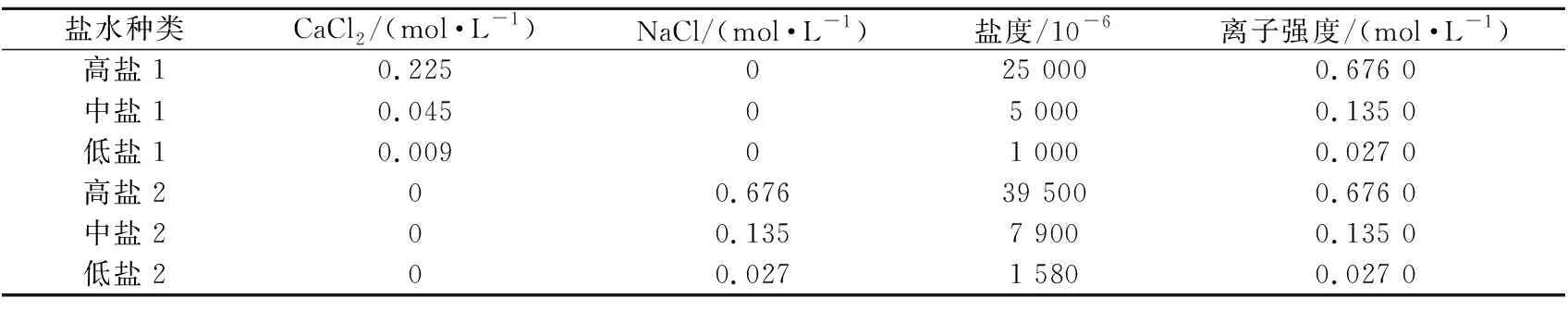
表2 鹽水性質
苯甲酸溶液:配制質量濃度為0.1 g/L的苯甲酸溶液[22],用NaOH將苯甲酸溶液pH調到9.5,使苯甲酸完全電離。
1.2 方法
1.2.1 巖心自滲吸實驗
將Berea砂巖巖心放入120 ℃溫度烘箱并烘干24 h,將干燥的巖心抽真空4 h;然后飽和初始鹽水,將巖心放入巖心夾持器,加10 MPa環壓,放入60 ℃溫度烘箱,開啟平流泵,向巖心中注入約10 PV初始鹽水,直至巖心末端鹽水pH穩定(pH=7);向巖心中注入4 PV原油,飽和油后,將巖心夾持器兩端封死,放入60 ℃溫度烘箱并老化14 d。用自滲吸裝置進行實驗,檢測不同時間段自滲吸采收率。
1.2.2 Zeta電位檢測
實驗采用DelsaTMNano型Zeta電位儀,測定石英/鹽水界面及鹽水/原油界面的Zeta電位。
(1)Zeta電位儀樣品池的清洗:依次用石油醚、乙醇、去離子水超聲清洗Zeta電位儀的樣品池各10 min;再用去離子水沖洗樣品池3次;最后用高純氮氣吹干樣品池。
(2)樣品的制備:將325目石英顆粒與不同離子組成的鹽水按質量比(1∶100)混合,用高速攪拌器攪拌10 min,轉速為4 000 r/min,配制石英顆粒/鹽水懸浮液;將原油與鹽水以體積比(1∶100)混合,用高速攪拌器攪拌10 min,轉速為4 000 r/min,配制原油/鹽水乳狀液。
(3)測定:用干凈的注射器將樣品(懸浮液/乳狀液)緩慢注入樣品池,避免產生氣泡,蓋上樣品池的蓋子。設定各項實驗參數,測定壓力為標準大氣壓,測定溫度為60 ℃,將儀器預熱10 min后進行光散射測定。
1.2.3 石英顆粒吸/脫附苯甲酸
原油中的酸性組分通常為含苯環的酸[23-25],選用苯甲酸作為原油中的模擬酸性組分。
(1)溶液的配制:配制40 mL離子強度分別為0、0.054 0、0.135 2、0.405 6、0.676 0、1.352 0 mol/L的CaCl2、NaCl鹽水;配制質量濃度為0.10 g/L的苯甲酸溶液。
(2)石英顆粒吸附苯甲酸:取4 g干凈、干燥的石英顆粒放入聚四氟乙烯瓶,向瓶中加入40 mL鹽水溶液;再將盛鹽水及石英顆粒的聚四氟乙烯瓶放入搖床并搖動1 h,搖床轉速為300 r/min,使鹽水中的離子在石英顆粒表面的吸附達到平衡。取40 mL苯甲酸溶液倒入聚四氟乙烯瓶進行吸附實驗,保持溶液pH為9.5,將裝有石英顆粒、鹽水、苯甲酸的聚四氟乙烯瓶放入搖床并搖動24 h,使吸附達到平衡狀態[26],搖床轉速為300 r/min,在吸附過程中,保持溶液pH為9.5,溫度設定為60 ℃。吸附完成后,將懸濁液放入離心機離心20 min,轉速為3 500 r/min,用總有機碳(TOC)儀測定上層清液中苯甲酸的濃度,作為吸附后溶液中苯甲酸的濃度。根據吸附前溶液中的苯甲酸的濃度與吸附后上層清液中的苯甲酸的濃度差,計算石英表面吸附的苯甲酸的量。
(3)石英顆粒脫附苯甲酸:當石英顆粒在離子強度為0.676 0 mol/L的CaCl2中吸附苯甲酸后,向其中加入去離子水進行稀釋;將懸濁液放入搖床,搖動24 h進行脫附,搖床轉速為300 r/min,在脫附過程中,保持pH為9.5。脫附完成后,將懸濁液放入離心機離心20 min,轉速為3 500 r/min,用總有機碳(TOC)儀測定上層清液中的苯甲酸的濃度。根據脫附前、后苯甲酸濃度差,計算石英表面脫附的苯甲酸的量。
2 分子動力學模擬
采用Accelrys公司開發的Material Studio 軟件包中的Discover及Forcite模塊進行模擬,選擇COMPASS力場。
COMPASS力場的勢能函數[27]為
(1)
式中:Et為作用前后變化的總勢能;Eb(b)為鍵伸縮勢能;Eθ(θ)為鍵角彎曲勢能;Eφ(φ)為二面角扭曲勢能;Eχ(χ)為離平面振動勢能;E(b,θ,φ)為能量交叉勢能;Ec為靜電相互作用能;Ev為范德華相互作用能。等號右邊前5項為成鍵相互作用,后2項為非鍵相互作用。其中Ec和Ev分別為
(2)
(3)
式(2-3)中:i、j為不同的原子;q為原子電荷;r為不同原子的作用距離;ε為勢阱深度。
2.1 模型建立
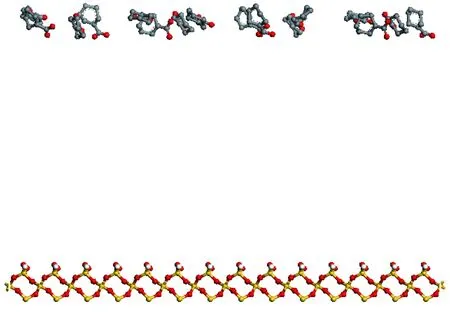
模擬過程采用周期性邊界條件,有陽離子存在的分子力學模型主要分為三部分,包括石英表面層、陽離子層及苯甲酸根層,初始構型見圖1。
首先,構建石英晶體,晶體盒子的堆積方式參考經典的六方堆積[28],晶格參數為a=0.491 3 nm,b=0.491 3 nm,c=0.540 5 nm,α=90°,β=90°,γ=120°,構建7×7×1的超胞,再進行體系能量最小化。其次,根據石英表面的晶體參數構建陽離子層,利用“build layer”命令將兩層結構組合在一起,再對體系進行能量最小化。最后,根據石英表面和陽離子層的晶體參數構建苯甲酸根層,利用“build layer”命令將石英、陽離子層與苯甲酸根層組合在一起,進行能量最小化,得到分子動力學模擬的最終模型。
利用Forcite模塊,分析最終模型中距離石英表面相關原子的濃度分布。在對體系采用COMPASS力場等條件進行能量最小化的過程中,需要固定固體的三維坐標,以防止晶體結構變形。
無陽離子存在的分子力學模型主要分為兩部分,包括石英表面層、苯甲酸根層,初始構型見圖2。
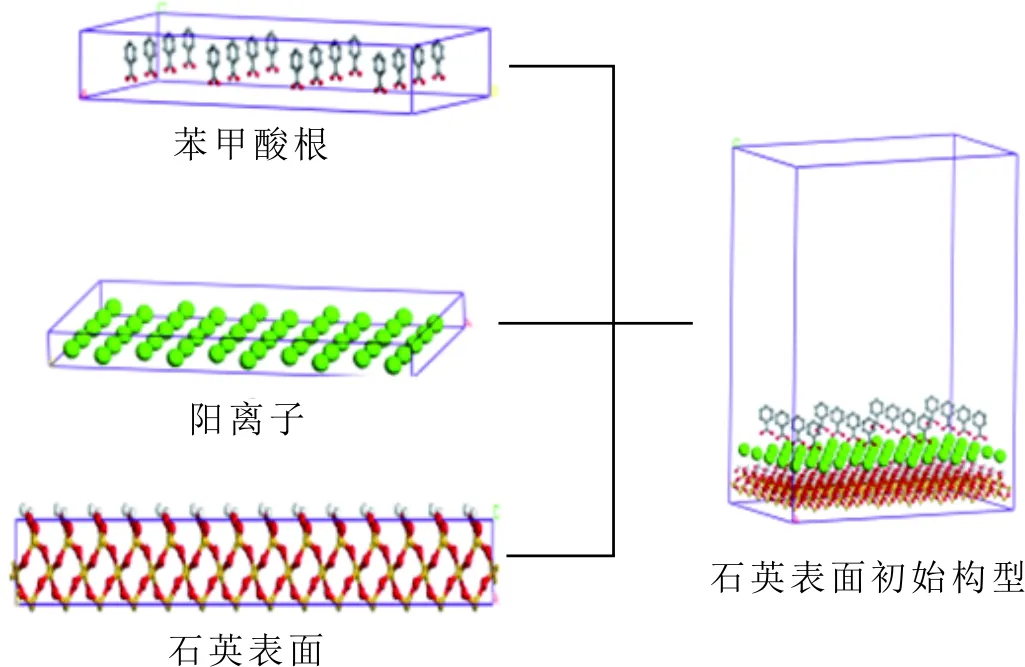
圖1 苯甲酸層、陽離子層、石英表面層初始構型Fig.1 The initial configuration of benzoic acid layer, cation layer and quartz surface
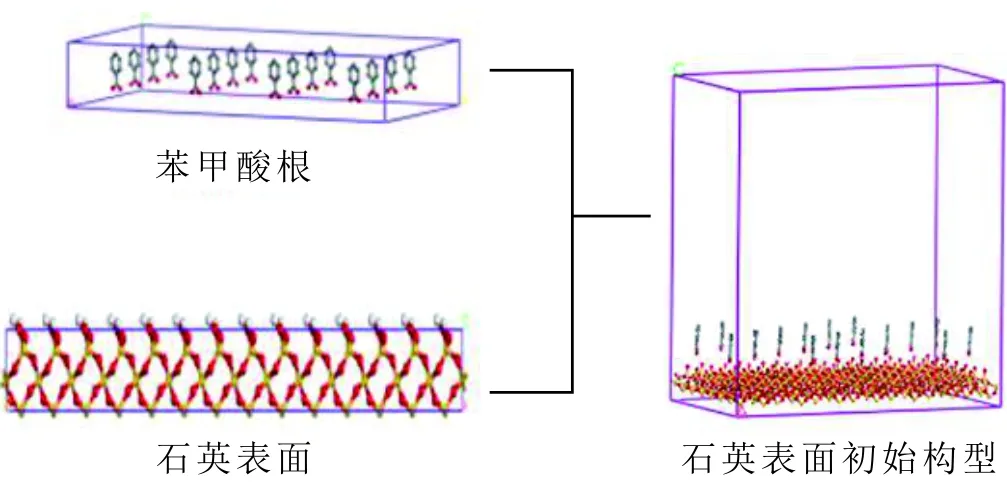
圖2 苯甲酸層及石英表面層初始構型Fig.2 The initial configuration of benzoic acid layer and quartz surface
首先,構建石英晶體。其次,根據石英表面的晶體參數構建苯甲酸根層,利用“build layer”命令將兩層結構組合在一起,對體系進行能量最小化,得到分子動力學模擬的最終模型。
2.2 結果分析
有陽離子存在的模型能量最小化后得到石英表面、陽離子、苯甲酸根之間的相互作用能[29],反映相互作用的強度,表達式為
ΔEi=Ez-(Ecl+Ea+Eq),
(4)
式中:ΔEi為整個過程中的相互作用能;Ez為作用后石英表面層、苯甲酸層、陽離子層的總能;Ea為相互作用前苯甲酸根的能量;Ecl為相互作用前陽離子層的能量;Eq為相互作用前石英表面的能量。
無陽離子存在的模型能量最小化后得到石英表面、苯甲酸根之間的相互作用能[29],表達式為
ΔEi=Ez-(Ea+Eq)。
(5)
3 結果與討論
3.1 鹽水陽離子種類及濃度對巖心潤濕性的影響
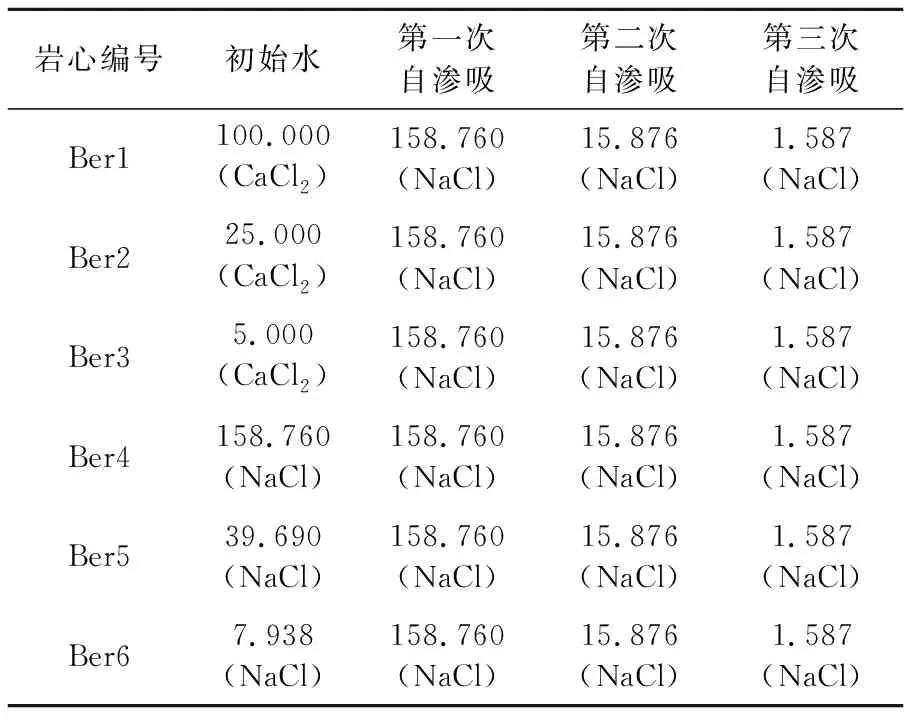
表3 自滲吸鹽水組分
巖心自滲吸實驗根據初始水中陽離子種類(Ca2+、Na+)及濃度,以及自滲吸鹽水濃度,研究陽離子種類及濃度對巖心潤濕性的影響。選用同一批次的6根Berea砂巖巖心(Ber1-6)進行巖心自滲吸實驗。實驗所用自滲吸鹽水組分見表3。
由表3可知,在6組自滲吸實驗過程中,只有初始鹽水不同,其余實驗鹽水組分相同,巖心Ber1-3初始鹽水的離子強度分別與巖心Ber4-6初始鹽水的相同。實驗結果見圖3。由圖3可知,自滲吸同一種高鹽水(NaCl鹽水,158.760 g/L)時,初始水為CaCl2鹽水的Ber1-3巖心的采收率及采收速率明顯小于初始水為NaCl鹽水的Ber4-6巖心的,初始水中CaCl2質量濃度越高,自滲吸高礦化度水的采收率越低,自滲吸、采收速率越小。如巖心Ber1-3初始飽和鹽水的礦化度分別為100.000、25.000、5.000 g/L,采收率分別為19.0%、24.0%、29.0%。當初始水中只含有NaCl時,初始水中NaCl質量濃度對自滲吸高礦化度水的采收率及采收速率影響不大,如巖心Ber4-6的采收率約為33.0%,表明初始鹽水中的Ca2+影響Berea砂巖的初始潤濕性,且初始鹽水中的Ca2+質量濃度越高,Berea砂巖巖心親水性越弱;初始水中的Na+對Berea砂巖的初始潤濕性影響不大。
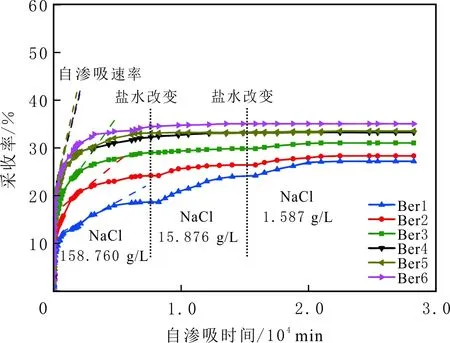
圖3 不同初始水對自滲吸采收率影響Fig.3 Effect of initial brine chemistry on oil recovery by spontaneous imbibitions
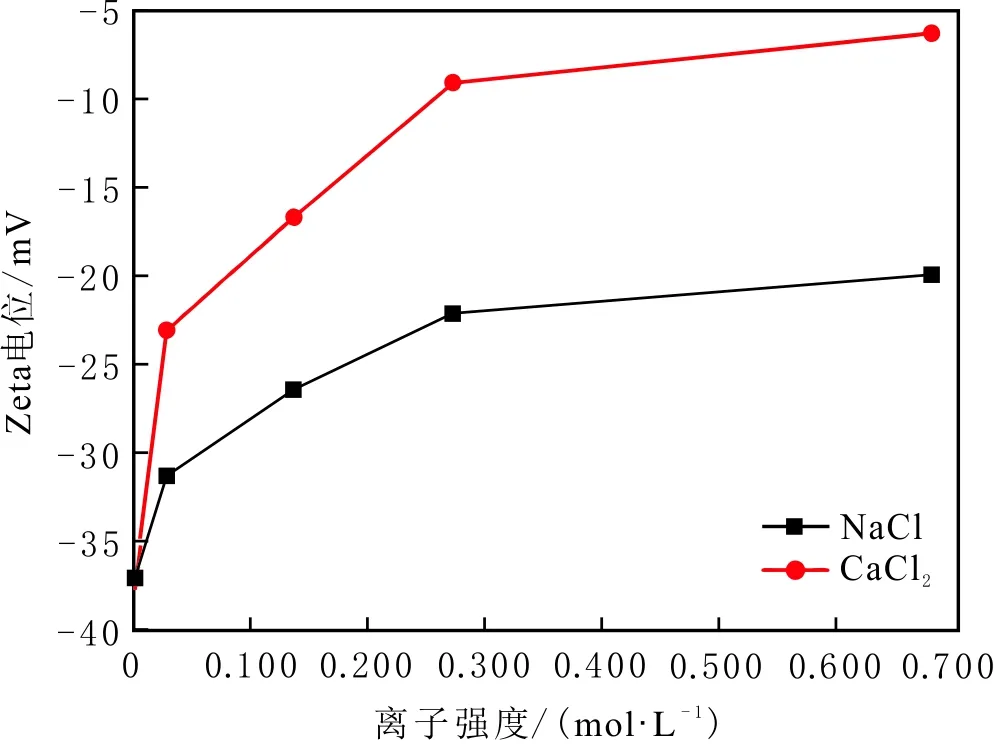
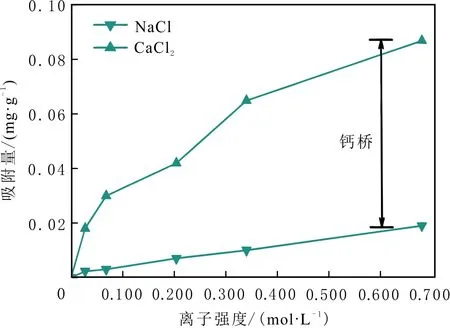
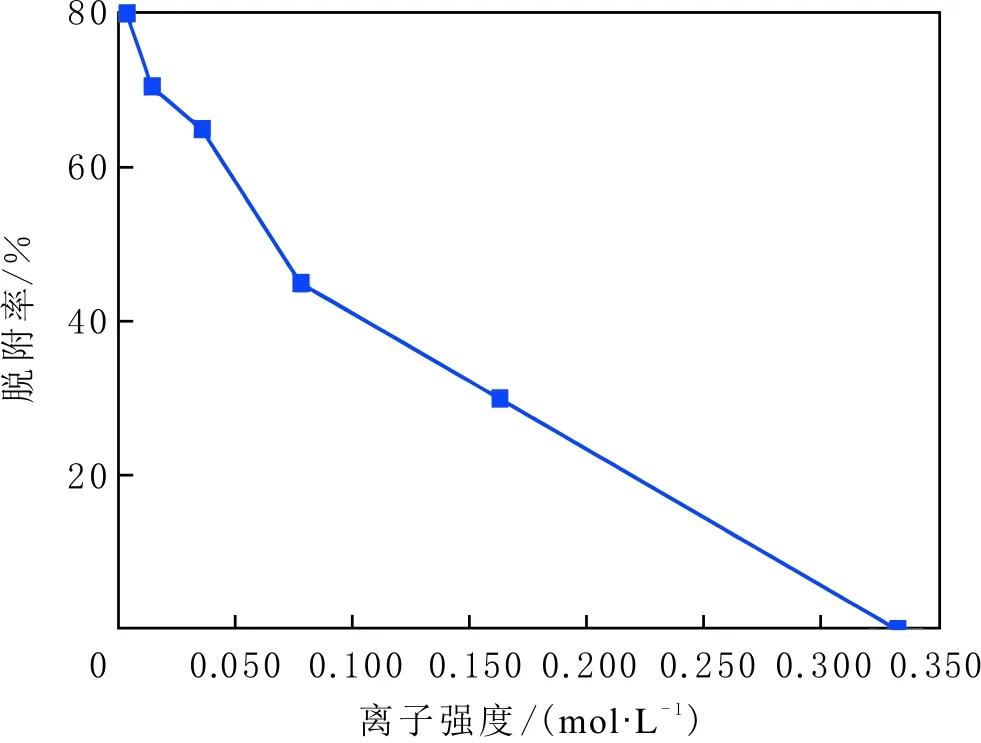
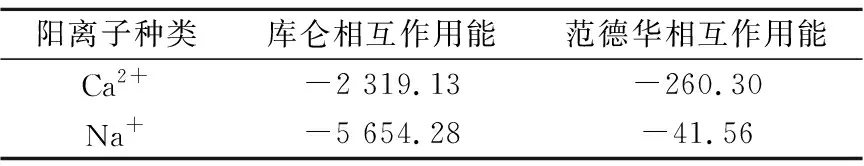
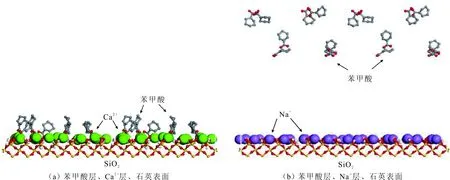
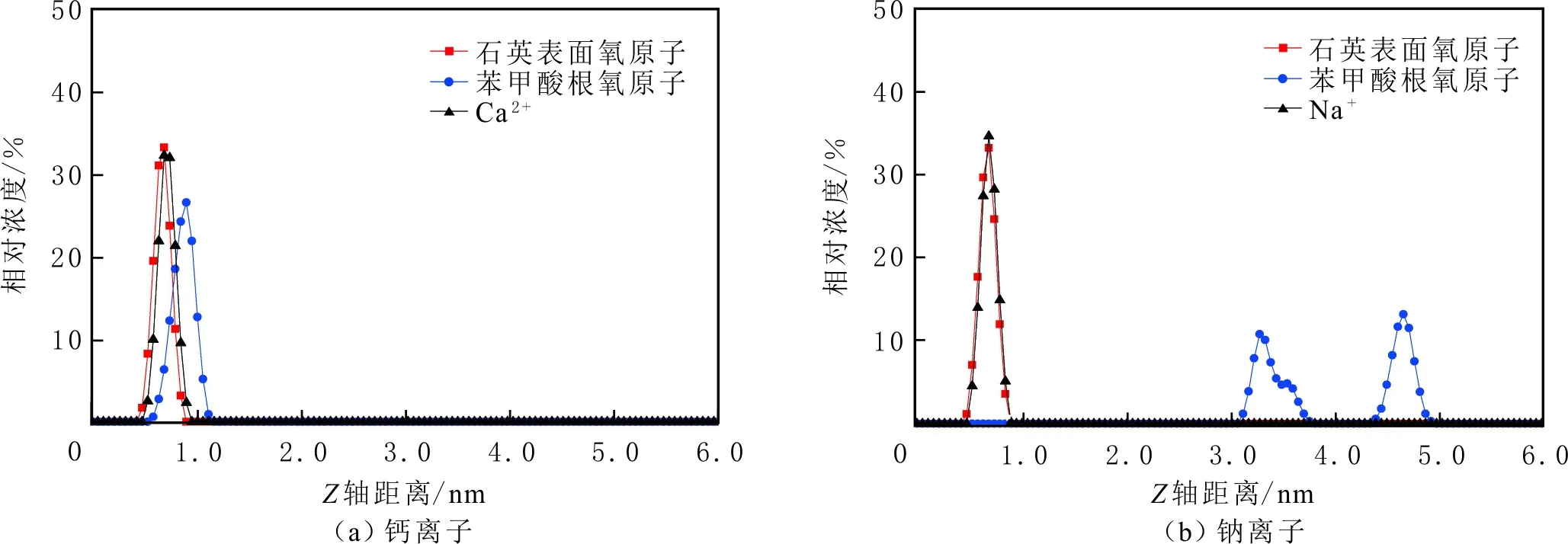
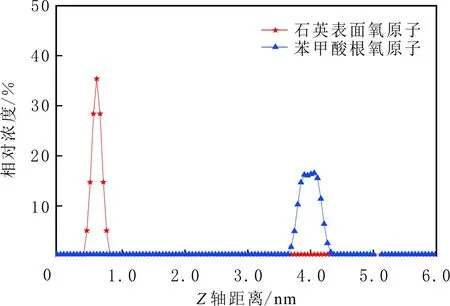
當初始鹽水為中性時,Bakken原油中的酸性組分被電離成負電性羧酸根,鹽水中的二價陽離子(Ca2+)正電性較強,將負電性羧基與帶負電的砂巖表面連起來,使羧基架橋吸附于砂巖礦物表面。羧基另一頭為親油的烴,使砂巖礦物表面的親水性減弱。當初始鹽水中只存在一價陽離子(Na+)時,正電性較小,被電離的羧酸根不能通過一價陽離子(Na+)架橋吸附于砂巖表面,一價陽離子(Na+)不能明顯改變砂巖表面的潤濕性。因此,巖心Ber4-6的初始潤濕性比Ber1-3的親水性更強。初始水中的二價陽離子(Ca2+)濃度越高,通過二價陽離子(Ca2+)架橋吸附于砂巖礦物表面的羧酸根越多,砂巖礦物表面的親水性越弱,親水性Ber1 當自滲吸鹽水(NaCl鹽水,158.760 g/L)鹽度減小至1.587 g/L時,巖心Ber1-3采收率明顯提高,分別為9.0%、5.0%、3.0%,而巖心Ber4-6采收率沒有明顯變化,表明巖心Ber1-3的潤濕性發生改變,巖心Ber4-6的潤濕性沒有明顯變化。當自滲吸鹽水濃度降低時,砂巖礦物表面吸附的陽離子數量減少,負電性砂巖礦物表面與負電性羧酸根之間靜電斥力增大,羧酸根離子由礦物表面脫落,礦物表面的親水性增強,脫附的羧酸根離子越多,礦物表面的親水性越強,提高采收率越多(Ber3 低鹽水改變砂巖表面潤濕性與砂巖表面、極性原油組分的電性,分析原油/鹽水、巖石/鹽水界面的Zeta電位(見圖4-5)。在中性(pH=7)條件下,鹽水離子強度減小使石英表面的負電性增強,當CaCl2鹽水離子強度為0.676 0 mol/L時,石英表面帶弱正電性(+7 mV);隨鹽水離子強度減小,石英表面由顯正電轉為帶負電,當鹽水離子強度進一步減小至0 mol/L時,石英表面的Zeta電位約為-50 mV。對于NaCl鹽水,當鹽水離子強度為0.676 0 mol/L時,石英表面帶負電(約為-10 mV),當鹽水離子強度減小至0 mol/L時,石英表面的Zeta電位約為-50 mV。在同離子強度下,石英/NaCl鹽水界面的負電性比石英/CaCl2鹽水界面的負電性更強。石英表面主要有Si、O元素,在不同pH條件下,兩種元素可能與氫元素結合并形成電中性硅醇基團(≡Si—OH)、負電性硅醇基團(≡Si—O—)[30],平衡反應方程式為 ≡Si—OH?Si—O+H+。 (6) 當水為中性時,式(6)平衡右移,石英表面的電中性硅醇基團(≡Si—OH)中的H被電離,形成裸露的帶負電的硅醇基團(≡Si—O—),石英表面顯負電。當鹽水離子強度較大時,鹽水中較多的陽離子通過與砂巖中石英表面帶負電的硅醇基團之間的靜電引力吸附于砂巖表面,砂巖表面負電性較小(或帶較弱的正電);隨鹽水離子強度減小,砂巖表面吸附的陽離子減少,負電性增強。由于Ca2+正電性強于Na+的,在同離子強度下,砂巖/CaCl2鹽水界面的負電性明顯弱于砂巖/NaCl鹽水界面的。 在中性條件下,當鹽水離子強度減小時,原油/鹽水界面的負電性增強,當CaCl2鹽水離子強度為0.676 0 mol/L時,原油/CaCl2鹽水界面的負電性較弱,Zeta電位為-5 mV,隨鹽水離子強度減小,原油/CaCl2鹽水界面的負電性增強,當離子強度減小至0 mol/L(去離子水)時,原油/去離子水界面的Zeta電位為-37 mV。當NaCl鹽水離子強度為0.676 0 mol/L時,原油/NaCl鹽水界面的Zeta電位約為-19 mV,隨鹽水離子強度減小,原油/NaCl鹽水界面負電性增強,當離子強度減小至0 mol/L時,原油/去離子水界面的Zeta電位為-37 mV。在同離子強度下,原油/NaCl鹽水界面的負電性明顯強于原油/CaCl2鹽水界面的負電性。 圖4 鹽水中陽離子種類及濃度對石英/鹽水界面Zeta電位的影響Fig.4 The effect of cationic type and concentration of brine on Zeta potential of brine/quartz interface 圖5 鹽水中陽離子種類及濃度對原油/鹽水界面Zeta電位的影響Fig.5 The effect of cationic type and concentration of on Zeta potential of crude oil/brine interface 因為原油中除含有不同烴外,還含有不同種類的非烴組分,如在不同pH條件下,石油酸組分中的極性基團發生去質子化,從而改變非烴組分的帶電量。在不同pH條件下,將原油中的酸性組分用HA表示,油滴表面的電荷發生變化。酸性化合物(HA)的解離平衡反應式為 HAi+, (7) 式中:A-為酸性化合物解離后的產物;H+為酸性化合物解離后的氫離子。對于高酸值Bakken原油中的酸性組分,當鹽水為中性時,式(7)平衡右移,石油酸被電離成帶負電的羧酸根。帶負電的羧酸根主要聚集于油/水界面,使油/水界面帶負電。當鹽水礦化度較高時,鹽水中較多的陽離子通過與油/水界面的羧酸根之間的靜電引力吸附于油/水界面,使油/水界面的負電性減小;隨鹽水鹽度降低,油/水界面吸附的陽離子減少,油/水界面負電性增強。由于二價陽離子Ca2+正電性強于單價陽離子Na+的,在同離子強度下,原油/CaCl2鹽水界面的負電性明顯弱于原油/NaCl鹽水界面的負電性。 圖6 鹽水中陽離子對苯甲酸在石英表面吸附的影響Fig.6 The effect of cation of brine on adsorption of benzoic acid on quartz 鹽水中陽離子對苯甲酸在石英表面吸附的影響見圖6。由圖6可知,當鹽水離子強度為0 mol/L時,苯甲酸幾乎不吸附于石英顆粒表面,向鹽水中加入二價陽離子(Ca2+)時,陽離子顯著影響苯甲酸在石英表面的吸附,且二價陽離子質量濃度越高,苯甲酸在石英表面的吸附越多;當CaCl2鹽水離子強度增大至0.676 0 mol/L時,苯甲酸在石英顆粒表面的吸附量達0.090 mg/g。一價陽離子(Na+)對苯甲酸在石英表面吸附的影響不大,當NaCl鹽水離子強度高達0.676 0 mol/L時,苯甲酸在石英表面的吸附量不到0.020 mg/g。在同離子強度下,苯甲酸通過二價陽離子吸附于石英表面的量明顯高于通過一價陽離子吸附于石英表面的量。 當苯甲酸pKa=4.62[22]時,在堿性條件下,苯甲酸被大量電離成負電性苯甲酸根,石英表面的電中性硅醇基團被電離成負電性硅醇基團(≡Si—O—),當鹽水離子強度為0 mol/L時,負電性苯甲酸根與負電性硅醇基團之間存在靜電斥力,苯甲酸根不能通過范德華力自行吸附于石英表面。當鹽水中存在陽離子時,陽離子吸附在負電性硅醇基團上,減小石英表面與苯甲酸根之間的靜電斥力。由于二價陽離子的正電性明顯強于一價陽離子的正電性,二價陽離子顯著減小苯甲酸層與石英表面之間的靜電斥力,苯甲酸根主要通過二價陽離子(Ca2+)架橋吸附于石英表面。 圖7 鹽水離子強度降低對苯甲酸從石英表面脫附的影響Fig.7 The effect of lowering salinity of brine on desorption of benzoic acid from quartz 鹽水離子強度降低對苯甲酸從石英表面脫附的影響見圖7。由圖7可知,隨鹽水離子強度減小,苯甲酸逐漸從石英表面脫附,且鹽水離子強度越小,脫附的苯甲酸越多,當CaCl2鹽水離子強度減小至0.020 0 mol/L時,苯甲酸脫附的量占總吸附量的80%,表明大部分通過二價陽離子吸附于石英表面的苯甲酸發生脫附。因為隨鹽水離子強度降低,帶負電的石英表面與苯甲酸層之間的陽離子減少,兩者負電性增強,靜電斥力增大,從而導致架橋吸附的苯甲酸根從石英表面脫附。 苯甲酸根只能通過二價陽離子(Ca2+)架橋吸附于石英表面,而不能通過一價陽離子(Na+)架橋或范德華力吸附于石英表面。通過分子模擬計算石英表面、陽離子、苯甲酸體系,以及石英表面、苯甲酸體系作用前后的能量變化,明確吸附過程中的主要作用力;分析體系作用后石英表面的吸附構型,以及最終模型中距離石英表面相關原子的濃度分布,將石英表面的吸附行為在原子尺度上表達出來,從而在微觀上為苯甲酸在石英表面的吸附機理提供佐證。 表4苯甲酸層、陽離子層、石英表面的庫侖相互作用能及范德華相互作用能 Table4CoulombinteractionenergyandvanderWaalsinteractionbetweenbenzoicacidlayer,cationlayerandquartzsurfacekJ/mol 苯甲酸層、陽離子(Ca2+、Na+)層、石英表面體系的相互作用能計算結果見表4,作用后的構型見圖8。由表4可知,作用前后的范德華相互作用能變化較小,庫侖相互作用能較大,且遠大于范德華相互作用能,說明庫侖力對苯甲酸在石英表面的吸附起主要作用。 當石英表面吸附二價陽離子(Ca2+)時,苯甲酸根逐漸靠近石英表面,羧基基團上的氧負離子最終通過二價陽離子(Ca2+)架橋穩定地吸附于石英表面(見圖8(a))。當石英表面吸附一價陽離子(Na+)時,苯甲酸根逐漸遠離石英表面,最終懸浮于真空層(見圖8(b))。 對于苯甲酸層、陽離子層、石英表面作用后的體系,距離石英表面的相關原子/離子的相對濃度分布見圖9。由圖9可知,Z軸起始點在石英表面下,方向為垂直于石英表面向上(指向苯甲酸層)。若兩個原子的Z坐標越近,則兩個原子的位置越近。苯甲酸根中氧負離子的峰與二價陽離子(Ca2+)及石英表面裸氧原子的峰基本重合,說明苯甲酸根氧原子與二價陽離子(Ca2+)及石英表面裸氧原子相近。 當石英表面吸附一價陽離子(Na+)時,Na+的峰與石英表面裸氧原子的峰基本重合,說明Na+與石英表面裸氧原子緊緊相連,而苯甲酸根的氧負離子的峰與一價陽離子(Na+)及石英表面裸氧原子的峰沒有交集,且相隔很遠,說明苯甲酸根的氧負離子與一價陽離子(Na+)及石英表面的裸氧原子相隔很遠。 苯甲酸層、石英表面體系作用前后能量變化計算結果顯示,兩者庫侖作用能變化為-17 780.21 kJ/mol,而范德華作用能變化為-159.46 kJ/mol,苯甲酸層、石英表面體系作用前后,范德華相互作用能變化較小,而庫侖相互作用能變化較大,遠大于范德華相互作用能的,說明庫侖力在吸附過程中起主要作用。同時,苯甲酸根層、石英表面體系作用后的構型見圖10。由圖10可知,當石英表面為苯甲酸根時,苯甲酸根逐漸遠離石英表面,最終懸浮在真空層里。 圖8 苯甲酸層、陽離子層、石英表面作用后構型Fig.8 The finial configuration of benzoic acid layer, cation layer and quartz surface 圖9 石英表面裸氧原子、苯甲酸根氧原子及陽離子沿Z軸方向的分布 苯甲酸層、石英表面體系作用后,距離石英表面的相關原子/離子的相對濃度分布見圖11。由圖11可知,當石英表面與苯甲酸根作用后,苯甲酸根的氧負離子的峰與石英表面裸氧原子的峰沒有重合,并且相隔很遠,說明苯甲酸根氧負離子與石英表面裸氧原子相隔較遠。 圖10 苯甲酸層、石英表面作用后構型Fig.10 The finial configuration of benzoic acid layer and quartz surface 圖11 石英表面裸氧原子、苯甲酸根氧原子沿Z軸方向的分布Fig.11 Concentration profile of oxygen atom of quartz surface、oxygen atom of benzoic acid in a Z axis directions 分子模擬結果表明,苯甲酸根只能通過二價陽離子(Ca2+)架橋吸附于石英礦物表面,不能通過一價陽離子(Na+)架橋吸附或范德華力吸附于石英表面。 (1)在中性條件下,原油中的酸性組分和砂巖表面的硅醇基團被電離而帶負電,負電性酸組分主要通過鹽水中的二價陽離子(Ca2+)架橋吸附于負電性砂巖表面,不能通過一價陽離子(Na+)架橋吸附或范德華力吸附。由于架橋吸附的酸性組分另一端為烴,酸性組分的吸附將使砂巖表面親水性減弱;當注入水鹽度降低時,砂巖表面與酸性組分之間陽離子減少,兩者靜電斥力增大,酸性組分將發生脫附,砂巖表面親水性增強。 (2)當陽離子、苯甲酸根、石英體系相互作用后,苯甲酸根、二價陽離子(Ca2+)與石英表面緊緊相連,苯甲酸根與一價陽離子(Na+)及石英表面距離較遠。當苯甲酸根單獨與石英表面作用后,苯甲酸根與石英表面距離較遠,表明酸性組分只能通過二價陽離子架橋吸附于石英表面,不能通過一價陽離子架橋吸附或范德華力吸附。在吸附過程中,體系作用前后范德華相互作用能變化較小,庫侖互相作用能變化較大,表明庫侖力在吸附過程中起決定性作用。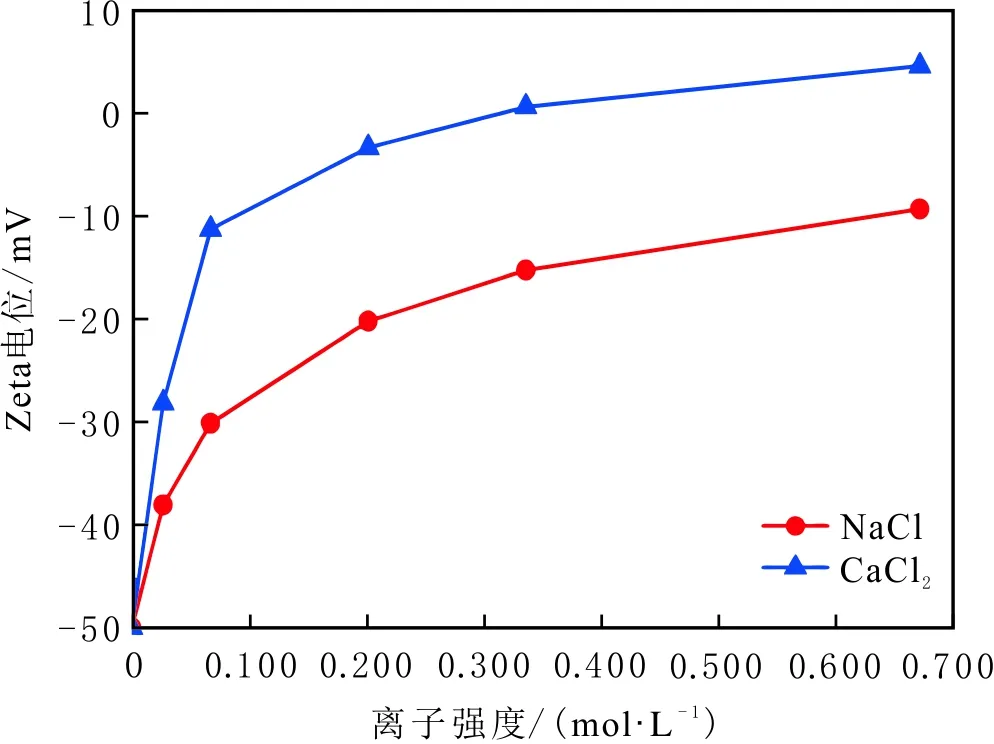
3.2 鹽水陽離子種類及濃度對石英吸附極性組分的影響
3.3 陽離子影響酸性組分在石英表面的吸附機理
4 結論

