利用動力學模型探討甲萘醌對脫氮假單胞桿菌發酵過程的影響
楊 勇,劉 群,章帥文,李昆太
?
利用動力學模型探討甲萘醌對脫氮假單胞桿菌發酵過程的影響
楊 勇,劉 群,章帥文,李昆太*
(江西農業大學 生物科學與工程學院,江西 南昌 330045)
以脫氮假單胞桿菌為供試菌,通過外源添加氧化應激誘導劑甲萘醌,測定了維生素B12發酵過程中代謝特征參數,應用Logistic、Luedeking-Piret 和Luedeking-Piret 修正模型建立了氧化應激狀態下菌體生長、產物積累和基質消耗的動力學方程,采用Origin9.0軟件對其進行非線性回歸分析,獲得動力學模型參數。研究結果發現:甲萘醌可以加快菌體生長、加速總糖消耗,但對維生素B12合成具有一定的抑制作用;擬合結果表明甲萘醌能夠有效降低菌體的最大比生長速率m、提高總糖的比消耗速率、降低維生素B12合成的比生成速率,延緩穩定期出現的時間,且擬合相關系數2均達到90%,說明該模型能較好地反映本研究實驗條件下脫氮假單胞桿菌的細胞生長、產物合成和底物消耗過程,為接下來深入研究不同氧化應激狀態下的菌體代謝變化特征提供參考。
脫氮假單胞桿菌;甲萘醌;維生素B12;相關系數;氧化應激
維生素B12(Vitamin B12,VB12)系含有鈷離子的類咕啉(corrinoid)類化合物,通常被稱為鈷胺素,其分子結構是以鈷離子為中心的咕啉環和5,6-二甲基苯并咪唑(DMBI)為堿基組成的核苷酸[1]。作為一種重要的生物活性物質,VB12還是很多重要生物化學反應所必需的輔酶[2],比如分子內重排、分子間甲基轉移反應以及由三磷酸核糖核苷酸生成2′-三磷酸脫氧核糖核苷酸的還原反應等[3]。目前,VB12主要用于治療惡性貧血癥以及末梢神經炎[4]。由于其分子構造高度復雜,全部的化學合成需要多達70余個反應步驟[5],而且成本極高,因此目前基本都是采用微生物發酵形式來生產合成VB12[6]。自然界中主要存在兩種不同的VB12生物合成途徑,即好氧途徑與厭氧途徑[7],這兩種合成途徑的本質區別在于鈷離子螯合到咕啉環的時機不同以及中心咕啉環的縮合機制不同[8]。脫氮假單胞桿菌由于具有完整的VB12合成基因,能夠在好氧條件下完成VB12的全合成,因而被廣泛應用于VB12的工業發酵生產[9]。
發酵動力學模型和方程的建立是為了解在發酵過程當中菌體生長、產物合成和基質消耗的動態平衡及內在代謝規律,為后續深入研究提供理論基礎[10]。近年來,國內外針對脫氮假單胞桿菌生物合成VB12發酵動力學的研究多集中在分批補料過程,如:劉東洪[11]、劉曉俠[12]等人通過建立發酵動力學模型很好地反映了VB12以及前體物質5-氨基乙酰丙酸(5-ALA)分批補料發酵過程,對VB12的發酵生產具有一定的理論指導意義。脫氮假單胞桿菌作為典型的具有ED代謝途徑的微生物[13],該途徑生成的NADPH,除了參與VB12合成的酶促反應[14],還是微生物胞內抗氧化防御系統的重要組成成分,其作為電子供體參與胞內的氧化還原反應以維持胞內正常的氧化還原平衡[15-16],然而目前國內外對外源氧化應激誘導劑存在下的VB12發酵代謝研究鮮有報道。甲萘醌作為一種超氧生成劑,可以進入細胞,經單電子還原成半醌自由基,從而進入呼吸鏈與O2作用形成·O2-[17-18]。因此,外源添加甲萘醌可以作為一種氧化應激誘導劑,改變菌體培養環境的氧化程度,起到添加活性氧的作用。
為此,本試驗以脫氮假單胞桿菌為供試菌體,在外源添加甲萘醌對脫氮假單胞桿菌發酵過程的研究基礎上,通過origin9.0非線性擬合,建立了菌體生長、VB12合成及基質消耗3個動力學模型,以期為接下來深入研究脫氮假單胞桿菌在維系菌體胞內氧化還原平衡和VB12合成中的關鍵調控作用,揭示限制性供氧促VB12高效合成的代謝機理提供試驗依據和研究基礎。
1 材料與方法
1.1 材料與試劑
1.1.1 菌種 脫氮假單胞桿菌(),由本實驗室保存。
1.1.2 培養基 斜面培養基:蔗糖30 g,蛋白胨10 g,玉米漿10 g,(NH4)2SO40.25 g,(NH4)2HPO41.5 g,MnSO4·H2O 0.1 g,ZnSO4·7H2O 0.1 g,瓊脂20 g,去離子水定容至1 000 mL。滅菌前調pH至7.0~7.2。
種子培養基:蔗糖35 g,蛋白胨20 g,KH2PO45 g,(NH4)2SO42.0 g,(NH4)2HPO40.8 g,MgSO41.5 g,ZnSO4·7H2O 0.02 g,MnSO4·H2O 0.2 g,去離子水定容至1 000 mL。滅菌前調pH至7.2~7.4。
發酵培養基:蔗糖50 g,蛋白胨25 g,(NH4)2SO41 g,ZnSO4·7H2O 0.08 g,MgSO42 g,KH2PO40.8 g,甜菜堿10 g,5,6-二甲基苯并咪唑(DMBI) 0.08 g,CoCl2·6H2O 0.15 g,CaCO32 g,去離子水定容至1 000 mL。滅菌前調pH至7.2~7.4。
以上培養基均在121 ℃下滅菌20 min。
1.1.3 材料 氫氧化鈉等常用試劑均為分析純,西隴科學股份有限公司;蛋白胨(生化試劑),奧博星生物技術有限公司;甲萘醌,國藥集團化學試劑有限公司;VB12標準品,阿拉丁生化科技股份有限公司。
1.2 儀器與設備
立式壓力蒸汽滅菌鍋,上海申安醫療器械廠;恒溫培養箱,韶關泰宏醫療器械有限公司;搖床、超凈工作臺,博迅醫療生物儀器股份有限公司;JW-3022高速冷凍離心機,安徽嘉文儀器裝備有限公司;UV759紫外分光光度計,上海佑科儀器儀表有限公司;KW-1000DC HH恒溫水浴鍋,金壇市中大儀器廠。
1.3 搖瓶發酵方法
種子液制備:每支斜面(18 mm×180 mm)以10 mL無菌水刮洗制成菌懸液。取2 mL至裝液量為50 mL/250 mL三角瓶的種子培養基中,180 r/min,30 ℃下搖床培養至菌體光密度(700)為9~10。
搖瓶發酵:將培養好的種子液按照10%接種量接種至裝液量為40 mL/250 mL三角瓶的發酵培養基中;甲萘醌溶液用0.25 μm有機相濾膜無菌過濾后按照相應的摩爾濃度梯度(濃度梯度分別為0,0.3 μmol/L)添加到發酵培養基中,30 ℃、180 r/min下搖瓶發酵培養。
1.4 分析方法
菌體生物量[19]、VB12含量[7]、殘總糖[20]的測定按參考文獻的方法進行。
1.5 試驗數據獲得與處理
在發酵培養過程中,每隔24 h取樣,分別測定菌體生物量、總糖以及VB12含量。每個實驗做3次平行實驗,取其平均值。
采用Excel2003與DPS7.05進行數據處理,origin9.0軟件進行作圖與動力學擬合分析。
1.6 動力學模型
1.6.1 菌體生長動力學模型 Logistic[21]方程是由Verhulst-Peal提出,可以直觀的顯示菌體在發酵過程當中的生長規律,對擬合菌體的生長具有廣泛的適用性。其方程形式如下:
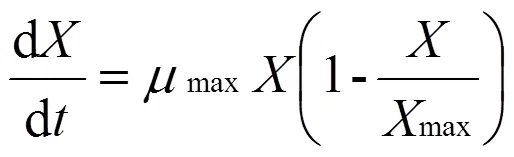
式中:為菌體生物量濃度;為比生長速率,h-1;表示時間,h;Xmax表示菌體生物濃度最大值。
在發酵生產VB12的過程中,存在著許許多多影響產物合成的因素,譬如:高濃度甜菜堿分解物質的抑制作用,前體物質甘氨酸、琥珀酰CoA和谷氨酸合成速率的影響,供氧水平與菌體形態的變化,以及菌體生長所需的營養成分擴散限制而導致菌體生長遲緩等,因此,發酵過程并不是一個均衡生長的過程。從圖1可以看出,菌體濃度呈S型增長,而Logistic模型恰好是一個非常典型的S型曲線,能夠比較準確地反映出發酵過程中菌體濃度變化對自身生長的作用,以及擬合發酵過程中菌體的生長規律。
以時間等于0,以0為起始條件,對式(1)積分可得生物量與時間的函數:
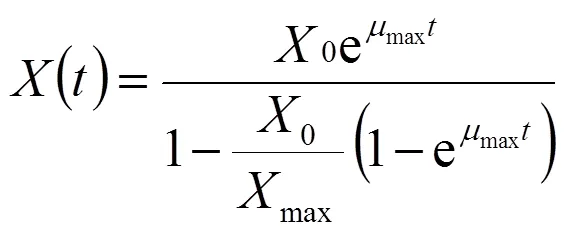
利用origin9.0軟件將()對時間進行非線性擬合,可獲得最大比生長速率max,0和max。相關系數2可用來評價模型的擬合程度。
1.6.2 產物生成動力學模型 從圖1可以看出,在整個發酵過程當中,VB12合成與生長存在相關聯系。VB12作為胞內產物,具備充足的菌體生物量是發酵高產的前提條件。根據發酵過程及試驗數據來看,VB12的合成與生物量隨時間的變化趨勢相同,當菌體處于對數生長期,產物VB12同時產生,但只是部分合成;菌體生長停滯后,VB12繼續以某種形式大量合成。根據文獻記載,Gaden[22]將產物合成與菌體生長及基質消耗相關聯,定性地將發酵過程歸為3類:生長偶聯型、非生長偶聯型和部分生長偶聯型。因此,發酵合成VB12的發酵過程為部分生長偶聯型[11]。
部分生長偶聯模型可用Leudeking-piret方程[10]表示:
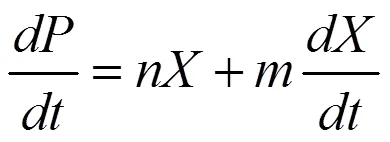
式中:為產物濃度,μg/mL;,是經驗常數(,均大于0),為與菌體量關聯的產物合成常數[g/(g·h)-1],為與菌體生長率關聯的產物合成常數(g/g)。
把式(2)代入式(3),并求積分得:

利用origin9.0軟件()對進行非線性擬合,可獲得,及初始值0,相關系數2可用來評價模型擬合程度。
1.6.3 基質消耗動力學模型 根據物料平衡法則,在VB12的發酵過程中,基質(蔗糖)的消耗主要可分為3個部分,即:構成菌體主要成分,維持菌體生長代謝的需要,合成產物VB12。因此,基質消耗速率可以采用Luedeking-piret修正模型表示:
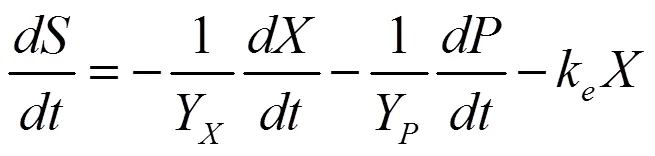
式中:k為細胞維持系數;Y為菌體對基質的得率系數;為基質濃度,μg/mL;Y為產物對基質的得率系數。把式(3)代入式(5),得:
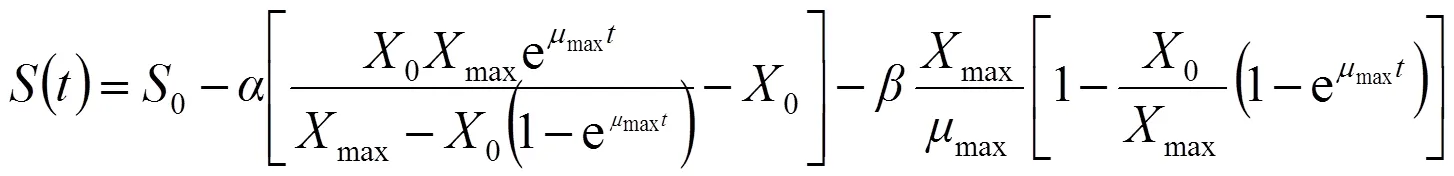
式(1)、(3)和(6)分別構成了發酵過程中的菌體生長、VB12合成以及總糖消耗的動力學模型,反映了發酵過程當中菌體生長、VB12合成及總糖消耗同發酵時間之間的關系;式(2)、式(4)和式(7)分別為3個模型的積分形式,便于模型的擬合求解。將()對進行非線性擬合,可獲得模型參數、,初始值0。相關系數2可以用來評價模型的擬合程度。
2 結果與分析
2.1 甲萘醌對P. denitrificans發酵過程代謝變化特征影響
由圖1可知,在0~24 h期間,菌體處于適應期,對照組與試驗組菌體量都沒有顯著增加;隨后,菌體進入對數生長期,在24~72 h期間,甲萘醌出現明顯抑制細胞生長的作用。甲萘醌作為一種苯醌化合物,通過氧化還原體系不斷地產生ROS,從而通過氧化壓力導致細胞損傷[23],因此發酵初期對照組菌體量高于試驗組,可能是由于甲萘醌對于細胞生長以及相關的酶系具有抑制作用。72 h后,試驗組菌體量開始高于對照組,可能是菌體開始適應胞外脅迫環境并利用甲萘醌。隨著發酵的進行,代謝不斷加劇,菌體生物量急劇增加,殘糖急劇下降;96 h之后,菌體進入穩定期及衰退期,殘糖量變化基本不變了。與對照組相比,添加甲萘醌加速了菌體的糖耗,側面反映了添加甲萘醌有利于菌體的生物量形成。另外,添加甲萘醌情況下,VB12產量也呈現出明顯的降低趨勢。盡管該甲萘醌濃度下的菌體生物量已達到最大值,但其VB12產量仍比對照組降低了7.5%,僅為56.82 μg/mL。
綜上可知,添加甲萘醌可以加快菌體生長、加速總糖消耗,但是對VB12的合成具有一定的抑制作用。
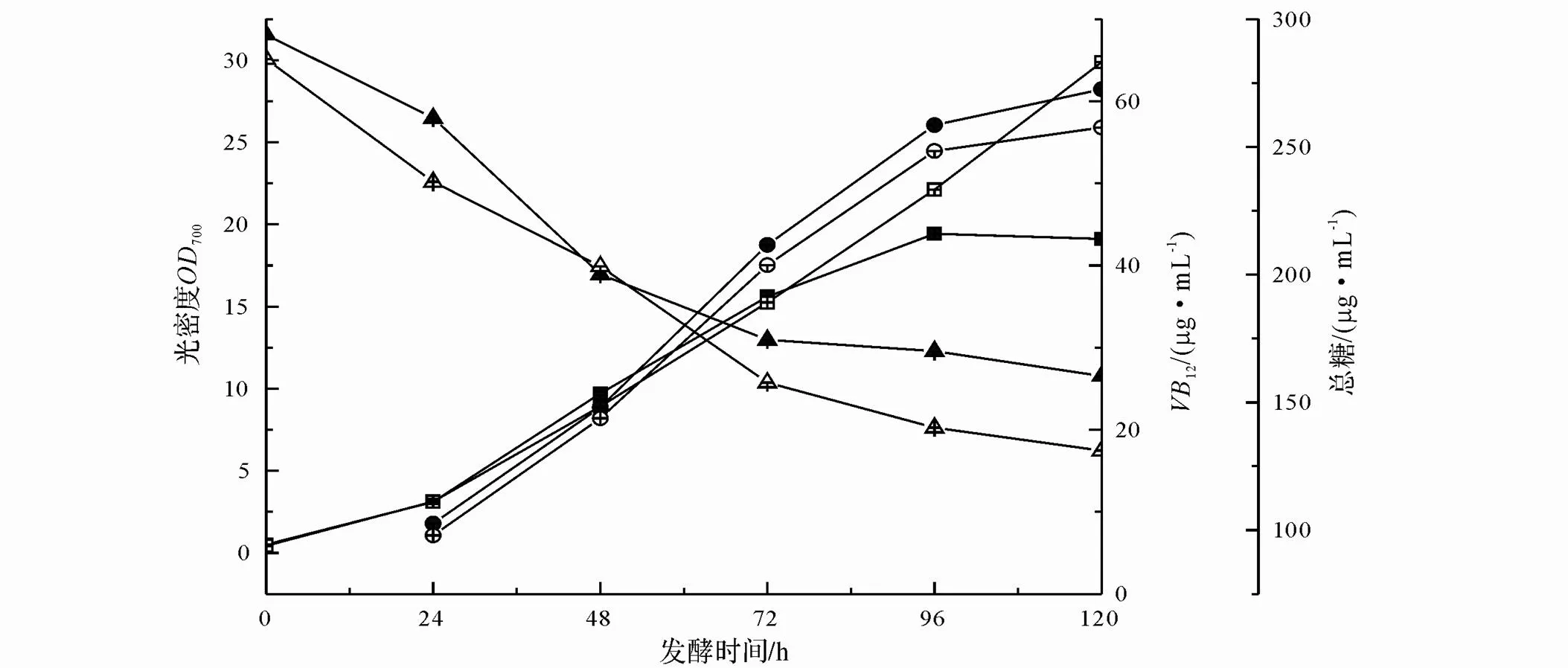
□:細胞濃度(添加甲萘醌);■:細胞濃度(不添加甲萘醌);○:VB12添加甲萘醌;●:VB12不添加甲萘醌;△:總糖(添加甲萘醌);▲:總糖(不添加甲萘醌)
2.2 VB12發酵動力學模型擬合求解與檢驗
將圖1中的實驗數據應用于上述1.6中的各模型,采用Origin9.0軟件對實驗數據進行非線性擬合,得出各參數值及初始值,結果如表1所示。
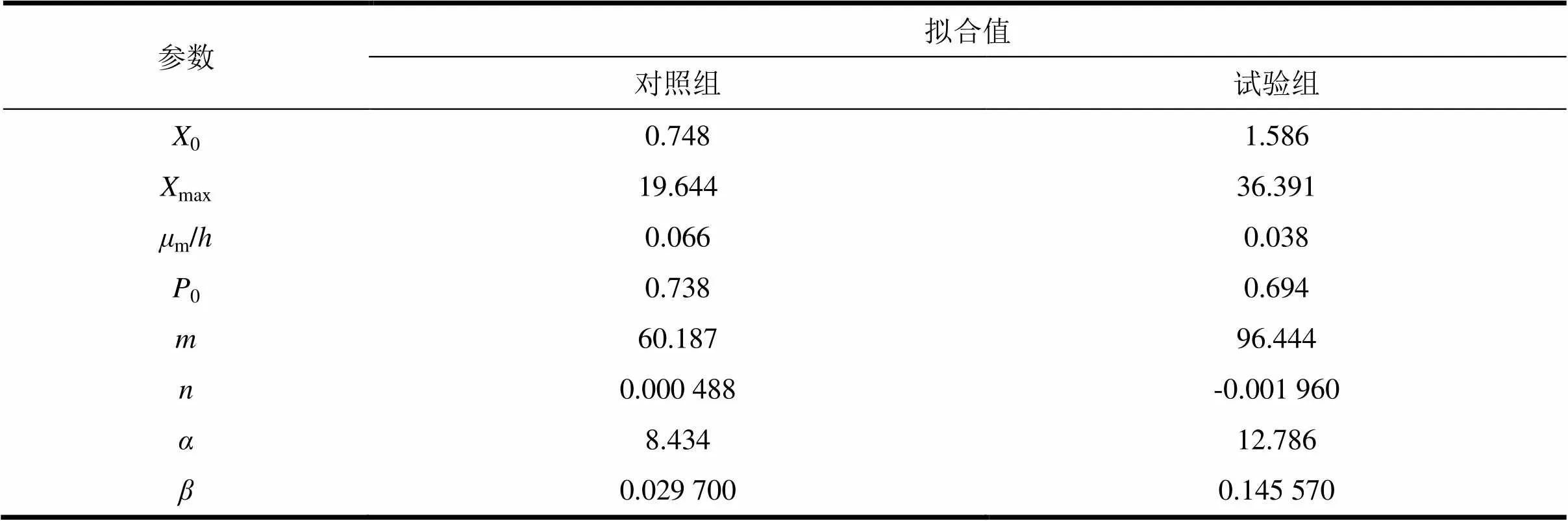
表1 動力學模擬參數模擬值
將各個參數與初始值代入式(1)、式(3)和式(6),由此,我們可以得到本試驗的發酵動力學模型:
(1)菌體生長動力學模型為:
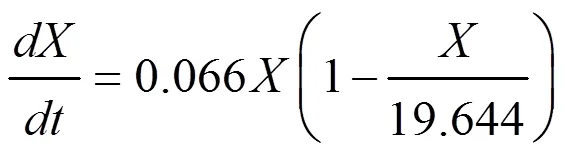
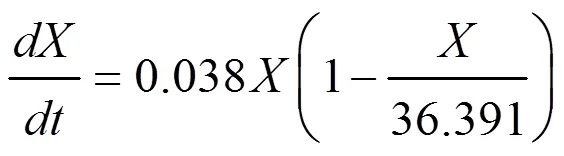
(2)VB12合成動力學模型為:
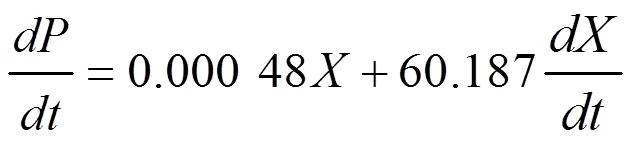
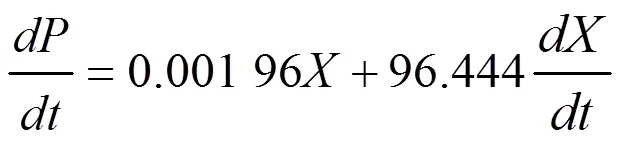
(3)基質消耗動力學模型為:
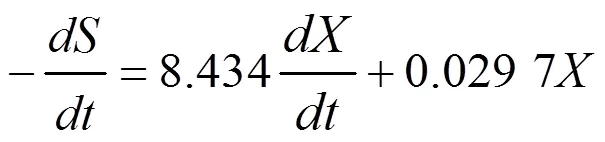
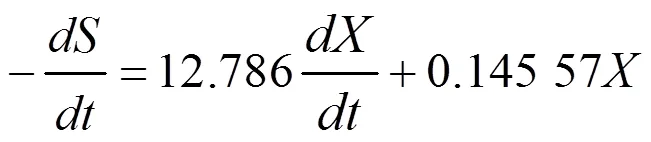
將得到的各發酵動力學模型的擬合曲線與實際的實驗數據相比較,結果見圖2。
A1,B1,C1為對照組,A2,B2,C2為試驗組
■實驗數據(actual values);○擬合值(simulation values)
圖2 動力學模型曲線與實驗值的比較
從圖2可以看出,所選擇的模型基本上都能較好的反映發酵合成VB12的情況。對照組菌體生長和VB12合成的擬合度2分別為0.995 6、0.994 9,試驗組二者的擬合度分別為0.990 5、0.997 5,擬合值與實驗值吻合度好,相對誤差均<1%。對照組和試驗組總糖消耗的擬合度也分別達到了0.939 2、0.925 5,擬合值與實驗值吻合度較好。此外,由圖可知,無論是否添加甲萘醌,菌體的生長曲線均為典型的S型曲線。在0—24 h,菌體處于適應期,添加甲萘醌能明顯降低該階段菌體生長速率。隨后菌體進入對數生長期,菌體濃度顯著上升,殘糖含量急劇下降。菌體發酵進入穩定期,菌體量和VB12含量峰值就出現在此時期。綜合圖2和實驗數據可以看出,甲萘醌的添加能夠有效降低菌體的最大比生長速率m、提高總糖的比消耗速率、降低VB12合成的比生成速率,延緩穩定期出現的時間。
3 結論與討論
發酵過程的理論與方法已被廣泛地應用于工業微生物產品生產及工藝優化,使得現代工業微生物發酵取得了高速發展[24]。Kang等[5]通過一系列發酵工藝的優化,使的VB12工業化發酵水平近年來得到了大幅度的提高,穩定在200 mg/L以上。但作為具有VB12好氧合成途徑的菌株,是否會與嗜糖假單胞菌()[25]、惡臭假單胞菌()[26]等大多假單胞菌類一樣,對胞內氧化環境較為敏感。為此,本文首先通過外源添加氧化應激誘導劑甲萘醌,利用進行搖瓶發酵實驗,測定了VB12合成過程中的菌體量、VB12和殘糖含量等代謝特征參數。根據結果顯示,甲萘醌可以促進菌體生長、加速總糖消耗,但是對VB12合成具有一定的抑制作用。結合文獻報道[27],可以分析得出,氧化應激誘導劑甲萘醌的加入雖然能延緩菌體穩定期出現的時間,顯著增強NADP磷酸酶的酶活,增加胞內NADPH的供給,但同樣誘發了胞內氧化環境的加劇,迫使菌體不得不將更多的NADPH用于抗氧化應激并維持胞內的氧化還原平衡,從而使得流向VB12合成途徑的NADPH偏少,從而最終影響VB12的合成量。
發酵動力學模型是研究各種環境因素與微生物代謝活動之間的相互作用隨時間變化規律的手段, 目的在于按照人們的需求來控制發酵過程[28],對發酵工藝的分析、優化、放大和控制具有非常重要的指導意義[29]。劉東洪等[11]以為供試菌株, 對VB12分批補料發酵動力學模型進行研究,建立了該菌株發酵合成VB12的菌體生長、產物合成和總糖消耗的動力學模型,較好地反映了VB12分批補料的發酵過程;Li等[30]通過研究發現,相比較于發酵過程中較高的DO控制濃度,限制性DO調控策略反而更有利于中的VB12合成。基于菌體在不同DO水平下的代謝調節機制,本文對氧化應激誘導劑甲萘醌狀態下的菌體發酵產VB12動力學變化進行了研究,通過建立發酵動力學模型,可以實時監控發酵過程中菌體生長、代謝產物合成、基質消耗的變化規律。模型擬合結果表明,對照組菌體生長、VB12合成以及總糖消耗的擬合度2分別為0.995 6、0.994 9、0.939 2,試驗組三者的擬合度分別為0.990 5、0.997 5、0.925 5,擬合值與實驗值相近,模型能較好地反映發酵過程規律。
本文通過外源添加氧化應激誘導劑甲萘醌,測定了VB12發酵過程中代謝特征參數,建立了氧化應激狀態下菌體發酵動力學模型,對深入探究在氧化應激狀態下的代謝輔因子變化規律,明確其在維系菌體胞內氧化還原平衡和VB12合成中的關鍵調控作用,揭示限制性供氧促VB12高效合成的代謝機理具有重要指導意義。
[1] 李永毅. 謝氏丙酸菌維生素B12生物合成核糖開關敲除的功能研究[D]. 石家莊: 河北科技大學, 2013.
[2] 楊勇, 龍悅, 吳志明, 等. 檸檬酸鈉對脫氮假單胞桿菌發酵產維生素B12代謝過程的影響[J]. 江西農業大學學報, 2018, 40(1): 174-181.
[3] Randaccio L, Geremia S, Demitri N, et al. Vitamin B12: Unique metalorganic compounds and the most complex vitamins[J]. Molecules, 2010, 15(5): 3228-3259.
[4] Stabler S P. Vitamin B12deficiency reply[J].New England Journal of Medicine, 2013, 368(21): 2041-2042.
[5] Kang Z, Zhang J, Zhou J, et al. Recent advances in microbial production of δ-aminolevulinic acid and vitamin B12[J]. Biotechnology Advances, 2012, 30(6): 1533-1542.
[6] 張翠所, 李昆太. 維生素B12的研究進展[J]. 中國釀造, 2008, 27(12): 17-20.
[7] Martens H, Barg H, Warren M J, et al. Microbial production of vitamin B12[J]. Applied Microbiology & Biotechnology, 2002, 58(3): 275-285.
[8] Moore S J, Biedendieck R, Lawrence A D, et al. Characterization of the enzyme CbiH60involved in anaerobic ring contraction of the cobalamin (Vitamin B12) biosynthetic pathway[J]. Journal of Biological Chemistry, 2013, 288(1): 297-305.
[9] Ainala S K, Somasundar A, Park S. Complete genome sequence ofATCC 13867[J]. Genome Announcements, 2013, 1(3): 63-96.
[10] 薛文嬌, 馬賽箭, 常帆, 等. 利用動力學模型探討碳源濃度對普魯蘭分批發酵過程的影響[J]. 化學工程, 2015, 43(11): 5-10.
[11] 劉東洪, 李昆太, 王永紅, 等. 脫氮假單胞桿菌產維生素B12分批補料發酵動力學研究[J]. 化學與生物工程, 2008, 25(5): 43-45.
[12] 劉曉俠. 5-氨基乙酰丙酸合成酶基因的克隆表達及生物合成5-氨基乙酰丙酸的研究[D]. 杭州: 浙江大學, 2006.
[13] Wang Z J, Wang P, Liu Y W, et al. Metabolic flux analysis of the central carbon metabolism of the industrial vitamin B12producing strainusing13C-labeled glucose[J]. Journal of the Taiwan Institute of Chemical Engineers, 2012, 43(2): 181-187.
[14] Warren M J, Raux E,Schubert H L, et al. The biosynthesis of adenosylcobalamin (vitamin B12)[J].Natural Product Reports, 2002, 19(4): 390-412.
[15] Flamholz A, Noor E, Bar-Even A, et al.Glycolytic strategy as a tradeoff between energy yield and proteincost[J].Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(24): 10039-10044.
[16] Ying W. NAD+/NADH and NADP+/NADPH in cellular functions and cell death: regulation and biological consequences[J]. Antioxidants & Redox Signaling, 2008, 10(2): 179-206.
[17] Thor H, Smith M T, Hartzell P, et al. The metabolism of Menadione (2-Methyl-1,4-naphthaquinone) by isolated hepatocytes [J].Journal of Biological Chemistry, 1982, 257(20): 12419-12425.
[18] Michaela K, Linda M H, Brian M. Oxidative stress response of a recombinant aspergillus niger to exogenous menadione and H2O2addition [J]. Enzyme & Microbial Technology, 2002, 30(3): 346-353.
[19] 彭衛福, 陳未, 周佳, 等. 無機氮源對脫氮假單胞桿菌產維生素B12代謝過程的影響[J]. 食品工業科技, 2013, 34(18): 178-181.
[20] 張文平, 李昆太, 黃林, 等. 產胞外多糖菌株的篩選及其對土壤團聚體的影響[J]. 江西農業大學學報, 2017, 39(4): 772-779.
[21] Phisalaphong M, Srirattana N, Tanthapanichakoon W. Mathematical modeling to investigate temperature effect on kinetic parameters of ethanol fermentation[J]. Biochemical Engineering Journal, 2006, 28(1): 36-43.
[22] Gaden E L. Fermentation kinetics and productivity[J]. J Biochem Microhiol Technol,1959,1(4): 413-429.
[23] 麻攀, 劉洪濤, 許青松, 等. 殼寡糖緩解甲萘醌誘導巨噬細胞損傷機制初探[J]. 中國生物工程雜志, 2011, 31(6):18-21.
[24] 夏永, 王斌, 王公孝, 等. C群流行性腦膜炎球菌多糖分批發酵動力學模型的建立[J]. 中國生物制品學雜志, 2014, 27(11): 1473-1476.
[25] Stettner A I, Segrè D. The cost of efficiency in energy metabolism[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(24): 9629-9630.
[26] Nikel P I, Kim J, de Lorenzo V. Metabolic and regulatory rearrangements underlying glycerol metabolism inKT2240[J]. Environmental Microbiology, 2014, 16(1): 239-254.
[27] Singh R, Mailloux R D S, Appanna V. Oxidative stress evokes a metabolic adaptation that favors increased NADPH synthesis and decreased NADH production in[J]. Journal of Bacteriology, 2007, 189(18): 6665-6675.
[28] 程新, 夏海林, 黃林, 等. 紅曲霉JR發酵動力學模型的建立[J].江西農業大學學報, 2010, 32(3): 590-594.
[29] 姜言暉, 張京良, 江曉路. 球形節桿菌A152產透明質酸酶的發酵優化及動力學模型的建立[J]. 生物工程學報, 2017, 33(11): 1883-1888.
[30] Kun-Tai L, Jia Z, Xin C, et al. Study on the dissolved oxygen control strategy in the large-scale vitamin B12fermentation by[J]. Journal of Chemical Technology & Biotechnology, 2012, 87(12): 1648-1653.
Study on Effects of Menadione onFermentation by Kinetics Model
YANG Yong, LIU Qun, ZHANG Shuai-wen, LI Kun-tai*
(College of Biological Science and Engineering, Jiangxi Agricultural University, Nanchang 330045, China)
In this paper, usingas the producing strain, the metabolic parameters of vitamin B12fermentation were studied by adding the exogenous oxidative stress inducer menadione. And the kinetic equations of biomass growth, production formation and substrate consumptionwere established by applying the Logistic, the Luedeking-Piret and the modified Luedeking-Piret equations. The non-linear curves were fitted and the kinetic parameters were calculated with Origin9.0. The results showed that menadione could promote the growth of bacteria and accelerate the substrate consumption, but significantly inhibited the synthesis of vitamin B12. By fitting, it was found that menadione could effectively reduce the maximum specific growth rate of bacteria, increase the specific consumption rate of total sugar, reduce the specific production rate of vitamin synthesis, and delay the emergence time of stable phase. And all the fitting correlation coefficients2were up to 90%, which showed the model could well reflect the cell growth, product synthesis and substrate consumption of. This study provided a reference for the further study of metabolic characteristics of bacteria under different oxidative stress condition.
; menadione; vitamin B12; correlation coefficient; oxidative stress
Q924
A
2095-3704(2018)03-0184-08
2018-06-19
國家自然科學基金項目(209005220)、江西省(青年)自然科學基金重大項目(20143ACB2100)和江西省青年科學家培養計劃項目(20142BCB23025)
楊勇(1993—),男,碩士生,主要從事微生物代謝調控方面的研究,wy931221@sina.com;
李昆太,教授,博士,atai78@sina.com。
楊勇, 劉群, 章帥文, 等. 利用動力學模型探討甲萘醌對脫氮假單胞桿菌發酵過程的影響[J]. 生物災害科學, 2018, 41(3): 184-191.
10.3969/j.issn.2095-3704.2018.03.41
