應用飛行檢查結果分析上海地區臨床實驗室的檢測質量
楊 雪, 朱 俊, 袁利斌, 秦 菲, 婁 嬌, 徐 翀
(上海市臨床檢驗中心,上海 200126)
室間質量評價(external quality assessment,EQA)和飛行檢查都是用于評估臨床實驗室檢測質量的方法。臨床實驗室可通過分析EQA及飛行檢查的上報數據,及時發現差錯,以便采取有效的改進措施[1]。但是,EQA和飛行檢查在實際操作上存在著差異。飛行檢查是在未經通知的情況下由監督人員攜帶樣品直接到達臨床實驗室,并監督樣品檢測和結果上報的整個過程,是一種直接檢查檢驗結果正確性的方法[2]。飛行檢查最早用于世界各國運動員的興奮劑檢測,以公正、真實及行動快捷為特點。作為上海地區臨床實驗室質量監督管理單位,上海市臨床檢驗中心(Shanghai Center for Clinical Laboratory,SCCL)自20世紀80年代就開始對上海地區的臨床實驗室實行了飛行檢查,迄今已持續近30年。EQA是評價實驗室檢測質量的一個重要方式,是《醫療機構臨床實驗室管理辦法》對臨床實驗室的基本要求。但是EQA活動在反映實驗室檢測質量的真實性上存在不足:EQA活動為每年定期舉行,實驗室的樣品檢測和結果上報過程無人監督且時間較長,容易互相串通和修改結果[3]。相對而言,飛行檢查具有突然性,且在監督下完成檢測工作并立即回報結果,能較真實地反映臨床實驗室的檢測質量。本研究通過對SCCL 2017年飛行檢查結果、EQA結果和實驗室室內質量控制(internal quality control,IQC)結果的對比分析,探討飛行檢查對于真實、準確評估臨床實驗室檢測質量的作用。
1 材料和方法
1.1 調查對象
SCCL于2017年5月和7月分別開展了當年第1次EQA和第1次飛行檢查活動,選取同時參加EQA和飛行檢查的上海地區臨床實驗室為本次的調查對象。
1.2 調查項目及樣品來源
飛行檢查所選擇的項目為醫療機構的常規檢測項目,或EQA結果有疑問的項目。選取飛行檢查結果中定量評估的項目進行分析。飛行檢查和EQA的樣品統一采購,各項目的檢測樣品數量為5個。
1.3 樣品發放
EQA樣品發放的流程為事先通知臨床實驗室,按規定時間發放樣品(冷鏈運輸,第2天到達),臨床實驗室在規定期限內檢測樣品并上報結果。飛行檢查則是在未經告知的情況下,由經培訓的人員攜帶樣品到達臨床實驗室,各臨床實驗室按照樣品操作說明書的要求在3 h內完成檢測,并將結果上傳到SCCL指定的“質評結果上報系統”中。
1.4 統計分析
飛行檢查和EQA的上報數據在SCCL主導開發的“室間質評管理平臺”中進行統計分析。采用穩健統計方法計算所有上報結果的變異系數(coefficient of variation,CV),CV(%) =標準化四分位間距/中位數×100%,其中標準化四分位間距=0.741 3×(第三、四分位數 - 第一、四分位數)[4]。同時使用Microsoft Office Excel 2007和SPSS 13.0軟件對數據進行統計。
1.4.1 飛行檢查與EQA成績對比 選取飛行檢查中有不合格計劃的實驗室,對比其EQA成績。這些計劃包括血脂、血氣和酸堿分析、凝血試驗、快速C反應蛋白(C-reactive protein,CRP)、快速血糖、同型半胱氨酸(homocysteine,Hcy)、腫瘤標志物。飛行檢查結果的評價方式與EQA結果相同。
1.4.2 飛行檢查與EQA的CV對比 選取飛行檢查與EQA相同的項目進行分析,比較實驗室上報數據的CV分布情況。使用SPSS 13.0軟件對不同項目飛行檢查與EQA的CV進行K-S正態性檢驗,然后使用Wilcoxon符號秩檢驗進行分析,以P<0.05為差異有統計學意義。
1.4.3 飛行檢查、EQA與當月IQC的CV對比 針對飛行檢查與EQA的CV差異較大的項目,收集當月實驗室上報的IQC數據。對質控品水平相近且評價分組(選擇條件為參加實驗室最多的分組,如按儀器分組分為國賽組、羅氏組等)相同的項目,分別統計飛行檢查、EQA和IQC三者的CV。同時各選取1家三級醫療機構或通過ISO 15189認可的實驗室,分析這些項目1個月內IQC的CV。
2 結果
2.1 被調查實驗室的基本信息
2017年第1次EQA共1 009家臨床實驗室回報了結果,飛行檢查上報結果的臨床實驗室為782家。其中,770家臨床實驗室同時參加了EQA和飛行檢查,所屬醫療機構為:三級醫院64家、二級醫院132家、一級醫院及衛生院266家、民營醫院290家、其他18家。
2.2 770家實驗室EQA及飛行檢查調查項目
EQA涉及臨床化學、臨床血液體液、分子生物、臨床免疫和臨床微生物專業共79個計劃,飛行檢查為21個計劃。其中,770家實驗室參加了計劃名為“血脂、凝血試驗、快速CRP、快速血糖、血氣和酸堿分析、Hcy和腫瘤標志物”的飛行檢查。見表1。

表1 770家實驗室EQA和飛行檢查調查項目
2.3 飛行檢查與EQA成績
在參加飛行檢查(7月)的770家實驗室中,共有102家實驗室存在不合格計劃,其中有85家(83.33%)實驗室的不合格計劃在2017年2次EQA中的成績均為合格(如某實驗室的血脂計劃,在飛行檢查中成績為不合格,而在2次EQA中成績均為合格)。有12家(9.51%)實驗室在第1次EQA(5月)中有成績不合格計劃,但在第2次EQA(9月)中這些計劃的成績為合格。見圖1。
2.4 飛行檢查與EQA上報結果CV的比較
相同項目飛行檢查與EQA CV的差距從0.11%(apo B)到52.15%(CA19-9)不等,平均為6.10%。使用K-S正態性檢驗顯示不同項目飛行檢查和EQA的CV差值呈非正態性分布。Wilcoxon符號秩檢驗顯示不同項目飛行檢查的CV>EQA的CV(P=0.014)。見表2。
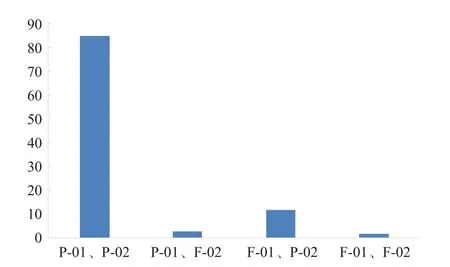
圖1 飛行檢查成績不合格實驗室EQA成績分布
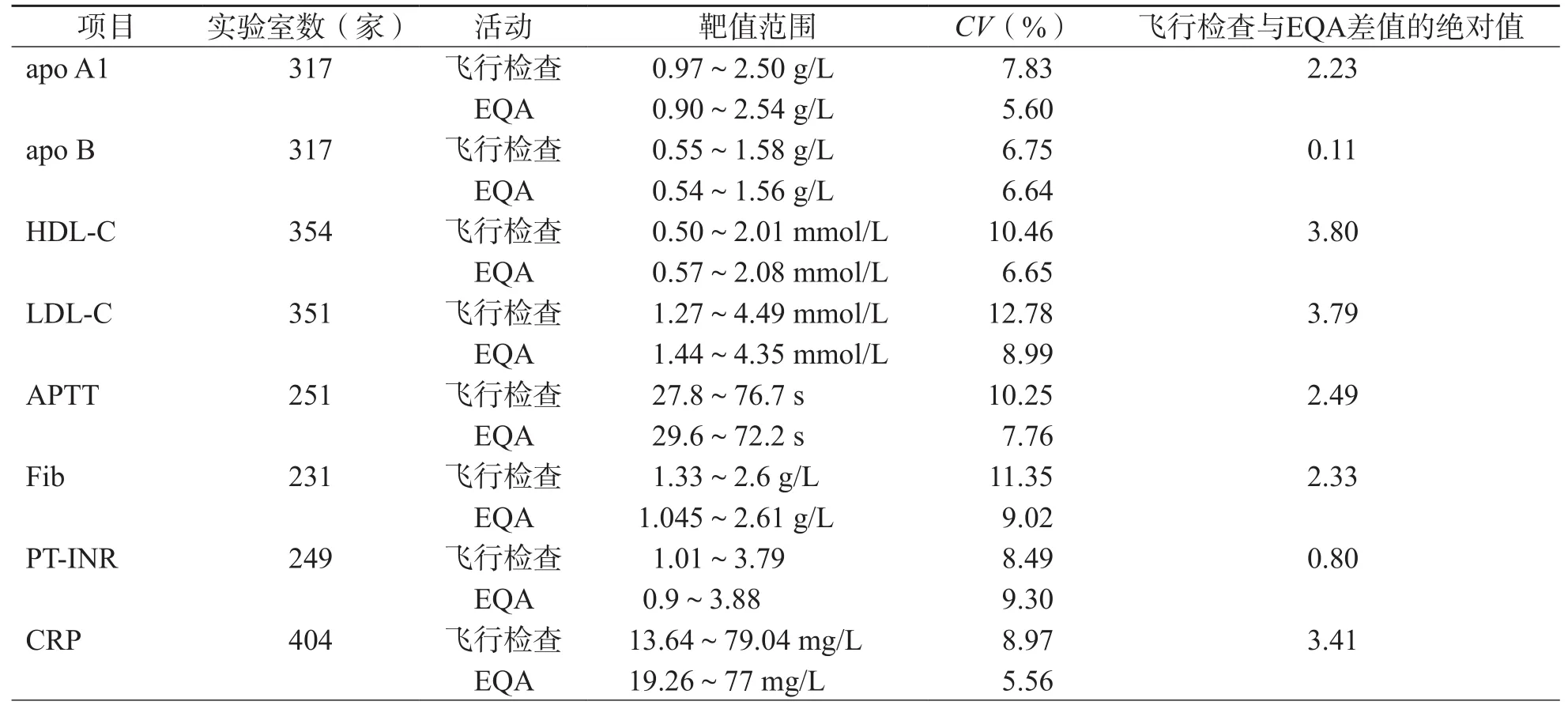
表2 不同項目飛行檢查的CV與EQA的CV對比
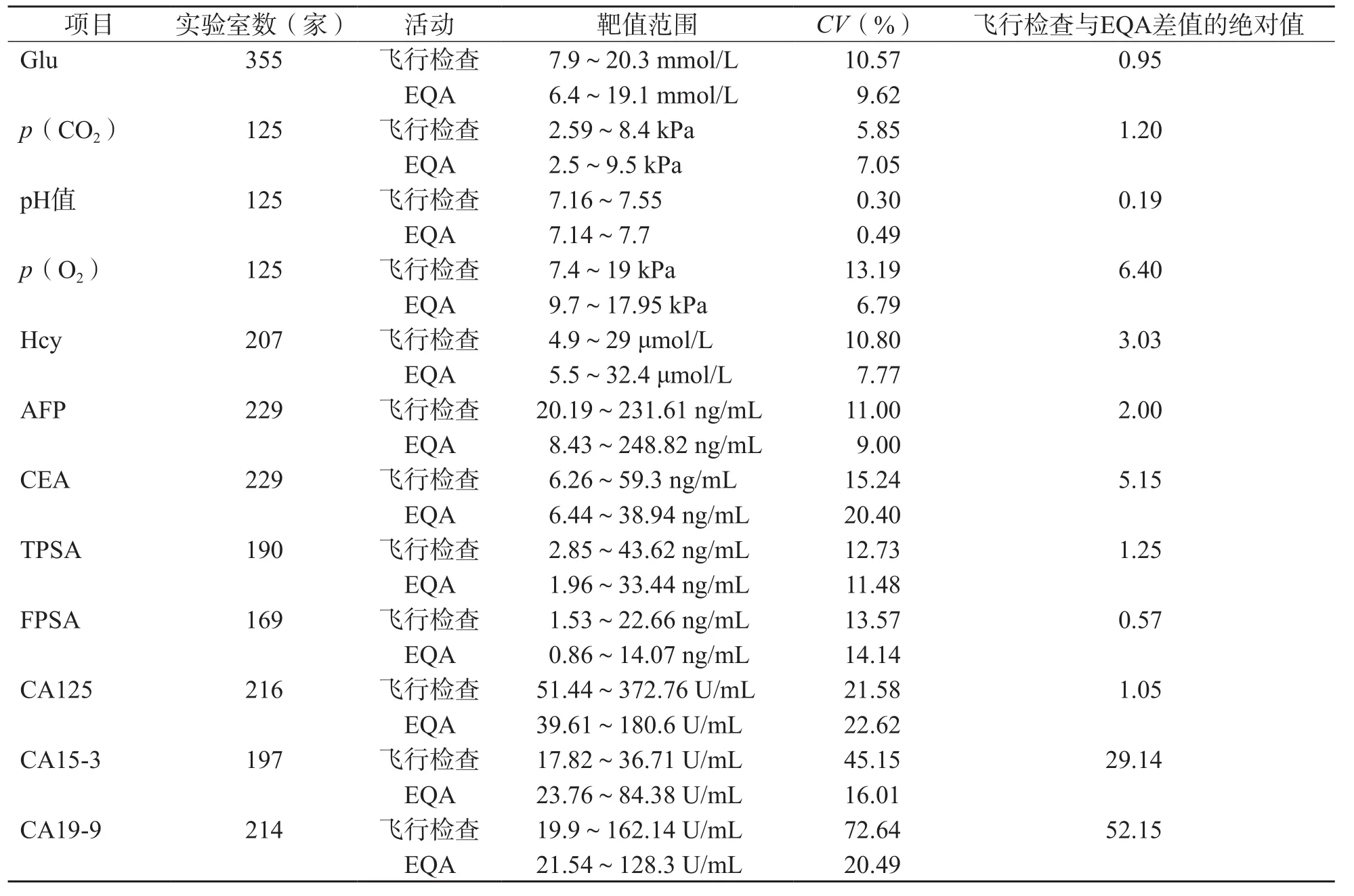
續表2
2.5 相同項目EQA、飛行檢查與當月IQC的CV比較
飛行檢查與EQA相同項目比較,CRP、p(O2)和CA19-9 CV的差異分別為3.41%、6.40%和52.15%。選取質控品水平相近和分組相同的實驗室數據,分別比較5月實驗室IQC的CV、EQA的CV和7月實驗室IQC的CV、飛行檢查的CV。某實驗室5月的CRP、p(O2)和CA19-9項目的IQC CV均>EQA CV。對于組內所有實驗室,除CA19-9項目羅氏組外,其他項目各分組的IQC CV均>EQA CV,CRP和p(O2)項目IQC與EQA的CV差值分別為2.26%和0.84%;而對于同一實驗室,其IQC CV均<飛行檢查CV。對于組內所有實驗室,7月IQC的CV均<飛行檢查的CV,CRP、p(O2)和CA19-9項目IQC與飛行檢查的CV差異分別為1.93%、5.82%和1.61%。見表3。

表3 相同項目EQA、飛行檢查與當月IQC的CV比較 (%)
3 討論
SCCL自20世紀80年代就開始對上海地區的醫療機構臨床實驗室開展飛行檢查,從最開始的摸索中不斷獲取經驗,逐漸發展成熟,已成為檢驗質量管理的一項特色工作。飛行檢查的主要環節包括前期被檢查實驗室名單的確定,檢查樣品的準備,飛行檢查人員的培訓,最終在3 d內完成全市不同等級醫療機構的臨床實驗室的檢查工作。實驗室在未被告知的情況下接受突擊檢查,當班人員被要求在3 h內完成樣品的檢測,并上報結果。這相較于無人監督檢測過程、回報時間較長(3~7 d)的EQA而言,能更真實地反映出實驗室日常檢測的水平,對于實驗室檢測質量的監管具有很大的作用。
2017年飛行檢查(7月)是對上海地區參加EQA(5月)的實驗室實施的一次全覆蓋檢查,包括全市16個區804家醫療機構的811個臨床實驗室。其中770家實驗室同時參加了2017年SCCL 2次EQA活動(5月和9月)。飛行檢查從樣品的準備、結果上報方式、數據評價和報告發放都采取與EQA相同的模式。但是,對飛行檢查中存在成績不合格計劃的實驗室進行追蹤分析,發現有83.33%的實驗室在2次EQA中成績都合格。原因可能在于:(1)飛行檢查成績不合格的單位進行了及時的整改;(2)飛行檢查為現場檢查,由當班人員對樣品進行測定(與患者樣品同時檢測);而EQA的檢測時間較長,且檢測模式可能與患者樣品是不同的,獲得的結果可能是經過反復校準后測定的。飛行檢查名單事前保密,在檢查實施前1天,飛行檢查人員才獲知自己檢查的單位名單,同時被檢查單位也難以獲知是否在名單內。且為了預防實驗室結果串通,飛行檢查在樣品設計時采用了隨機樣品和分組樣品2種方法。
飛行檢查相同項目EQA結果的CV分析顯示,大多數項目飛行檢查的CV高于EQA的CV,CV差異從0.11%到52.15%不等,平均為6.10%,表明目前的EQA結果可能不能真實地反映實驗室檢測質量。由于飛行檢查時由當班人員進行檢測,且飛行檢查人員會核對原始數據,而EQA的樣品檢測人員可能是實驗室內檢測技術較高的人員,其上報的檢測結果可能為多次檢測的均值,這樣并不能反映出實驗室的真實檢測質量(與患者樣品不同等對待)。
SCCL的實時預警系統每個月收集各臨床實驗室的IQC數據。本研究分析了EQA(5月)和飛行檢查(7月)與同月實驗室IQC數據的CV。結果顯示實驗室分組相同且質控品水平相近時,上報的EQA結果的CV<當月的IQC結果的CV,如CRP和p(O2)項目IQC和EQA的CV差值分別為2.26%和0.84%;而飛行檢查的CV均 >IQC的CV,如CRP、p(O2)和CA19-9項目,飛行檢查和IQC的CV差值分別為1.93%、5.82%和1.61%。這也反映出,EQA結果可能存在數據串通的情況。針對EQA可能存在的數據串通情況,可采取如下的應對措施:(1)采用EQA樣品編號亂序法;(2)讓實驗室保留EQA樣品檢測時的儀器原始數據,在年終的現場督查時重點對CV差異較大的實驗室的EQA原始數據進行抽查,數據不一致或不能提供原始數據者均視為EQA串通,定期報相關機構處理。

