骨髓細胞參與肝癌新生血管的構建
邵茜雯,朱海濤,凌蕓,徐靜
(1.南京醫科大學第一附屬醫院 腫瘤科,江蘇 南京 210029;2.江蘇省腫瘤醫院/南京醫科大學附屬腫瘤醫院/江蘇省腫瘤研究所 普外科,江蘇 南京 210009;3.南京醫科大學第一附屬醫院 檢驗學部,江蘇 南京 210029)
血管新生是肝細胞肝癌的重要特性,肝癌進展時骨髓動員明顯,但骨髓干細胞(bone marrow stem cells, BMSCs)是否參與肝癌血管新生還不明確[1]。我們通過細胞示蹤技術,觀察BMSCs是否參與肝癌細胞(hepatic cells cancer, HCC)的血管新生。
1 材料與方法
1.1 材料
流式抗體AlexaFluor488- CD133、PE- 血管內皮生長因子受體2(PE- VEGFR2)、PE- CD34購自eBioscience公司,大鼠抗小鼠CD31單抗、PE標記羊抗大鼠二抗購自ABCOM公司,血管內皮生長因子(VEGF)- ELISA試劑盒購自eBioscience公司。C57BL/6小鼠70只,雄性,體重18~22 g;骨髓供體:eGFP轉基因C57BL/6小鼠10只,雌性,體重18~22 g。小鼠由南京大學模式動物中心提供。
1.2 方法
1.2.1 小鼠原位肝癌模型制作[2]小鼠稱重后,自右下腹腹腔注射鹽酸氯胺酮(42 mg·kg-1)麻醉小鼠。麻醉成功后仰臥位固定小鼠,自劍突向下1.0 cm切開,提起腹壁,以無菌棉簽固定肝臟,肝內注射2×105個H22細胞(總量0.2 ml)(上海細胞研究所)。對照組:小鼠麻醉后肝內注射等量生理鹽水。
1.2.2 ELISA測定血清VEGF濃度 上述原位肝癌建模后14 d尾靜脈采血,對照組在同時間點尾靜脈采血作為對照,4 ℃靜止半小時后4 ℃ 2 000 r·min-1離心5 min,取上清保存后統一測定,具體按ELISA說明書操作。
1.2.3 流式細胞術 原位肝癌建模后14 d,模型組以及對照組小鼠均從尾靜脈采血300 μl,加入等量紅細胞裂解液,震蕩5 min后4 ℃ 2 000 r·min-1離心5 min,小心吸取沉淀細胞并重懸于0.5 ml PBS中。按說明書添加流式抗體AlexaFluor488- CD133、PE- VEGFR2和PE- CD34,室溫下避光保存30 min后上機測定CD133+VEGFR2+和CD133+CD34+細胞的百分比。
1.2.4 建立GFP+骨髓的小鼠原位肝癌模型[3]受體小鼠11 Gy照射后2 h內經尾靜脈注射2×106個GFP+BMSCs(0.2~0.3 ml),SPF級環境中飼養4周后按上述方法建立肝癌模型。
1.2.5 肝組織病理學檢查 肝癌建模7 d及14 d后處死小鼠取肝臟,冷凍切片2 μm,分別進行HE及免疫熒光染色。
1.2.6 RT- PCR 肝癌建模后14 d取肝組織,酚-氯仿法抽提總RNA,ExScriptTM逆轉錄(TaKaRa日本)合成cDNA。引物由TakaRa公司設計合成。CD133:5′- AACGTGGTCCAGCCGAATG- 3′,5′- TCCCAGGATGGCGCAGATA- 3′;CD34:5′- ACCCACCGAGCCATATGCTTAC- 3′,5′- GATACCCTGGGCCAACCTCA- 3′;β- actin:5′- CATCCGTAAAGACCTCTATGCCAAC- 3′,5′- ATGGAGCCACCGATCCACA- 3′。采用SYBR?GreenⅠ嵌合法計算目的基因相對表達水平。
1.2.7 免疫熒光 肝癌建模后7、14 d取肝組織,快速冰凍后5 μm切片,室溫固定,封閉液孵育后加一抗CD31(1∶800)4 ℃過夜。熒光二抗(1∶1 000)室溫孵育35 min。二脒基苯基吲哚(DAPI)染核,高倍鏡下計數GFP+CD31+細胞在血管內皮中的比率。摻入率=GFP陽性核/所有內皮細胞核×100%。
1.2.8 Western blotting 肝癌建模后14 d取肝癌與癌旁組織并提取蛋白,上樣100 μg,常規聚丙烯酰胺電泳、轉膜,加一抗(1∶200)4 ℃過夜后加二抗(1∶1 000),X線 膠片顯影。
1.3 統計學處理
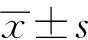
2 結 果
2.1 肝癌組織病理
建模7 d后肝臟出現灰白色結節,鏡下見典型的肝癌病理特征,腫瘤新生血管明顯。
2.2 肝癌模型小鼠血清VEGF和BMSCs水平
肝癌建模后14 d血清VEGF濃度為(175.13±52.34)pg·ml-1,顯著高于對照組的(81.65±32.71)pg·ml-1(P<0.05),同時循環CD133+CD34+和CD133+VEGFR2+細胞明顯升高,分別為(0.27±0.13)%和(0.16±0.08)%,顯著高于對照組的(0.07±0.04)%和(0.08±0.06) %(P<0.01)。
2.3 建立GFP+骨髓的原位肝癌模型
肝癌小鼠有核細胞GFP陽性率為95%~98%,表明骨髓標記成功。建模后14 d腫瘤中出現大量綠色熒光,直接證明BMSCs動員后富集于肝癌組織中(圖1)。同時肝癌組織中BMSCs表型基因CD133、CD34水平顯著高于無瘤組織。

A.肝癌組織HE染色結果(×50,2 μm);B.A在熒光顯微鏡下圖像,腫瘤組織中出現GFP(×100)T為肝癌組織,N為正常組織
圖1原位肝癌組織快速冰凍切片
2.4 肝癌新生血管中的BMSCs
CD31是血管內皮特異性抗原,鏡下腫瘤血管內皮中存在CD31+GFP+細胞,這是內皮細胞來源于BMSCs的直接證據(圖2)。隨著腫瘤的增殖,BMSCs在肝癌新生血管中的比例從7.6%(建模7 d)逐漸升高到19.3%(建模14 d)(P<0.05)。
2.5 肝癌組織中VEGF表達水平
肝癌組織中VEGF含量高于正常肝組織,見圖3。
3 討 論
研究發現,BMSCs動員后能分化為成熟的血管內皮細胞而參與血管新生[1,4],VEGF是最主要的骨髓動員因子和促血管因子[5]。本實驗顯示,血清VEGF隨著腫瘤生長明顯升高,BMSCs大量動員,肝癌組織中VEGF也明顯高表達。推測肝癌組織釋放VEGF入血動員BMSCs進入循環,受局部微環境的趨化而在局部富集,最終在腫瘤微環境誘導之下分化為成熟的血管內皮而參與腫瘤血管新生。有研究認為除了直接分化為血管內皮外,BMSCs也可在局部分泌促血管生成因子以“旁分泌”方式參與血管新生[6]。
目前對動員后的BMSCs在腫瘤組織中如何分布,觀點不盡相同。有人認為腫瘤組織獨特的缺氧、低pH、高液壓以及高細胞因子水平對BMSCs具有顯著的募集作用[7],但也有人認為BMSCs主要在癌旁異常富集[8]。鑒于腫瘤生長有賴于血管的生成,理論上腫瘤組織應該含有更多的BMSCs以促進腫瘤血管新生。實驗結果顯示動員后BMSCs在肝癌組織中富集,定量PCR結果與其吻合,BMSCs表型基因CD133、CD34在腫瘤中的表達水平顯著高于無瘤區。研究結果和臨床結果有差異的可能原因:(1) 動物模型沒有肝硬化背景,而肝硬化常伴有血管新生[9];(2) 實驗腫瘤增殖較血管新生活躍;(3) BMSCs分化丟失干細胞標志后不易為臨床檢測到,而GFP可以有效示蹤BMSCs。某種程度上我們的實驗反映了BMSCs在肝癌組織中的自然分布。
有研究發現抗腫瘤治療導致血清VEGF以及循環BMSCs增高[10]。組織酸中毒、低氧、壞死加劇后更多的細胞因子釋放入血,隨之更多的BMSCs入血。因此盡管腫瘤血管可以被破壞,但是BMSCs釋放入血后可以構建新生血管以補償腫瘤血供。我們實驗發現肝癌建模7 d后BMSCs在血管內皮中的比率約7.6%,隨著腫瘤的生長,其比率逐漸達到19.3%。腫瘤初始階段即需求血管新生為其進一步生長鋪墊,直至形成實體瘤。事實上,肝硬化、肝炎、肝癌癌前病變就已經發生了血管新生。當形成腫瘤實體后,血管新生就成為腫瘤明顯的特征同時也決定了腫瘤的進展和患者的預后。

腫瘤中可見GFPCD31雙陽性細胞(箭頭),A.紅色,血管內皮CD31;B.綠色,GFP標記的BMSCs;C和D.藍色,DAPI染色的細胞核 ×300,2 μm,Frozen
圖2肝癌組織新生血管中的BMSCs

圖3肝癌組織與正常肝組織中VEGF蛋白電泳圖
我們的研究提示在肝癌生長過程中BMSCs在新生血管構建中起著重要的作用。循環BMSCs或許可以作為肝癌重要的預測指標,阻斷骨髓介導的血管新生可能在進一步提高抗腫瘤新生血管治療效果中起到積極的作用[11]。

