ERS標志物PDI表達對肝癌細胞遷移的影響
李利波,曹輝,張紅麗,潘婭
(1.貴州省人民醫院 腫瘤科,貴州 貴陽 550002;2. 貴州醫科大學,貴州 貴陽 550002)
腫瘤侵襲和轉移是腫瘤惡化的一個重要標志。而在腫瘤轉移中起關鍵作用的就是腫瘤細胞突破基底膜(basement membrane,BM)和細胞外基質(extracellular matrix ECM)組成的屏障[1]。內質網是細胞中脂質和蛋白質合成的場所,當內質網內出現發生錯誤折疊或者沒有折疊的蛋白質超量積累時,會激活細胞中一些信號通路,引發內質網應激(endoplasmic reticulum stress,ERS)[2]。許多癌癥相關的病理與內質網穩態的失衡以及誘導ERS和未折疊蛋白反應(unfolded protein response UPR)途徑有關[3- 4]。目前,腫瘤細胞內的葡萄糖調節蛋白78(glucose- regulated protein 78,GRP78)常被視為腫瘤治療反應的一種特異性標志物[5- 6],生長停滯及DNA損傷誘導基因153(CHOP)為ERS凋亡途徑被激活的主要標志之一[7- 9],X- 盒- 結合蛋白- 1(X box- binding protein- 1,XBP- 1)的表達上調為ERS標志[10- 11]。蛋白質二硫鍵異構酶(protein disulfide isomerase,PDI)是內質網中含量最豐富的蛋白質之一[12],它是促進蛋白質結構中二硫鍵形成的蛋白酶。當PDI減少時,錯誤折疊的蛋白質增多且細胞凋亡程序啟動,促進細胞死亡[13- 14]。
1 材料與方法
1.1 細胞系、試劑及設備
正常肝細胞LO2、人肝癌細胞系SMMC- 7721細胞和HepG2細胞(上海生命科學研究所),RIPA裂解液和BCA Protein Assay KitP0010S(上海碧云天生物技術有限公司),CHOP和PDI以及GRP78抗體和XBP- 1抗體(ABCAM公司),P- 40裂解液和RIPA裂解液WB- 0071(上海鼎國生物技術有限公司),KitM3121/1859022/ECL- PLUS和Prestained protein marker 00161543(Termo)。X線膠片顯影粉和定影粉(上海冠龍照相材料廠),醫用X光片038401501(Crestream),PVDF膜IPVH00010(Mllipore),SDS- PAGE蛋白電泳儀VE- 180、穩壓電源(電泳用)EPS- 300和蛋白轉膜儀VE- 186(上海天能公司)。熒光顯微鏡IX71(奧林帕斯公司),離心機Fresco 21為賽默飛世爾科技(中國)有限公司產品,倒置顯微鏡XDS- 100為上海蔡康光學儀器有限公司產品,CO2培養箱MCO- 15A為SANYO產品,96 Wounding和Replicator VP408FH為VP scientific公司產品。
1.2 實驗方法
1.2.1 細胞培養 人正常肝細胞LO2培養條件:在37 ℃ 5%CO2細胞培養箱中培養,培養基為DMEM+10%胎牛血清;人肝癌細胞系HepG2培養條件:在37 ℃ 5%CO2細胞培養箱中培養,培養基為DMEM+10%胎牛血清;人肝癌細胞系SMMC- 7721細胞培養條件:在37 ℃ 5%CO2細胞培養箱中培養,培養基為RMPI 1640+10%胎牛血清。3種細胞均按照1∶3~1∶6傳代后提取細胞樣品,PBS洗滌兩次后轉移入EP管中,在冰上裂解15 min,裂解結束后用超聲波將細胞打碎,用離心機離心15 min,得到的上清液即為蛋白樣品。
1.2.2 誘導ERS 取培養獲得的正常肝細胞LO2及肝癌細胞系HepG2細胞和SMMC- 7721細胞,將濃度為150 mmol·L-1的無水乙醇加入到HepG2、LO2和SMMC- 7721細胞中,作用48 h。將無水乙醇棄掉,然后用PBS洗滌2次,從而得到經過無水乙醇進行誘導發生ERS的HepG2、LO2和SMMC- 7721細胞。
1.2.3 細胞裂解液中GRP78、CHOP、XBP- 1及PDI表達的測定 分別將獲得的正常肝細胞LO2、人肝癌細胞系HepG2及SMMC- 7721細胞,以及無水乙醇誘導發生ERS的3種細胞樣品,用PBS洗滌兩次后轉移入EP管中,在冰上進行裂解,裂解時間為15 min,裂解結束后用超聲波將細胞打碎,用離心機離心15 min,得到的上清液即為蛋白樣品。將蛋白樣品上樣,恒壓80 V電泳2 h,4 ℃、 恒流為300 mA的條件下進行電轉150 min,然后將蛋白轉移到PVDF膜上,在室溫下用封閉液(封閉液為含5%脫脂牛奶的TBST溶液)封閉PVDF膜,封閉時間為1 h,然后4 ℃過夜;用TBST洗膜3次,每次洗滌時間為10 min;用Western blotting system試劑盒進行顯色,檢測GRP78、CHOP、XBP- 1及PDI表達。
1.2.4 LV- PDIA2(9923- 1)病毒轉染 取培養獲得的正常肝細胞LO2、肝癌細胞系HepG2細胞和SMMC- 7721細胞,分別加LV- PDIA2(9923- 1)10 μl和病毒CON145(陰性對照)感染細胞。在感染16 h后將培養基更換為常規培養基,然后繼續培養,以綠色熒光蛋白(green fluorescent protein,GFP)為熒光標記慢病毒感染,72 h時用熒光顯微鏡觀察報告基因的表達情況,熒光率即為陽性感染率。
1.2.5 細胞遷移能力檢測 取感染前LO2、HepG2及SMMC- 7721細胞及病毒轉染后的3種細胞約3×104個分別加入含有胎牛血清培養基的96孔板上,次日將培養基換成血清濃度較低的培養基,保持劃痕儀和96孔板的下端中央部位對齊,用力向上輕輕一推形成劃痕。然后用無血清培養基進行漂洗,漂洗2~3遍后在培養基中加入血清濃度較低的培養基(如0.5% FBS),于37 ℃、5%CO2培養箱培養,0、8、24 h拍照,觀察細胞遷移能力。
1.3 統計學處理
所有數據采用SPSS 21軟件進行統計分析,采用非參數檢驗和one- way ANOVA法分析無水乙醇處理前后3種細胞中GRP78和PDI、CHOP、XBP- 1蛋白表達,t檢驗分析3種細胞的遷移能力在病毒轉染前后改變,P<0.05為差異具有統計學意義。
2 結 果
2.1 GRP78、CHOP、XBP- 1在ERS前后的表達
Western blotting檢測發現,無水乙醇處理后LO2、HepG2及SMMC- 7721細胞中GRP78、XBP- 1光密度值升高(圖1、2,表1),差異具有統計學意義(P<0.05),提示3種細胞經無水乙醇處理后發生了ERS;無水乙醇處理后,LO2及SMMC- 7721中CHOP的光密度值也增高(圖3、4,表1),差異具有統計學意義(P<0.05);但無水乙醇處理前后HepG2細胞中均無CHOP表達。
2.2 PDI在ERS前后的表達
Western blotting檢測發現無水乙醇處理前,在SMMC- 7721細胞中PDI的光密度值最高,其次LO2細胞,在HepG2細胞中最低,3種細胞比較差異具有統計學意義(P<0.01)。在無水乙醇處理48 h后,PDI在3種細胞中的光密度值均下降,光密度值從高到低仍然是SMMC- 7721、LO2、HepG2,3種細胞分別與無水乙醇處理前比較,差異具有統計學意義(P<0.05)。見圖5、6,表2。
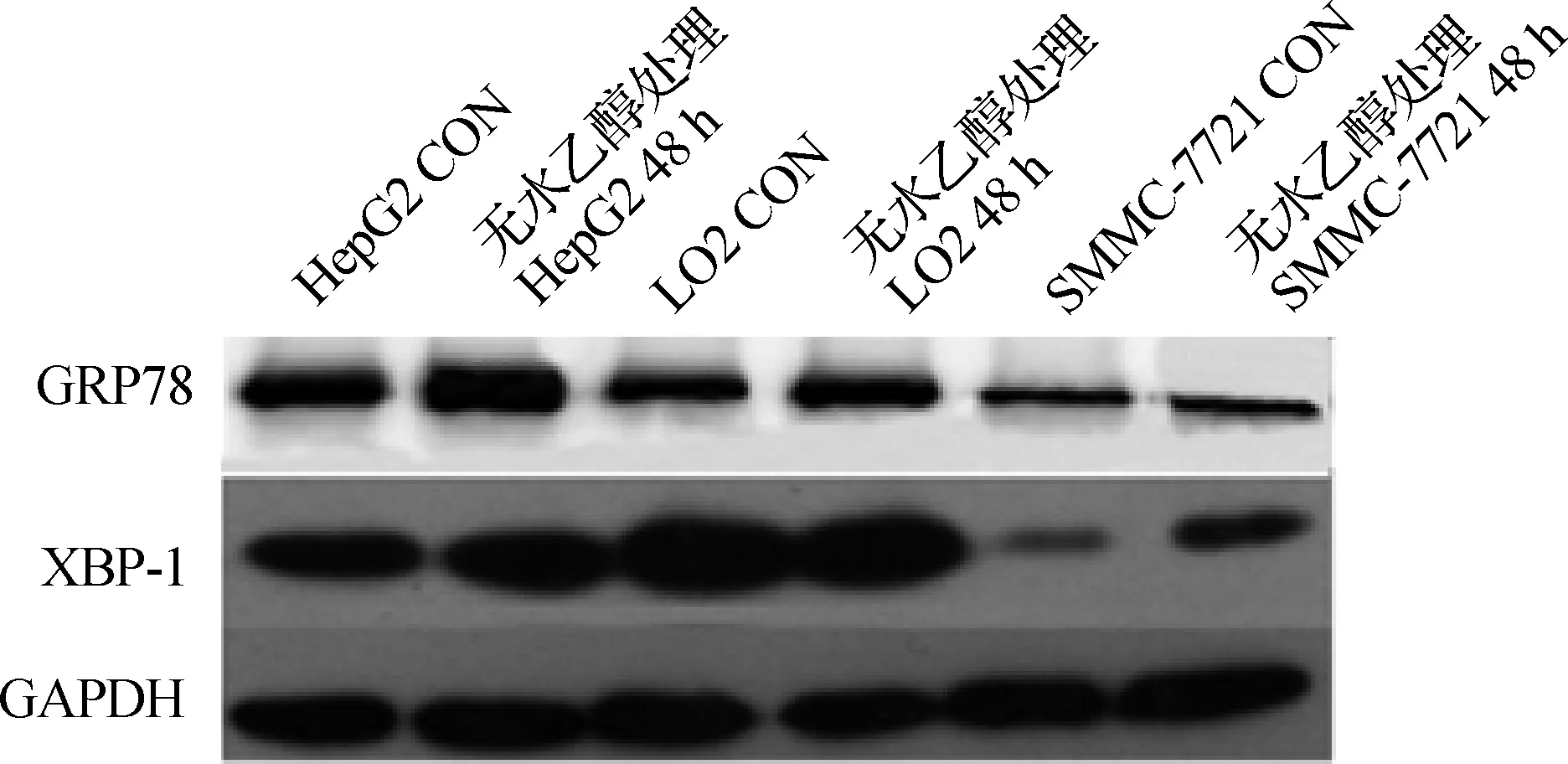
圖1無水乙醇處理前后3種細胞中GRP78、XBP-1表達
Fig1TheexpressionofGRP78andXBP-1inthreekindsofcellsbeforeandafterethanoltreatment
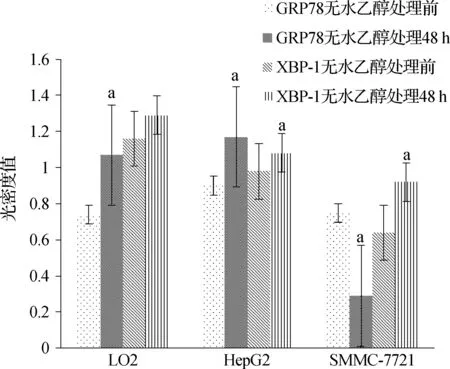
與無水乙醇處理前相比,aP<0.05
圖2無水乙醇處理前后3種細胞中GRP78、XBP-1表達
Fig2TheexpressionofGRP78inthreekindsofcellsbeforeandafterethanoltreatment
表1無水乙醇處理前后3種細胞GRP78、XBP-1、CHOP光密度值
Tab1ThedensityofGRP78、XBP-1、CHOPinthreekindsofcellsbeforeandafterethanoltreatment
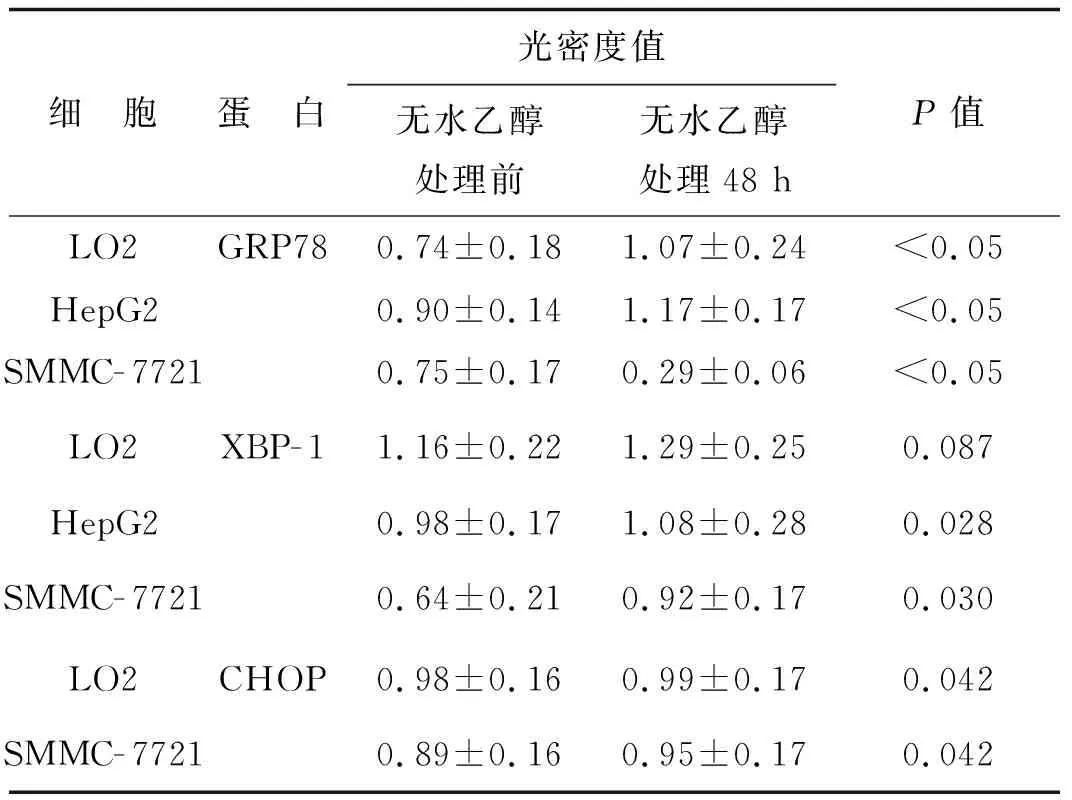
細 胞蛋 白光密度值無水乙醇處理前無水乙醇處理48 hP值LO2GRP780.74±0.181.07±0.24<0.05HepG20.90±0.141.17±0.17<0.05SMMC-77210.75±0.170.29±0.06<0.05LO2XBP-11.16±0.221.29±0.250.087HepG20.98±0.171.08±0.280.028SMMC-77210.64±0.210.92±0.170.030LO2CHOP0.98±0.160.99±0.170.042SMMC-77210.89±0.160.95±0.170.042
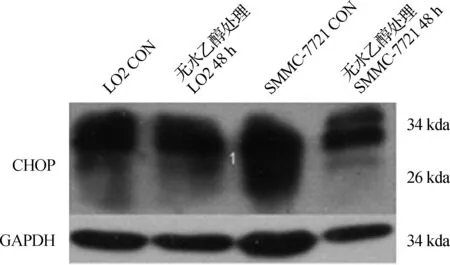
圖3無水乙醇處理前后2種細胞中CHOP表達
Fig3TheexpressionofCHOPintwokindsofcellsbeforeandafterethanoltreatment

與無水酒精處理前相比, aP<0.05
圖4無水乙醇處理前后LO2和SMMC-7721細胞中的CHOP表達
Fig4TheexpressionofCHOPinLO2cellandSMMC-7721cellbeforeandafterethanoltreatment
2.3 PDI對肝癌細胞遷移能力的影響
病毒轉染前3種細胞中HepG2細胞遷移能力最弱,其次為LO2,遷移能力最強的為SMMC- 7721細胞。感染病毒使PDI過表達后,SMMC- 7721細胞遷移能力最強,其次為LO2細胞,HepG2細胞遷移能力最弱;與PDI過表達前比較,LO2細胞遷移能力受到了抑制,而HepG2細胞與SMMC- 7721細胞遷移能力得到了增強。見圖7、8,表3。
3 討 論
原發性肝癌是嚴重危害人類健康的常見惡性腫瘤之一,腫瘤細胞侵襲遷移能力的改變是惡性腫瘤轉移的前提。由于腫瘤處于一種高度細胞分裂增殖的狀態,細胞內營養供應不夠,導致腫瘤細胞長期處于缺氧狀態。而腫瘤細胞缺氧正是ERS的一種強誘導劑,所以,腫瘤組織中有ERS。內質網是蛋白質合成、折疊、組裝、運輸以及參與脂質代謝的場所,并且也儲存細胞內Ca2+離子,細胞中存在一完整機制來促進內質網內蛋白質發生折疊和修飾。當內質網內生理功能發生紊發生紊亂等。內質網還可通過促進凋亡反應誘導腫瘤細胞發生凋亡,內質網也可以通過抗凋亡作用而導致腫瘤細胞發生無限增殖。腫瘤細胞還可以激活未折疊蛋白反應,從而增強生長因子、血管生成因子和細胞因子分泌的能力,從而促進腫瘤細胞的遷移和侵襲[15- 16]。ERS發生時UPR還可以通過影響血管因子的表達促進腫瘤新生血管的生成,許多癌癥相關的病理與內質網穩態的失衡以及誘導ERS和UPR途徑有關,這使得ERS成為近年來腫瘤治療的一個新靶點,目前通常采用參與未折疊蛋白反應的標志性分子,如GRP78、CHOP、XBP- 1等表達水平上調來提示ERS的發生[15- 16]。本研究結果提示,正常肝細胞LO2、肝癌細胞HepG2及高轉移肝癌細胞SMMC- 7721經無水乙醇處理48 h,細胞中ERS標志物GRP78、CHOP、XBP- 1的表達都發生改變(HepG2細胞中CHOP除外),提示經無水乙醇處理48 h的3種細胞都發生了ERS。PDI是附著在內質網膜腔面上的一種氧化還原酶,它可以切斷二硫鍵,形成自由能最低的蛋白質構象,從而幫助新生蛋白質產生正確折疊的構象,還可充當分子伴侶,是內質網中的一種重要的折疊催化劑[17]。PDI可以通過介導氧化蛋白的折疊來維持細胞穩態,研究表明,PDI在多種癌癥的生存和發展中起到重要作用[18]。在本研究中,無水乙醇處理前3種細胞中都有PDI表達,表達量高低依次是SMMC- 772、LO2、HepG2細胞,說明腫瘤細胞的惡性程度越高,PDI表達越明顯。處理48 h后PDI的表達水平均明顯下調,表達量高低順序仍然依次是SMMC- 772、LO2、HepG2細胞,提示PDI表達可能影響SMMC- 7721的轉移能力,表明在肝癌細胞中ERS可以促使PDI進入細胞質,使得PDI減少,增加錯誤折疊的蛋白質,進而使癌細胞保持在ERS狀態,啟動凋亡程序,從而促進細胞死亡。處理前后PDI表達水平不同與肝癌細胞的轉移能力相關,因此需要觀察PDI過表達對肝癌細胞的遷移率的影響。在病毒轉染前3種細胞細胞遷徙能力順序依次是SMMC- 772、LO2、HepG2細胞,病毒感染后3種細胞遷徙能力順序依次是SMMC- 772、LO2、HepG2細胞。與感染前比較,LO2細胞遷移能力受到了抑制,而HepG2細胞與SMMC- 7721細胞遷移能力得到了增強,且隨著細胞惡性程度的增加而增強。這提示肝癌細胞的遷移能力受到PDI的影響,PDI過表達可以促進肝癌細胞的遷移能力,因此這兩種肝癌細胞都表現出遷移傾向加強。有文獻顯示,PDI靜默可以通過降低氧自由基而降低血管平滑肌細胞的遷移能力。內質網正常的生理功能與氧化還原狀態密切相關,越來越多的研究證明ROS和RNS在內質網應激過程中起著介導和調節作用[19- 20]。內質網提供一個獨特的氧化環境促進蛋白質二硫鍵形成,進而在內質網形成ROS,腫瘤細胞的微環境呈現出低氧、低營養和低pH值的狀態,存在錯誤折疊的蛋白質,PDI可切斷錯誤折疊的蛋白質二硫鍵,形成自由能最低的蛋白質構象,幫助形成新的二硫鍵并產生正確折疊的構象,蛋白質的折疊和重折疊需要消耗大量ATP,ATP耗竭導致蛋白質錯誤折疊刺激線粒體氧化磷酸化增加ATP和ROS的產生,進而增加腫瘤細胞遷移能力[21- 22]。且PDI增加越多,ROS形成越多,肝癌細胞遷移能力增強的程度越大。而在正常肝細胞中,穩定的內質網環境的可以使PDI介導錯誤氧化的蛋白質進行二硫化物重組,使ROS減少,從而抑制細胞遷徙能力[23]。
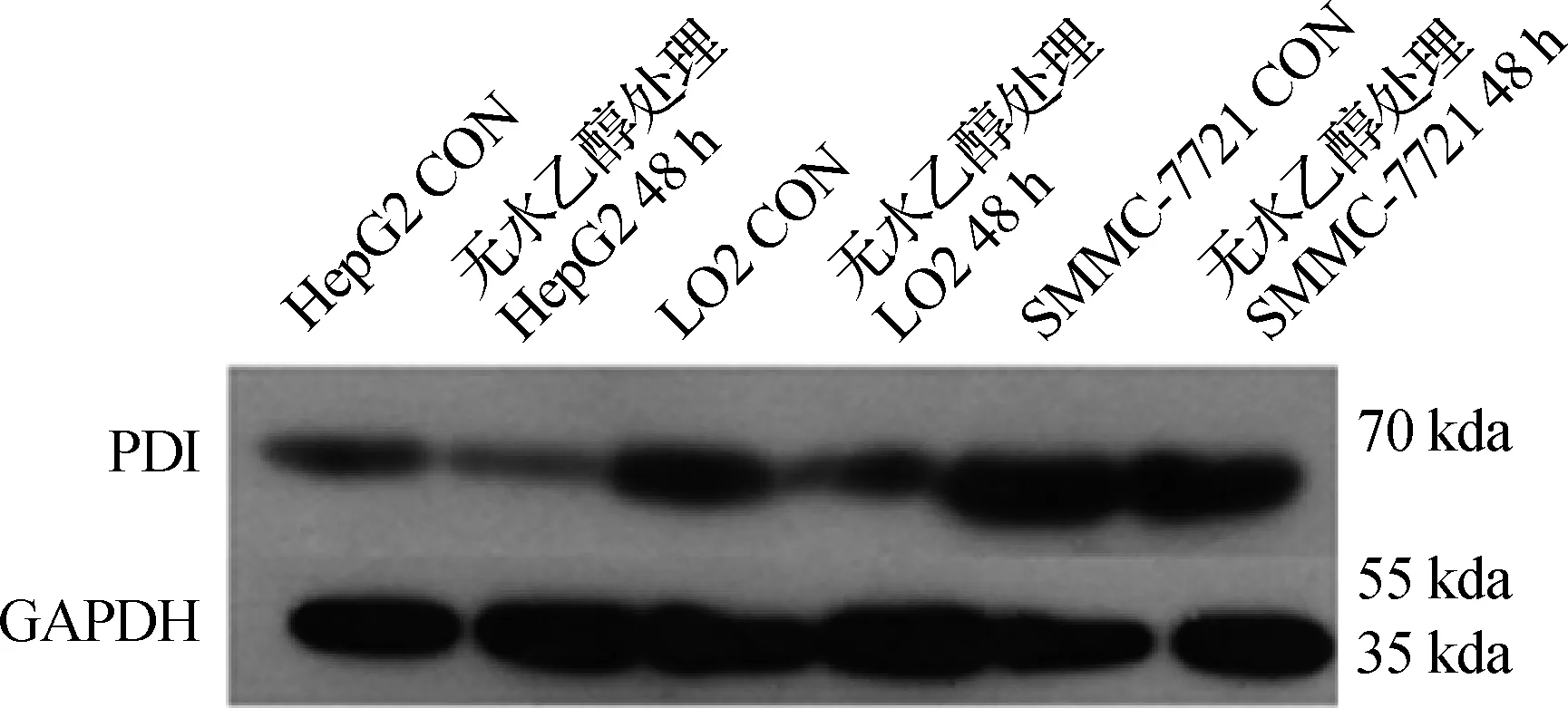
圖5無水乙醇處理前后3種細胞中PDI表達
Fig5TheexpressionofPDIinthreekindsofcellsbeforeandafterethanoltreatment
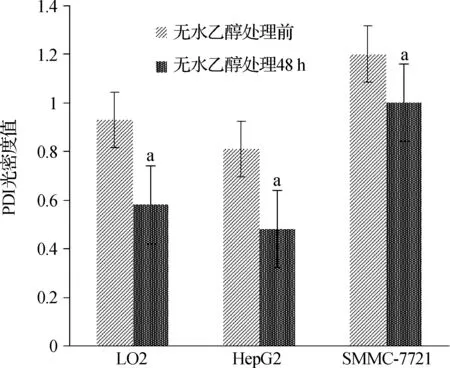
與無水酒精處理前相比,aP<0.05
圖6無水乙醇處理前后3種細胞中PDI表達
Fig6TheexpressionofPDIinthreekindsofcellsbeforeandafterethanoltreatment
表2無水乙醇處理前后3種細胞PDI光密度值
Tab2ThedensityofPDIinthreekindsofcellsbeforeandafterethanoltreatment
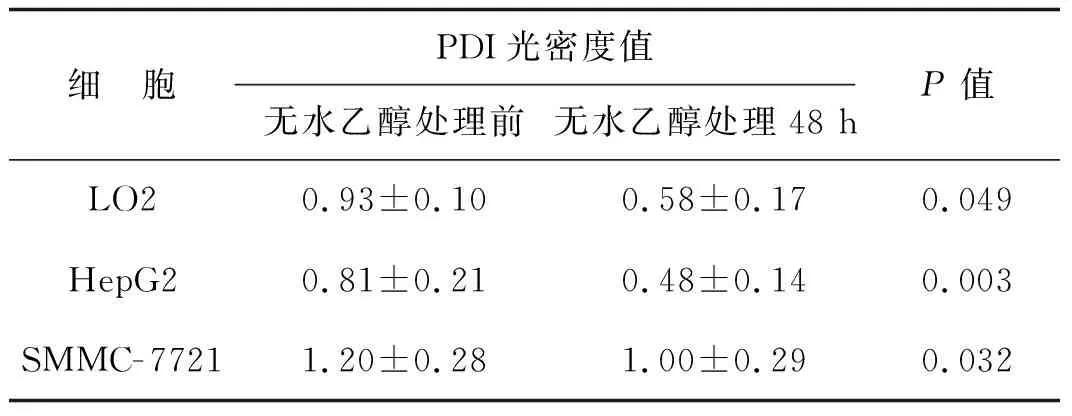
細 胞PDI光密度值無水乙醇處理前無水乙醇處理48 hP值LO20.93±0.100.58±0.170.049HepG20.81±0.210.48±0.140.003SMMC-77211.20±0.281.00±0.290.032
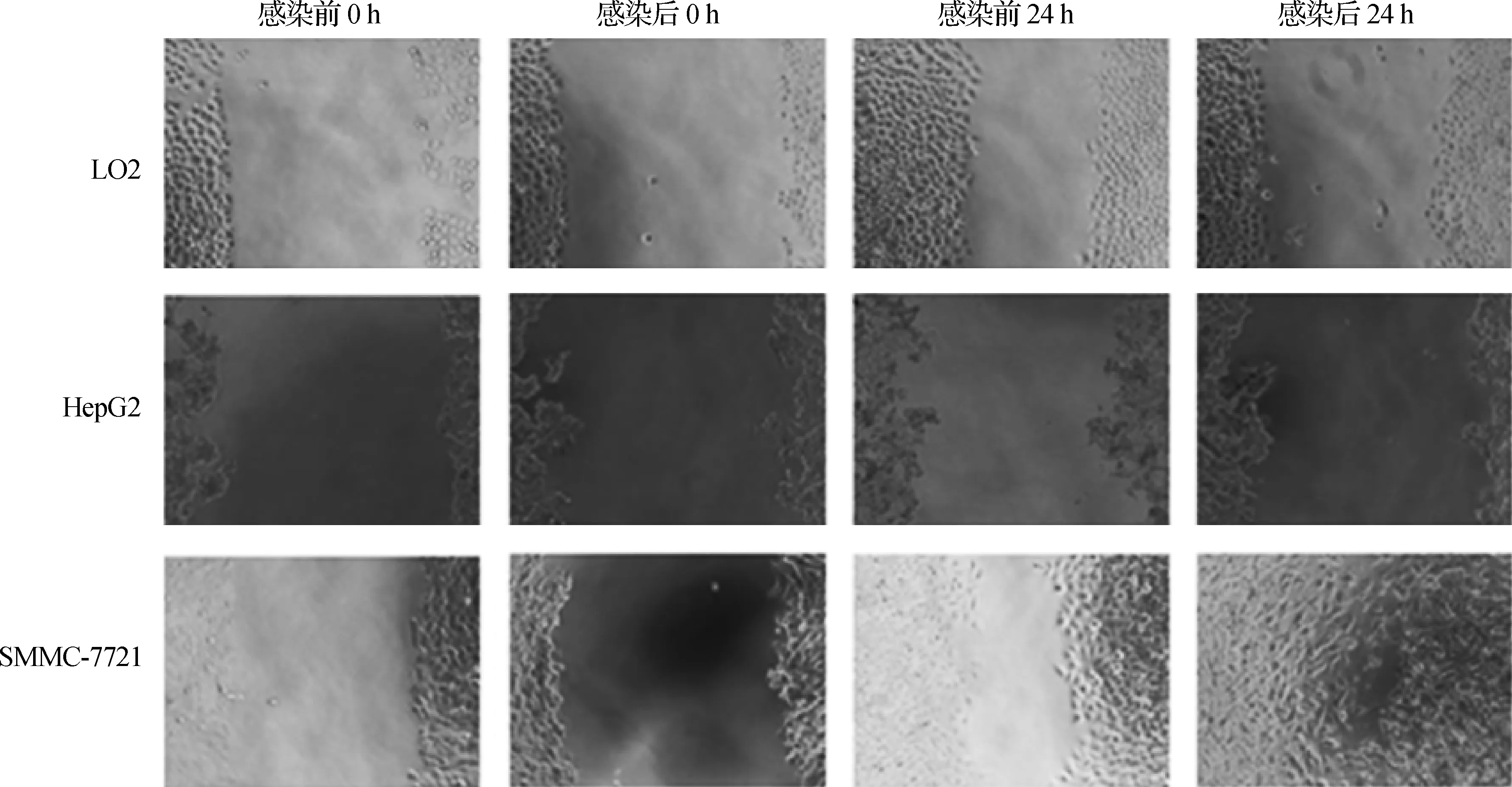
圖7病毒感染前后3種細胞遷移能力(0h,24h)
Fig7Themigrationabilityofthreekindsofcellsbeforeandaftervirustransfection(0h,24h)
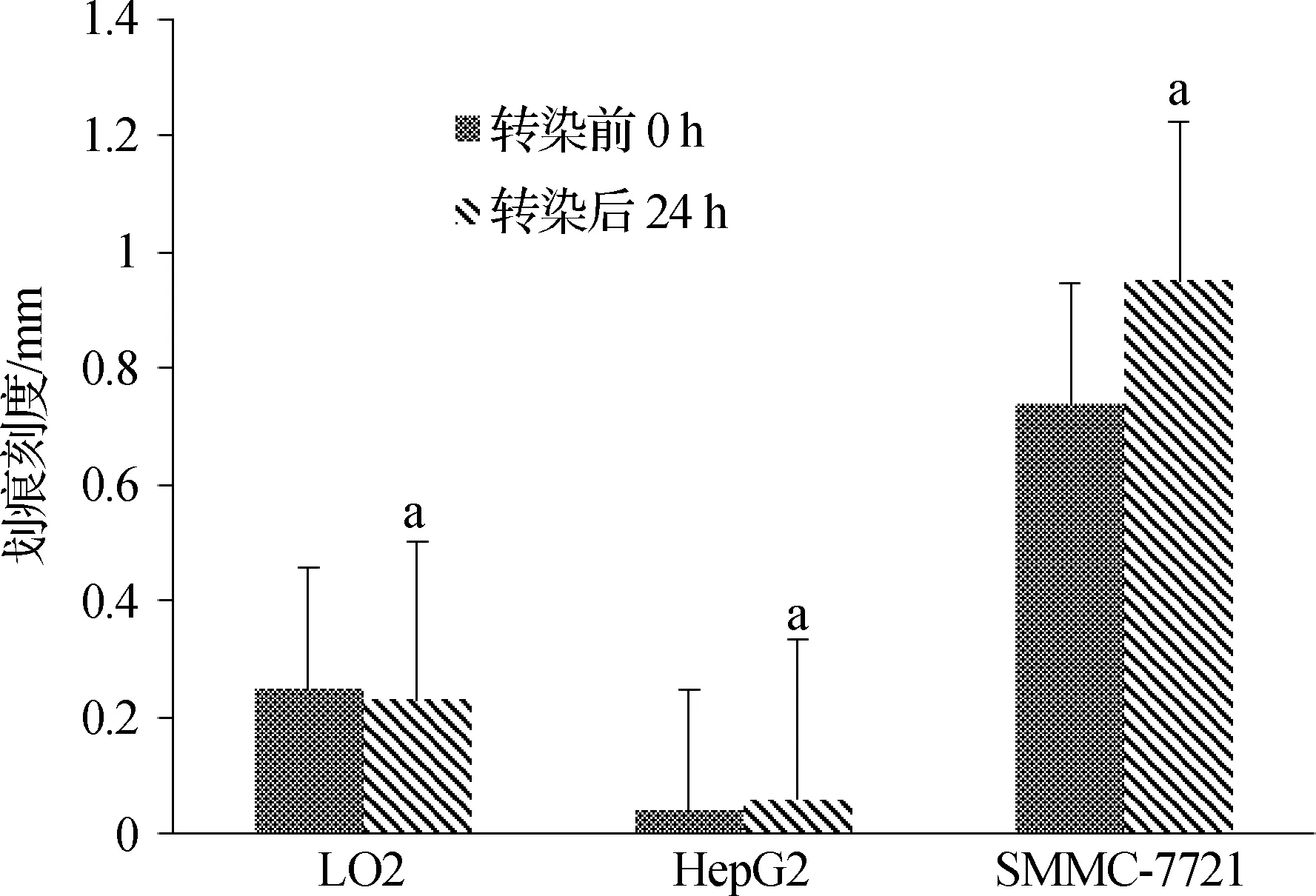
與轉染前相比,aP<0.05
圖8病毒感染前后3種細胞遷移能力
Fig8Themigrationabilityofthreekindsofcellsbeforeandaftervirustransfection
表3病毒轉染前后3種細胞遷移率
Tab3Themigrationabilityofthreekindsofcellsbeforeandaftervirustransfection
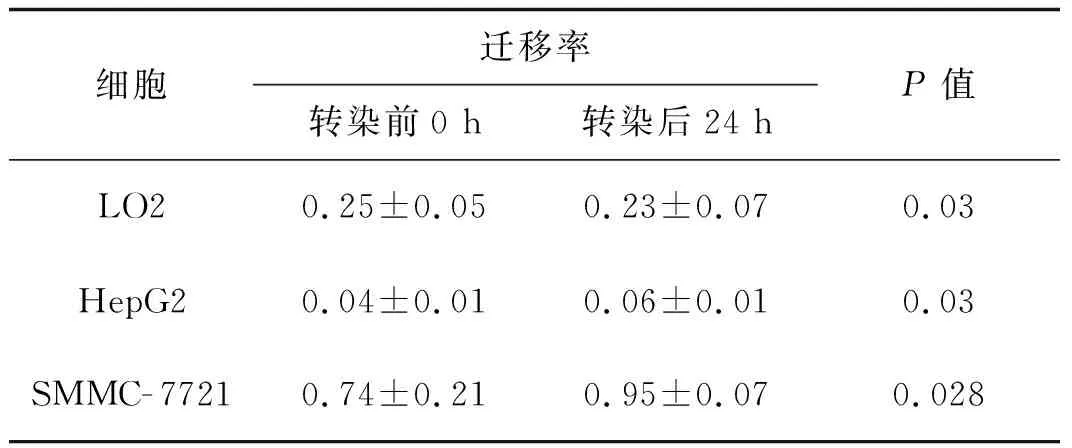
細胞遷移率轉染前0 h轉染后24 hP值LO20.25±0.050.23±0.070.03HepG20.04±0.010.06±0.010.03SMMC-77210.74±0.210.95±0.070.028
亂時,將導致ERS一系列反應出現,包括蛋白質翻譯停滯、蛋白質折疊能力增強、蛋白質的降解加速或者細胞內Ca2+
ERS標志物GRP78、CHOP、XBP- 1及PDI在正常肝細胞LO2中都具有一定的表達,而無論是在肝癌HepG2細胞還是高轉移能力的肝癌SMMC- 7721細胞中ERS標志物的表達水平均與正常肝細胞不同,提示正常肝細胞和惡性腫瘤細胞的ERS反應程度不同。無水乙醇處理前后SMMC- 7721的PDI表達水平在3種細胞中最高,轉染病毒使PDI過表達時,SMMC- 7721細胞的遷移能力明顯增強,提示PDI表達水平升高與腫瘤的高轉移能力有關[24- 29]。

