成人Still病合并肺孢子菌肺炎和巨細胞病毒肺炎5例臨床分析
張 祎 黃 絮 易 麗 李 敏 顧思超 詹慶元
成人Still病(adult-onset Still’s disease,AOSD)是以發熱、關節痛和/或關節炎、皮疹、肌痛、咽痛、淋巴結腫大、白細胞總數和中性粒細胞、血小板增多為主要表現的結締組織疾病,嚴重者可伴發系統損害、噬血綜合征等炎癥反應。糖皮質激素、免疫抑制劑或生物制劑是AOSD的主要治療手段,但接受治療的患者常處于免疫抑制狀態,是肺部機會性感染的高危人群。肺孢子菌(pneumocystis carinii,Pc)和巨細胞病毒(cytomegalovirus,CMV)是免疫功能缺陷者常見的肺部感染病原微生物,其導致的肺部感染臨床癥狀不特異且進展迅速,病死率較高,應引起臨床重視。查閱文獻,尚未見到國內外有關AOSD合并肺孢子菌肺炎(pneumocystis pneumonia,PCP)的報道,Pc與CMV混合感染的病例亦為首次報道。2013年1月至2017年3月,本院共收治5例,現分析報道如下。
資料與方法
1.一般臨床資料 通過計算機病案管理系統檢索選擇,2013年1月至2017年3月,在中日友好醫院住院,符合AOSD的Yamaguchi診斷標準[1](表1),診斷為AOSD合并PCP的患者共5例為研究對象,一般資料見表2。

表1 AOSD的Yamaguchi診斷標準
2.病原學檢測方法 本組5例PCP患者均通過支氣管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)聚合酶鏈反應(polymerase chain reaction,PCR)法檢出Pc病原體的線粒體大亞基(mtLSU)rRNA和CMV DNA特異性基因片段和結合臨床特征而診斷,經六胺銀染色未檢測到Pc包囊。發病時間至確診時間為13~30 d。
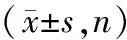
表2 5例AOSD合并PCP患者一般資料
3.統計學方法 數據分析使用SPSS 22.0軟件包進行。符合正態分布的計量資料以均數±標準差表示,采用t檢驗;非正態分布資料采用中位數(M)及四分位數間距(P25, P75)表示,采用秩和檢驗。以P<0.05為差異有統計學意義。
結 果
1. 臨床癥狀、體征和原發病治療 (1)臨床癥狀:1例于門診常規復診時發現肺部濕啰音,胸部影像學異常入院。其余4例以咳嗽為首發癥狀,伴發熱3例,咳痰3例,呼吸困難1例。患者主訴呼吸系統癥狀時無皮疹、關節疼痛、咽痛等AOSD活動的表現,急性病程2例,亞急性病程2例。患者發病時間于確診AOSD并接受治療后2~19個月。
(2)體征:1例患者雙肺呼吸音清,未聞及干濕性啰音;4例聽診雙肺呼吸音粗糙;2例患者肺底聞及局限性濕啰音;1例患者肺底聞及爆裂音。
(3)原發病治療:5例患者均正在接受中等劑量糖皮質激素治療及免疫抑制劑治療。3例因新發呼吸系統癥狀就診及1例常規復診的患者均于AOSD癥狀控制良好、激素減量過程中出現臨床癥狀。另1例患者維持原激素治療用量>6個月。3例使用環孢素A,2例使用甲氨喋呤。所有病例近3月內均未使用激素沖擊或新型生物制劑治療。

圖1 5例患者此次入院及確診AOSD時ESR、血清CRP及Fet水平注:與此次入院比較,*P<0.05,**P<0.05
2.實驗室及影像學檢查 (1)一般實驗室檢查:外周白細胞計數為(10.08±1.72)×109/L,其中有3例患者>10×109/L;,中性粒細胞比例70.6%~96.1%,淋巴細胞比例2.9%~22.2%。5名患者均無肝功能損傷表現。作為評價全身炎癥活動的指標,C反應蛋白(CRP)4.3~22.2 g/L,血沉16~88mm/h,平均值明顯低于AOSD確診時水平,且差異具有統計學意義(圖1 A~B)。血清鐵蛋白(Ferritin, Fet)差異極大,為117.1~2 637.7g/L,但5例均明顯低于AOSD確診時水平(圖1C)。所有病例血LDH均有不同程度升高。5例患者中有4例患者CD4+T淋巴細胞減少,1例計數<100/mm3,2例計數100~200/mm3,1例計數200~300/mm3。患者此次入院及確診AOSD時臨床資料見表3。
5例患者根據入院當時血氣分析計算氧合指數145~415mmHg(1mmHg=0.133kPa),4例患者入院時存在低氧血癥。其中3例呼吸衰竭進展,2例接受正壓機械通氣的患者最低氧合指數<100mmHg(表3)。

圖2 AOSD合并PCP患者胸部CT A:雙肺彌漫磨玻璃影;B:雙側不均勻斑片影,局部可見支氣管充氣征; C:線狀或網狀肺小葉間隔增厚影
(2)影像學檢查 胸部X線特點:①5例均有雙肺透亮度下降并呈毛玻璃樣變;②2例患者雙肺紋理粗重、紊亂模糊,并呈小網格狀或絮狀模糊影;③l例肺紋理重伴少許模糊索條影。
胸部HRCT的主要特點:①毛玻璃影:5例患者均表現為肺部彌漫毛玻璃樣不透明區 (圖2A);②斑片影:2例表現為雙側不均勻斑片影,局部可見支氣管充氣征(圖2B);③小葉間隔病變:2例表現為線狀或網狀肺小葉間隔增厚 (圖2C)。治療過程中復查胸部CT,合并存在其他肺部影像學表現有沿支氣管分布的不規則索條影1例,呈現肺纖維化表現(圖3A);自發性氣胸、縱隔氣腫1例(圖3B)。
(3)病原學檢查:5例患者中3例血G試驗呈陽性,GM試驗均陰性。BALF送檢細菌、真菌、分枝桿菌涂片及培養,呼吸道常見病原學核酸檢測。5例Pc及CMV核酸檢測陽性;3例伴EBV核酸陽性。唯一1例接受有創正壓機械通氣患者BALF中Pc、CMV、EB及甲型流感病毒核酸檢測均陽性。2例在ICU接受正壓機械通氣過程中合并鮑曼不動桿菌感染。
5例患者均接受血漿CMV及EBV核酸定量檢測,其中1例CMV核酸定量1.21×104/copies,EBV核酸定量1.59×104/copies,余患者核酸定量均陰性。
3.治療情況 5例患者均首選口服復方磺胺甲基異惡唑(SMZ/TMP)治療,劑量為SMZ 75~100 mg·kg-1·d-1,TMP 15~20 mg·kg-1·d-1,分3~4次服用,療程2~3周。同時靜脈輸注更昔洛韋,5 mg·kg-1·次-1,每日2次,療程2~3周。
3例繼續維持入院前糖皮質激素劑量,為口服強的松或甲潑尼龍,1~2次/d,1例停用口服激素后換用等劑量靜脈激素制劑,上述4例患者均繼續免疫抑制劑使用。1例病情危重患者,氣管插管后由激素減量并改為靜脈甲潑尼龍40mg 1次/d,并停用免疫抑制劑,后因患者再次出現高熱、白細胞升高及鐵蛋白升高,予激素加量并恢復免疫抑制劑使用。
病原學檢測結果尚未明確時經驗性應用抗細菌、抗真菌治療,合并混合感染者同時給予相應的抗細菌治療。

圖3 AOSD合并PCP患者接受治療過程中復查胸部CT A:沿支氣管分布的不規則索條影,伴牽拉性支氣管擴張;B:左側 氣胸,縱隔氣腫
3例患者在經鼻高流量吸氧,2 例患者在無創正壓機械通氣輔助下完成支氣管肺泡灌洗檢查。1例患者使用傳統方式(儲氧面罩)吸氧,1例患者使用經鼻高流量吸氧。1例患者接受48h的BiPAP模式無創正壓機械通氣后成功撤離。1例患者在BiPAP模式無創機械通氣7d后發生氣胸及縱隔氣腫,改為經鼻高流量吸氧,因肺壓縮<20%未予胸腔閉式引流。還有1例患者在無創正壓機械通氣48h后失敗,接受有創正壓通氣,常頻通氣10d后,影像學出現肺部早期纖維化特征,發生氣壓傷風險日益增加,因此改為高頻振蕩通氣(high frequency oscillatory ventilation,HFOV)支持6d,后改為常頻通氣,繼而順利拔除氣管插管,序貫無創機械通氣(表4)。
4.預后 5例AOSD合并PCP和CMV肺炎患者均好轉出院。ICU住院天數1~35d。
討 論
糖皮質激素是AOSD的一線治療用藥,約60%患者應用激素單藥可控制癥狀[2]。癥狀難以控制、反復發作或激素難以減量的,推薦聯合使用甲氨蝶呤、環孢素A或環磷酰胺等免疫抑制劑[3]。近年來,拮抗TNF-α,IL-1,IL-6等細胞因子的新型生物制劑聯合激素治療難治的AOSD已有較多成功病例報道[4]。但上述藥物均可導致免疫抑制,增加嚴重肺部機會性感染風險,甚至快速進展為呼吸衰竭。
接受治療的AOSD患者出現呼吸系統癥狀,伴隨快速進展的影像學改變甚至呼吸衰竭時,首先需鑒別是活動肺部受累還是新發感染。AOSD造成的原發肺部病變并不常見,且均發生于疾病活動期。有學者總結了單中心40余年收治的臨床病例共57例,排除感染、藥物毒性及心源性因素后,僅有3例(5.3%)符合AOSD原發病相關的肺部受累,發生率極低。該學者還結合既往文獻報道的27例AOSD合并原發肺部病病例,統計出AOSD相關的肺部受累中ARDS約占40%(12/30),均出現在疾病活動期,大部分在起病第一年出現,在病程中早發;而非彌漫性肺部受累,則可出現在疾病的不同階段,多表現為雙肺下葉纖維化或滲出實變影,彌漫性肺泡出血、胸腔積液亦有報道[5]。國內還曾報道過以彌漫性小葉中心結節為表現的病例[6]。糖皮質激素、免疫抑制劑及生物制劑對原發病造成的肺部受累一般有效[5,7]。但我們報道的5例患者呼吸系統癥狀在病程中出現較晚,血清Fet等炎性指標無動態升高,無多系統損傷加重的臨床表現,處于疾病穩定期。通過評價免疫功能,5例患者中有4例患者CD4+T淋巴細胞減少,且均存在免疫球蛋白不同程度降低,因此在臨床診斷上應首先考慮機會致病菌感染。

表3 5例AOSD合并PCP患者的實驗室檢查
注:與此次入院比較,*P<0.05,**P<0.01
目前AOSD合并肺部感染僅見病例報道或單中心小樣本量觀察性研究。國內學者通過61例病例總結,證實嚴重感染和呼吸衰竭是導致AOSD患者死亡的主要原因[8]。AOSD合并化膿性細菌、曲霉菌、奴卡菌、CMV的肺部感染均有報道[9-11]。但檢索國內外文獻,我們均未見AOSD合并PCP的病例報道。黃絮、翁利等通過對本中心及北京協和醫院Pc核酸檢測陽性的非HIV患者統計發現,合并CMV感染的高達58%[12]。而這5例患者BALF中CMV核酸檢測均為陽性,符合上述病原微生物混合感染的臨床規律。而唯一一名需有創機械通氣支持的女性患者CD4+T細胞數量僅為71/mm3,除Pc、CMV、EBV病毒外,甲型流感病毒核酸檢測亦為陽性,上述病原體混合感染無論在AOSD還是在其他結締組織病患者中均尚無報道。因此,因此當長期應用激素及免疫抑制劑的AOSD患者影像學出現彌漫特征時,必須考慮混合感染可能,建議早期經驗性使用抗Pc及CMV的聯合治療,在流感季節尚需警惕合并流感病毒感染。盡快取得下呼吸道分泌物標本進行病原學檢測是后續治療的關鍵,支氣管肺泡灌洗檢查可作為免疫抑制患者獲得病原學診斷的首選方法[13]。

表4 5例AOSD合并PCP患者的呼吸輔助治療
PCP和CMV肺炎在胸片及胸部CT上均可表現為彌漫性滲出性病變,病灶呈大片磨玻璃樣改變,同時可有斑點狀、片狀、網狀病變,多沿支氣管分布。但二者在影像學上有如下區別:①PCP病變由肺門區向肺野輻射,而上肺尖或上肺野及周圍肺野多不受累,這種改變是由于病原體沿支氣管氣道離心性擴散所致[14];而CMV肺炎多有中下肺向上肺蔓延,最終受累肺野范圍更廣泛。②由于Pc菌體可造成呼吸性細支氣管滲出、阻塞,可在胸部CT上形成典型氣囊或“馬賽克征”,PCP較易合并氣胸或縱隔氣腫,一旦出現氣胸,提示預后不良[15]。③與PCP相比,CMV肺炎中不均勻斑片影,甚至局部實變影更常見,多沿支氣管分布,部分可融合為廣泛的“棉團”樣影,小結節影甚至結節影亦常見[16]。
本文報道的5例患者均表現為肺部彌漫毛玻璃樣不透明區,均有邊緣肺野受累;其中4例肺尖部位無“豁免”,2例中下肺野出現較大范圍的沿氣道分布的不均勻斑片影。上述影像學改變難以用Pc單一病原完全解釋,最終病原學結果也證實為混合感染。我們報道的5例AOSD合并PCP和CMV肺炎患者無一例外是在原發病控制的時間窗內新發,多數(4/5)處于激素減量過程中。出現這種現象的具體機制尚不清楚,但觀察到非HIV PCP患者的病情嚴重程度并非與T細胞數量、特別是CD4+T細胞數量呈負相關[17]。糖皮質激素導致的T淋巴細胞數量減低雖利于Pc繁殖,增加PCP發生的幾率,但同時還可以通過抑制炎性反應的作用減輕對肺組織的損傷,而在激素減量過程中隨著這種炎癥抑制作用的減弱,T淋巴細胞介導的肺組織損傷加重,甚至可因免疫重建而打破炎癥與抗炎反應之間的平衡,損害宿主,呈現出免疫重建炎癥綜合征(immune reconstitution inflammatory syndrome,IRIS)反應[18]。在非HIV且激素減量過程中發生PCP的患者,如何調整激素用量存在較大爭議,而針對AOSD合并PCP的激素及免疫抑制劑應用尚無報道[19]。在這5例患者的治療中,我們綜合分析AOSD處于穩定期,激素減量過程中Pc所誘發的機體不適當免疫激活是造成肺損傷的主要因素,因此維持甚至適當增加激素劑量,可能會減輕過度炎癥反應,改善預后。
在呼吸支持治療方面,因使用糖皮質激素等因素導致免疫抑制人群合在并嚴重肺部感染后,進展為急性低氧性呼吸衰竭的比例較免疫力正常者更高[20],而發生氣管插管和機械通氣相關的各種并發癥的比例也更高[21]。經鼻高流量吸氧能在保證吸氧濃度同時有效加溫加濕,在免疫抑制合并感染患者中耐受性好,有助于氣管鏡檢查的實施[22]。在PCP合并縱隔氣腫或氣胸患者中,能減輕無創正壓機械通導致的氣壓傷。對病情較重(RR>30次/min,輔助呼吸肌參與呼吸,氧合指數<200mmHg)者應盡早使用無創機械通氣并盡可能延長其使用時間[23];對于接受有創機械通氣的患者,序貫無創機械通氣,實現早期拔管,對減少VAP等并發癥具有重要意義[24]。
多個研究證實HFOV能在改善氧合同時下降低平均氣道壓,降低氣壓傷風險[25]。但RCT研究發現,相比常頻肺保護通氣策略,HFOV未能改善病死率[26]。在嚴重低氧血癥中HFOV能否作為一線治療意義尚存在爭議。但現有RCT證據級別較低,針對非HIV免疫抑制患者的呼吸支持研究中引用HFOV還缺乏相關報道,篩選氣道分泌物少,血流動力學穩定的嚴重低氧患者更有可能獲益。其中1例AOSD合并PCP及CMV肺炎患者成功實施HFOV,有效改善氧合且未發生氣壓傷,由此我們認為,對于因經濟原因難以實施ECMO治療,以及有ECMO治療禁忌癥,以及導管相關血流感染風險較高的免疫抑制患者,充分評估氣道分泌物及血流動力學情況后,可將HFOV作為候選治療方案。
5例PCP患者并無一例死亡,其中2例病情較重的患者雖在病程超過2周后呈現出早期纖維化的影像表現,但肺部病變最終均完全吸收。筆者推測,與其他結締組織疾病相比,AOSD造成的原發肺部損傷罕見,伴發淋巴細胞介導的免疫紊亂程度較輕,因Pc和CMV所誘發的機體不適當免疫激活導致的肺損傷也較輕,患者如能結合及時診斷和合理治療,預后較好。因AOSD易復發,激素、免疫抑制劑需維持較長時間,對高危人群可考慮使用Pc預防性治療。

