褪黑素對miRNA-223表達的影響及對膿毒癥小鼠心肌損傷保護作用的機制
劉銘傳,李林成,曹夢遠,張家寧,劉 洋,何 亭
膿毒癥及膿毒癥休克是危重癥領域的重大難題,病死率為25%~30%,合并休克的患者病死率更高,為40%~50%[1]。2016年膿毒癥與膿毒性休克處理國際指南定義“膿毒癥3.0”:針對感染的失調的宿主反應引起的危及生命的器官功能障礙[2]。多項研究表明,褪黑素具有延緩衰老、抗擊腫瘤、抗炎、抗氧化、改善睡眠、調節免疫等作用,可能有助于改善膿毒癥的器官損傷[3-6]。MicroRNAs是一類具有基因表達調控功能的非編碼RNA[7]。研究顯示,MicroRNAs在炎性反應中起著關鍵作用,被證實是潛在的膿毒癥生物標志物[8],而miRNA-223是其中之一。本研究擬通過觀察褪黑素對膿毒癥小鼠miRNA-223及炎性因子和心肌損傷的影響,來初步判斷褪黑素和miRNA-223的關系及其對膿毒癥小鼠心肌損傷的保護作用。
1 實驗材料與方法
1.1動物、主要試劑及儀器來源 健康清潔級雄性C57BL/6小鼠[許可證號:SYXK(軍)2012-0022]48只,鼠齡6~8周,重量18~20 g,購自空軍軍醫大學實驗動物中心。腫瘤壞死因子-α(TNF-α)、白介素(IL)-1β、IL-6均從南京建成生物工程研究所購買。Bcl-2、Bax多克隆抗體(美國Santa Cruz Biotechnology公司),兔抗小鼠β肌動蛋白抗體(美國Cell Signal公司),辣根過氧化物酶標記的山羊抗兔IgG、二抗山羊抗鼠IgG二抗(武漢博士德生物工程有限公司),SYBR Green MasterMix(美國ABI公司),內毒素(Sigma公司),Trizol試劑(美國Invitrogen公司),氯仿,異丙醇,乙醇,DEPC處理水等均為國產分析純。3-18K型高速冷凍離心機(Sigma公司),7900HT型熒光定量PCR儀(美國應用生物公司),ImageMaster凝膠成像分析儀(Applied Biosystems公司)。紫外線分光光度計、mini PROTEAN型垂直電泳儀、電轉移儀(美國Bio-Rad公司)。
1.2動物分組及膿毒癥模型制備 小鼠實驗前分籠飼養24 h,自由飲食,按隨機數字表法分為3組,每組16只。生理鹽水組、褪黑素治療組給予內毒素10 mg/kg一次性腹腔給藥制備膿毒癥模型,假傷組于腹腔內注射等體積生理鹽水。
1.3動物給藥處理 褪黑素治療組于建模前30 min、建模時、傷后4 h分3次注射褪黑素(30 mg/kg),生理鹽水組和假傷組均在褪黑素治療組相應給藥時間點注射等量生理鹽水。3組小鼠處理后分籠飼養,自由飲食。
1.4血清及臟器標本采集 3組各取8只小鼠在處理24 h后,通過腹腔注射戊巴比妥鈉(40 mg/kg)進行麻醉,眼球采血1 ml。室溫靜置15 min后,12 000 r/min條件下離心15 min后收集上層血清,分裝在Eppendorf管中,置于-80℃條件下保存。其余小鼠在處理48 h后提取心肌組織:麻醉后采用頸部脫臼法處死小鼠,并立即剪取心肌組織,用4℃冰生理鹽水沖洗干凈,其中一部分用多聚甲醛固定,其余部分置于-80℃下凍存。
1.5檢測指標
1.5.1酶聯免疫吸附試驗(ELISA)檢測血清中IL-1β、IL-6含量:取出-80℃冰箱血清標本,按照IL-1β、IL-6 ELISA檢測試劑盒操作說明,已知抗體稀釋緩沖液包被,4℃過夜,洗滌,設立空白孔,每孔加待測血清,37℃孵育1 h,洗滌,各孔加酶標抗體,溫育,洗滌,加底物液顯色,終止反應,空白孔調零,利用酶標儀450 nm波長測各孔吸光度(OD)值,繪制標準曲線,計算血清IL-1β、IL-6表達水平。
1.5.2蛋白免疫印跡法檢測心肌組織中凋亡相關因子Bcl-2、Bax蛋白表達:取出-80℃下凍存的心肌組織,加入裂解液后,吹打并轉移至Eppendorf管中,對提取蛋白進行定量。加入上樣緩沖液后,100℃高溫變性10 min。用10%十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離蛋白質,4℃電轉膜100 min。使用5% TBST脫脂奶粉洗膜,共洗3次,每次5 min。然后加入抗Bcl-2抗體(美國Santa Cruz Biotechnology公司,1∶1000),抗Bax抗體(美國Santa Cruz Biotechnology公司,1∶1000)。4℃過夜,再用TBST洗掉一抗,加入山羊抗兔特異性二抗(HRP標記的二抗1∶3000),37℃條件下孵育1 h。TBST洗去二抗,共洗3次,每次5 min。加入化學發光液,用ImageMaster凝膠成像分析儀成像及掃描分析,目的蛋白表達水平按照與β-actin灰度比值來表示。實驗重復3次。
1.5.3心臟組織切片HE染色觀察組織形態:取出多聚甲醛固定的各組心臟組織,乙醇梯度脫水,常規石蠟包埋切片,經HE染色,在低倍鏡下觀察3組小鼠心肌組織的病理變化情況。
1.5.4實時熒光定量PCR法檢測心肌組織中miRNA-223含量:取出-80℃下凍存的心肌組織,按照組織與生理鹽水1∶9制成組織勻漿,3000 r/min離心15 min,取上清液,按照1∶1加入1 ml Trizol試劑,按說明書要求提取RNA,且反轉錄出cDNA。反應結束后,將制得的cDNA行PCR擴增,以U6為內參,擴增條件為:95℃預變性 10 min,95℃變性10 s,60℃退火延伸20 s,循環40次,每個循環結束后檢測熒光信號,測定結果按照2-△△Ct相對定量方法計算。每個標本設置3個復孔,實驗重復3次。
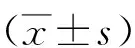
2 結果
2.1血清IL-1β、IL-6水平 3組血清IL-1β、IL-6水平比較差異有統計學意義(P<0.01);生理鹽水組和褪黑素治療組血清IL-1β、IL-6水平高于假傷組,但褪黑素治療組低于生理鹽水組(P<0.01)。見表1。
2.2心肌組織中Bcl-2、Bax蛋白表達水平 3組心肌組織中Bcl-2、Bax蛋白表達水平比較差異有統計學意義(P<0.01)。生理鹽水組、褪黑素治療組心肌組織中Bcl-2表達水平低于假傷組,而褪黑素治療組高于生理鹽水組(P<0.01);生理鹽水組、褪黑素治療組心肌組織中Bax蛋白表達水平高于假傷組,褪黑素治療組低于生理鹽水組(P<0.01)。見圖1、表2。

表1 3組小鼠血清白介素-1β和白介素-6水平比較
注:與假傷組比較,bP<0.01;與生理鹽水組比較,dP<0.01

圖13組小鼠傷后24h心肌組織中凋亡相關分子Bcl-2、Bax蛋白表達

表2 3組小鼠傷后24 h心肌組織中凋亡相關分子Bcl-2、Bax蛋白表達
注:與假傷組比較,bP<0.01;與生理鹽水組比較,dP<0.01
2.3小鼠心肌組織病理變化 假傷組心肌纖維排列整齊,界限清楚,細胞核清晰,核膜完整,無炎性細胞浸潤;生理鹽水組心肌纖維明顯腫脹,排列不齊,可見有胞核破碎,胞質嗜酸性增強,凋亡細胞體積縮小,間質內大量炎性細胞浸潤;褪黑素治療組損傷程度有所減輕,心肌纖維稍腫脹,排列較整齊,有少量炎性細胞浸潤。見圖2。

圖2 3組小鼠傷后48 h心肌組織病理檢查結果(HE×200)
2.4心肌組織miRNA-223表達水平 假傷組、生理鹽水組和褪黑素治療組小鼠心肌組織miRNA-223表達水平分別為0.97±0.15、0.29±0.10、0.66±0.10,3組比較差異有統計學意義(P<0.01)。褪黑素治療組及生理鹽水組心肌組織miRNA-223表達水平均低于假傷組,褪黑素治療組高于生理鹽水組(P<0.01)。
3 討論
膿毒癥是由感染引起的全身炎癥反應綜合征[9],嚴重者出現膿毒癥休克,甚至導致多器官功能障礙(MODS),而心功能衰竭是膿毒癥的主要表現之一,一旦膿毒癥合并心肌損傷,患者病死率將明顯升高[10-11]。膿毒癥損傷心肌引起心肌功能障礙,主要表現為心室擴張、左心室射血分數下降以及收縮峰值壓力/收縮末期容積比值下降等[12],其發病機制復雜,涉及失控性炎性反應、氧化應激以及免疫功能紊亂等多個方面[13],而過度炎性反應介導的組織損傷是公認的重要發病機制之一。有研究顯示,膿毒癥感染通過Toll樣受體、核因子-κB(NF-κB)以及p38-MAPK等信號通路產生大量炎性因子損傷心肌,嚴重者引起心功能衰竭[14-15]。本研究結果顯示,生理鹽水組、褪黑素治療組心肌組織IL-1β、IL-6水平均高于假傷組,提示內毒素導致炎性反應明顯增強,小鼠膿毒癥模型制備成功。
膿毒癥的治療是醫療領域的重大難題,而褪黑素是近年發現的有效藥物之一,其不僅能夠調節睡眠,同時具有強大的抗炎和抗氧化作用[16-17],褪黑素抗炎和抗氧化對膿毒癥和多器官功能衰竭的保護具有重要作用[18]。而褪黑素抗炎的作用機制目前還不是很清楚,有研究顯示,褪黑素抑制膿毒癥NF-κB/NLRP3炎性小體通路,從而抑制促炎癥蛋白酶半胱氨酸天冬氨酸蛋白酶-1(Caspase-1)活化切割IL-1β和IL-18的前體,減輕膿毒癥的炎性損傷[19]。本研究結果顯示,褪黑素治療組血清中IL-1β、IL-6水平低于生理鹽水組。提示褪黑素可以降低引起細胞損傷的促炎因子IL-1β、IL-6的表達,這與Rahim等[19]研究結果一致。通過對小鼠心肌損傷的病理變化觀察,發現生理鹽水組小鼠心肌細胞出現嚴重凋亡損傷,而褪黑素治療組心肌功能障礙改善明顯。提示內毒素能夠誘導過度的炎性反應從而導致心肌組織凋亡損傷,而褪黑素可能通過減輕炎性反應水平進而減輕器官功能損傷。除此之外,我們通過測定凋亡相關因子Bcl-2、Bax發現,褪黑素治療組Bcl-2表達水平高于生理鹽水組,而Bax表達水平低于生理鹽水組。與心肌組織的病理損傷相一致,更加證實褪黑素可以減輕炎性反應,從而抑制心肌細胞凋亡,起到減輕心肌損傷的作用。
近年研究表明,多種miRNA分子如miRNA-125b、miRNA-200b、miRNA-203和miRNA-155等,通過抑制Myd88和TLR調控TLR/Myd88/NF-κB信號通路,參與調控炎性反應的過程[20]。miRNA是一種通過結合mRNA 3'端的短核心序列轉錄后調控mRNA[21]。RNA聚合酶Ⅱ轉錄miRNA基因,產生大小為70~100個核苷酸的具有發夾結構的前體miRNA,經Dicer酶加工后產生miRNA[22]。Real等[23]研究發現,膿毒性休克患者的外泌體表達與炎癥和細胞周期調節有關的miRNA,可能成為膿毒癥潛在的治療靶點和生物標志物[24]。而miRNA-223是我們本次研究的重點。近年來有研究證實,miRNA-223可以負性調控許多炎性因子如NLRP3、STAT3以及IL-6的表達等減輕炎性反應,保護組織功能[25-26]。而褪黑素抗炎途徑是否是通過調控miRNA來實現,我們進行了初步的研究。生理鹽水組miRNA-223表達量低于假傷組,而褪黑素治療組高于生理鹽水組,提示miRNA-223很可能是褪黑素的作用靶點,炎性因子IL-1β、IL-6等可能受到miRNA-223的調控。大量研究也證明miRNA-223可以有效抑制炎性因子如IL-1β、IL-6等的表達[27-28]。Zhang等[29]發現褪黑素可以通過miRNA-223來抑制動脈粥樣硬化過程中內皮細胞的炎性反應。當然,關于揭示褪黑素和miRNA-223關系的文獻報道還比較少。本實驗我們僅證明了褪黑素治療膿毒癥與miRNA-223有一定的相關性,推測miRNA-223可能為褪黑素抑制炎性反應的作用靶點。為進一步研究miRNA-223在褪黑素治療膿毒癥中的重要作用,我們將通過觀察不同濃度褪黑素對miRNA-223表達水平的影響以及通過轉染增強miRNA-223或者敲除miRNA-223,來進一步明確miRNA-223是否是褪黑素抑制炎性反應,減輕心肌損傷的重要分子。
綜上所述,褪黑素能明顯減輕膿毒癥小鼠心肌損傷,其作用機制可能是通過上調miRNA-223表達,抑制IL-1β、IL-6等炎性因子表達發揮抗炎、保護心肌組織的作用,但是尚待進一步證實。

