微創玻璃體切除術后早期高眼壓發生的相關因素分析
李 杰,劉三梅,李 芳,董文韜,鐘 捷
(四川醫學科學院·四川省人民醫院眼科,四川 成都 610072)
本世紀第一個10年里,無結膜縫線25 g、23 g及27 g玻璃體切除術(簡稱:玻切術)相繼問世,將傳統的玻切術帶入微創玻切術時代[1~3]。微創玻切術大大簡化了玻切手術步驟,減少了手術時間及降低了眼前節術后反應[4]。微創玻切術在臨床上得到廣泛應用,使得更多玻璃體視網膜疾病患者得到了有效的治療[5~7]。但同傳統玻切術一樣,微創玻切術后常并發一過性或者持續性的高眼壓,如不及時處理,可能對視力造成嚴重損害[8,9]。術后持續性高眼壓能夠導致視網膜中央動脈阻塞、視盤缺血和視神經萎縮,進而造成視力喪失,嚴重影響患者的預后。本研究回顧性分析我院眼底外科2016 年4 月至2017 年10 月收治的217例行微創玻切術患者的資料,探討術后早期高眼壓發生率及相關危險因素。希望研究結果能有助于臨床實踐中對微創玻切術術后高眼壓的預防及治療起到指導作用。
1 資料與方法
1.1一般資料2016 年4 月至2017 年10 月我院運用微創玻切術(25 g或27 g)治療各類玻璃體視網膜疾病217例(217眼)。其中糖尿病視網膜病變51眼、黃斑前膜29眼、黃斑裂孔23眼、孔源性視網膜脫離80眼、玻璃體積血24眼、其他疾病10眼,見表1。納入標準:研究時間區間內所有登記在冊的行微創玻切術患者。排除標準:既往眼部手術病史,術中聯合外路手術及本研究相關觀察指標缺項的病例。根據術后早期高眼壓的診斷標準(術后1周內任一時間點非接觸性眼壓計測眼壓≥25 mmHg[10]),將患者分為術后高眼壓組和無高眼壓組。高眼壓組26例,男13例,女13例,年齡(53.6 ± 13.9)歲;無高眼壓組191例,男89例,女102例,年齡(55.0 ± 16.3)歲。兩組年齡、性別、眼別比較,差異均無統計學意義(P> 0.05),見表1。所有患者手術前行最佳矯正視力(BCVA)、眼壓、裂隙燈顯微鏡、三面鏡、眼部B 超及眼底檢查。
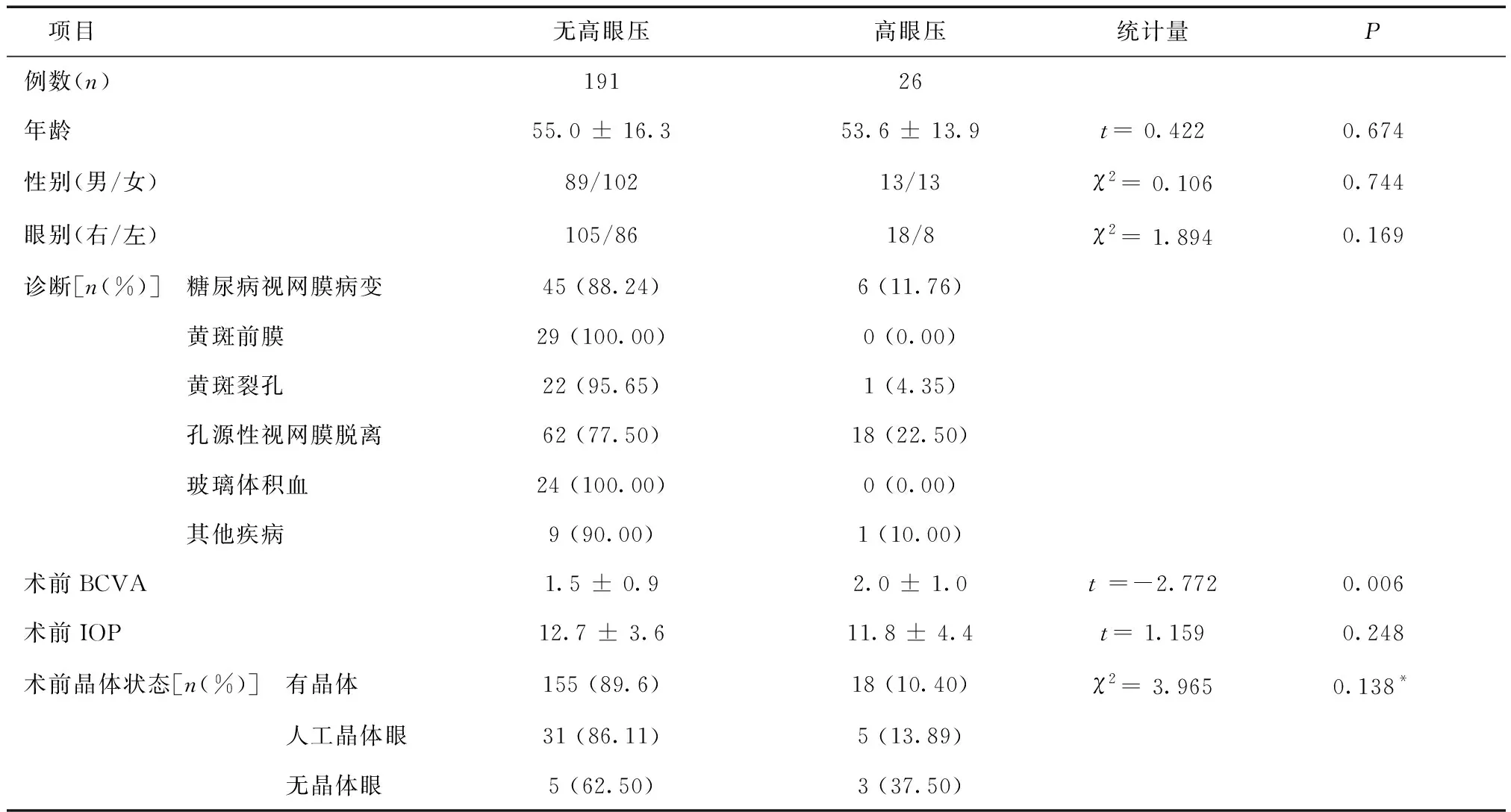
表1 患者基本信息及術前因素對術后高眼壓發生率的影響
1.2方法采用愛爾康超高速雙向氣動玻切機(Constellation Vision System),蔡司公司顯微鏡(S88/OPMI Lumera T)及RESIGHT 非接觸式廣角鏡,視網膜激光光凝器為愛爾康公司PUREPOINT 532 激光機。手術由同一主刀醫師完成。羅哌卡因3~5 ml球周麻醉后,采用斜行穿刺方式在顳上、鼻上、顳下距角鞏膜緣后3.5~4 mm處預置25/27 g套管建立三通道,顳下方套管連接灌注管。玻切機切速設置為7500 cpm,負壓0~650 mmHg。先行中央部玻璃體切除,再切除周邊部玻璃體;并根據疾病的不同,行視網膜前膜剝離、重水輔助固定視網膜、視網膜下液移除、視網膜切開或切除、眼內電凝止血及激光光凝等操作。完成眼內操作后,拔出鼻上和顳上的套管,同時拔出顳下方的套管和灌注管,用棉簽按摩或鑷子夾閉穿刺口,使之閉合。術畢指測眼壓Tn,涂典必殊眼膏,包扎術眼。術后局部予非甾體類抗炎眼液、激素類眼液。
術后檢查:術后第1、2、3及7天檢查患者,并記錄BCVA、眼壓、眼前節炎癥反應等情況。光感記錄為LogMAR視力4,手動記錄為LogMAR視力3,數指記錄為LogMAR視力2[11,12]。術后眼前節炎癥反應標準參考《眼科學》及《中華眼科學》[13,14]制定:前房閃輝分為無、輕、中、重,分別記為0~4級;房水細胞高倍鏡下觀察1 mm×1 mm裂隙光帶,無細胞記為0;1~10個細胞記為1;11~20個細胞記為2;31~40個細胞記為3;40個細胞以上記為4級。
術后高眼壓處理:對于術后眼壓21~30 mmHg者,局部選用噻嗎心安滴眼液、酒石酸溴莫尼定滴眼液、布林佐胺滴眼液或曲伏前列素滴眼液等。術后眼壓30~40 mmHg者,局部使用降壓眼液同時口服碳酸酐酶抑制劑。術后眼壓>40 mmHg者,進一步聯合使用高滲劑,藥物治療效果不好者行前房穿刺等對癥治療。
1.3統計學方法采用SPSS 19.0軟件進行統計分析。正態分布計量資料以均數±標準差表示,組間比較采用t檢驗,非正態分布計量資料比較采用秩和檢驗;計數資料比較采用卡方檢驗;相關因素分析采用Logistic回歸分析。P<0.05為差異有統計學意義。
2 結果
2.1術后早期高眼壓發生及轉歸術后1周內共26眼發生高眼壓,發生率為11.98%。21眼在局部抗炎及降眼壓眼液治療1周內恢復正常;3眼在1月內恢復正常;2眼局部藥物控制眼壓效果欠佳,行青光眼小梁切除+虹膜周切術。
2.2不同術前因素下術后高眼壓發生率糖尿病視網膜病變患眼、黃斑前膜、黃斑裂孔、孔源性視網膜脫離、玻璃體積血、其他疾病高眼壓發生率分別為11.76%、0%、4.35%、22.5%、0%及10%。高眼壓組術前BCVA低于無高眼壓組(P= 0.006)。兩組術前眼壓比較,差異無統計學意義(P= 0.248)。術前有晶體眼、人工晶體眼及無晶體眼的高眼壓發生率分別為10.40%、13.89%及37.50%,差異無統計學意義(P= 0.138),見表1。
2.3術中因素對術后高眼壓發生的影響高眼壓組手術時間長于無高眼壓組(P< 0.001)。27 g玻切術組高眼壓發生率低于25 g組(P= 0.026)。術中有無激光光凝、是否聯合Phaco+IOL植入術、切口關閉方式對高眼壓發生率的影響均無統計學意義。術畢眼內填充物為硅油、平衡鹽溶液及空氣的高眼壓發生率分別為22.34%、4.67%、0.0%,組間差異有統計學意義(P< 0.001),見表2。分別兩兩比較,硅油與平衡鹽溶液相比,差異有統計學意義(χ2= 13.869,P< 0.001);硅油與空氣相比,差異無統計學意義(χ2= 3.09,P= 0.079);平衡鹽溶液與空氣相比,差異無統計學意義(χ2= 0.042,P= 0.838)。

表2 微創玻璃體切除術手術各項指標對術后高眼壓發生率的影響
2.4不同術后因素下術后高眼壓發生率術后眼壓波動,高眼壓組高于無高眼壓組(P< 0.001)。術后前房閃輝為0級、1級、2級及3級以上時,高眼壓發生率分別為11.0%、8.00%、45.5%及9.1%,組間差異有統計學意義(χ2= 8.615,P= 0.034)。術后房水細胞為0級、1級、2級及3級以上時,高眼壓發生率分別為9.2%、16.7%、50.0%及25.0%,組間差異有統計學意義(χ2= 8.082,P= 0.044),見表3。
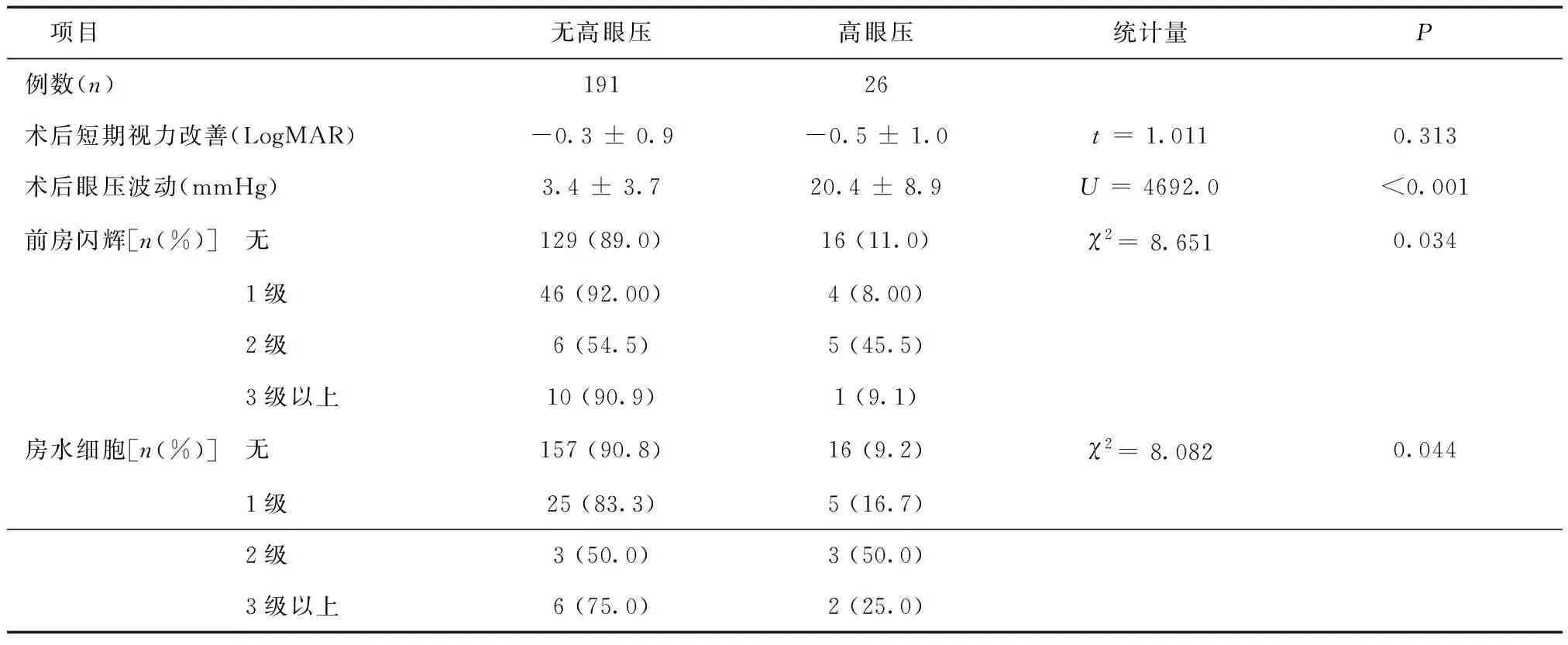
表3 微創玻璃體切除術術后短期隨訪指標對術后高眼壓發生率的影響
2.5相關因素分析經Logistic回歸分析發現,糖尿病視網膜病變、眼內填充物(硅油)、術后前房閃輝及術后眼壓波動是引起微創玻切術后早期高眼壓的獨立危險因素,見表4。
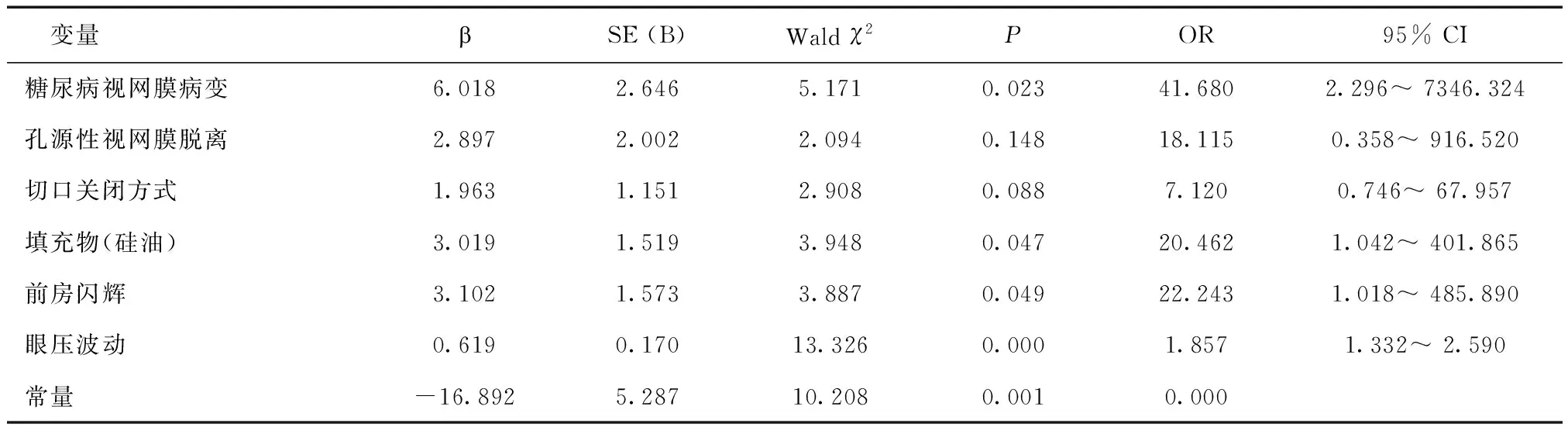
表4 微創玻璃體切除術后高眼壓影響因素回歸分析
3 討論
術后高眼壓是玻切術常見并發癥。總體而言,本研究中217例患眼1周內共26眼發生術后高眼壓,發生率為11.98%,低于俞學群等報道的23 g玻切術后早期高眼壓發生率(32.2%)[15]。可能原因為本研究觀察時間相對較短,術后1周的高眼壓患者未納入研究。我們進一步分析發現以下因素在術后高眼壓的發生中起重要作用:
3.1眼內充填(硅油)所致的眼壓升高本研究中眼內硅油填充組的高眼壓發病率顯著高于無填充物組(術畢眼內為平衡鹽溶液),與劉世波等報道一致[16]。硅油引起術后高眼壓的可能機制有手術后眼內組織水腫、葡萄膜反應;硅油注射量過多,增加后房壓力并向前推擠晶體虹膜膈,導致周邊前房變淺、房角變窄,使得房水外流受阻從而引起眼壓升高;無晶體患者可能發生瞳孔阻滯;硅油小粒阻塞房角等。本研究21例硅油填充眼發生高眼壓,20例局部抗炎降眼壓對癥治療后好轉,考慮高眼壓原因以眼內組織炎癥水腫為主;另外1例持續高眼壓患眼因晶體懸韌帶松弛,硅油進入前房所致。
3.2糖尿病視網膜病變所致眼壓升高本研究217例患者術前診斷不盡相同,共歸為六大類。本研究發現糖尿病視網膜病變是術后高眼壓獨立危險因素。俞學群等發現糖尿病僅伴有單純性玻璃體積血,術后高眼壓發生率為21.1%,而伴有牽拉性視網膜脫離的患者,發生率高達57.6%[15]。吳娜等也發現糖尿病視網膜患者玻切術后高眼壓發生率顯著升高。糖尿病視網膜病變患者術后高眼壓發生,可能的機制是因糖尿病患者的血管機能較正常人差,小梁網濾過功能下降,血管擴張并且通透性升高致使術后炎癥反應重[17]。
3.3前房炎癥反應與眼壓升高前房閃輝及房水細胞是術后眼前節炎癥反應指標。本研究發現房水閃輝及房水細胞分級,在高眼壓組和無高眼壓組之間具有顯著差異,并且回歸分析發現前房閃輝是術后高眼壓的獨立危險因素。其機制可能為手術機械刺激局部血流增加,白細胞釋放炎性介質使血管擴張、通透性升高,破壞血房水屏障,使血漿性房水進入后房,導致眼壓的暫時升高口;同時小粱網炎性水腫或被炎性碎屑堵塞,可使房水濾出率降低造成眼壓升高[18]。由此可見,術后眼前節炎癥反應的控制對預防術后高眼壓發生具有重要意義
3.4眼壓波動與高眼壓本研究發現眼壓波動是高眼壓發生的危險因素之一。眼壓波動大,其波動上限可能本身就超過25 mmHg。眼壓波動的危害不僅僅是增加了高眼壓的發生概率,而是波動的眼壓可能對視神經造成不可逆的損害[19]。因此眼壓波動也應納入術后重點關注。
綜上所述,微創玻切術術后早期常伴有高眼壓發生。術后高眼壓的發生受較多因素影響,要重點注意其中的獨立危險因素,如糖尿病視網膜病變、眼內填充物(硅油)、術后前房閃輝及眼壓波動。掌握了玻切術后早期眼壓升高的發生規律和危險因素,可以對術后眼壓升高的發生做到心中有數,并及時發現、盡早處理,以降低高眼壓發生率,最大程度提高患者的視力。

