泡菜中高效氨氮降解菌的篩選及鑒定
馮愛娟,朱美娟,陳美娟,蘇莉莎,葉茂*
(1.廣東輕工職業技術學院 食品與生物技術學院,廣州 510300;2.廣東高校特色調味品工程技術開發中心,廣州 510300)
近年來,由于工業的快速發展,排出的廢水急劇增加,導致水污染的原因有很多,如有機污染物、無機污染物等,其中廢水中氨氮含量嚴重超標導致水體富營養化,危害環境。氨氮是水相環境中氨的主要形態,是造成水體富營養化的主要污染物。因此,氨氮的含量可以作為污水水質的重要指標。水體污染給環境和人類的生活造成了威脅[1,2]。根據搜查的相關資料,氨氮含量的排放量劇增,造成氮循環不規律[3],為保證水資源的可持續發展,開發出更高效的氨氮處理技術成為目前迫在眉睫的事情。現今,國內外對高氨氮廢水處理方面也展開了較多研究,除了傳統的方法外,還有現推行的方法生物脫氮技術[4],生物脫氮是利用從自然界中獲得的有益微生物降解氨氮,生物脫氮技術具有無污染、經濟和安全等優點,因此更加備受關注。生物脫氮技術的核心是篩選能高效降解氨氮的微生物,所以前人對這方面進行了大量的研究工作。近十幾年來,很多學術上的學者從研究河蝦等水殖產業的污水、某工業地的淤泥中篩選出能降解廢水中氨氮的菌株,相關文獻報道過的有硝化細菌、反硝化細菌、高效脫氮除磷菌等降解氨氮的菌株[5],在這方面也有了一定的進展。眾多研究結果表明,高氨氮污水及污泥中篩選高效菌株是最為有效的優良菌劑獲取方法,但盡管目前投入了大量的嘗試性研究,還遠遠未達到有效、節約地處理污水氨氮的程度。因此,應對目前全國范圍內各種污染類型水體中普遍發生的氨氮超標問題,篩選出高效菌株并對其性能進行優化仍是當前及未來的主要研究方向。我們也向著這個方向出發,研究以市售泡菜為原材料,使用富集與分離的方法篩選氨氮降解菌,通過測定其氨氮降解率以獲得1株高效的氨氮降解菌株,并對其降解條件進行優化,期望能為我國處理水體的氨氮提供一條新途徑。
1 實驗材料與方法
1.1 泡菜樣品
泡菜樣品:市售。
1.2 培養基
1.2.1 富集培養基
葡萄糖5.0 g,(NH4)2SO42.5 g,NaCl 2.0 g,FeSO4·7H2O 0.4 g,K2HPO41.0 g,pH值7.2~7.4,MgSO4·7H2O 0.5 g,水1000 mL。取200 mL富集培養基放入1000 mL錐形瓶中,115 ℃滅菌30 min。
1.2.2 分離平板培養基
葡萄糖5.0 g,(NH4)2SO42.5 g,NaCl 2.0 g,FeSO4·7H2O 0.4 g,K2HPO41.0 g,pH值7.2~7.4,MgSO4·7H2O 0.5 g,瓊脂20 g,水1000 mL,115 ℃滅菌30 min。
1.2.3 活化培養基
蛋白胨5 g,葡萄糖5 g,K2HPO42 g,NaCl 5 g,水1000 mL,pH值7.0~7.2,過濾分裝后于115 ℃滅菌30 min。
1.2.4 斜面培養基
采用Luria-Bertani (LB)瓊脂培養基,其組成如下:蛋白胨10 g/L,酵母膏5 g/L,NaCl 10 g/L和瓊脂20 g/L。將pH調至7.5,121 ℃滅菌20 min。
1.2.5 搖瓶種子培養基
采用LB液體培養基,將pH調至7.5,121 ℃滅菌20 min。
1.2.6 篩選培養基
葡萄糖5.0 g,(NH4)2SO42.5 g,NaCl 1.0 g,K2HPO40.5 g,pH值7.2~7.4,MgSO4·7H2O 0.25 g,去離子水定容至1000 mL,此時NH4-N含量為500 mg/L,分裝于1000 mL三角瓶中,每瓶200 mL,115 ℃滅菌30 min。
1.3 分離篩選出氨氮降解菌
1.3.1 氨氮降解菌的富集
配制好190 mL富集培養基,滅菌、冷卻后,從混合均勻的泡菜樣品中取出30 g,接入裝有富集培養基的1000 mL三角瓶中,搖勻,再放入150 r/min,28 ℃的恒溫搖床培養24 h。培養結束后測定pH值;然后取出10 mL上清菌液,加到新鮮富集培養基中在相同條件下再次富集培養,培養結束后再測定pH值,觀察從培養基到富集2次后的pH值的變化情況。
1.3.2 氨氮降解菌的分離純化
配制好分離平板培養基,滅菌、分裝、冷卻后,取第2次富集培養基中的上清菌液1 mL,在無菌操作條件下將培養液稀釋、涂布于分離平板培養基上,于28 ℃恒溫培養箱培養2~3天,至平板長出單菌落為止;挑取各個單菌落至新的平板上劃線,28 ℃下培養2~3天,至平板上長出單菌落為止,以進一步純化;挑選各個單菌落于斜面培養基上,于28 ℃下培養24 h;待斜面長出菌苔后,分別以斜面固態保藏于4 ℃冰箱和中制成甘油管保藏于-20 ℃冰箱中。
1.3.3 制備菌懸液及測定細胞濃度
將活化后的各菌種接入搖瓶種子培養基;各接入1環,于150 r/min、28 ℃恒溫搖床培養24 h;在4 ℃、10000 r/min下離心15 min并棄上清液,收集菌體;將濕菌體加至無菌的生理鹽水中洗滌3~4次[6],測定OD600=1,并將其配制成細胞濃度約為109個/mL的菌懸液備用。
1.3.4 篩選高效降解菌
制備搖瓶篩選培養基190 mL加入1000 mL的三角瓶中,滅菌、冷卻后,分別接入各菌株的細胞濃度相等的菌懸液;置于150 r/min、28 ℃恒溫搖床中培養72 h;采用《水楊酸分光光度法》分析經各菌種降解后的培養基中的氨氮殘留量(24,48,72 h各測1次);用未接種的搖瓶做參照,記錄數據并計算氨氮降解率。參照文獻[7]中提出的方法,并按式(1)計算菌株的氨氮降解率:

(1)
綜合數據,根據降解率的大小,優選出降解效率最高的目的菌株。
1.3.5 高效降解菌菌株最大吸收波長的測定
配制好100 mL活化培養基,滅菌、冷卻后,將優選出的菌株在活化培養基中活化24 h(將斜面保藏的菌種接1環到活化培養基中,置于28 ℃和150 r/min條件下培養24 h),取培養液用紫外-可見光分光光度儀在340~600 nm的波長下以未接種的培養基為參比測定其OD值,以波長為橫坐標,以OD值為縱坐標畫圖,確定該優選菌株的最大吸收波長。
1.3.6 高效降解菌菌株的生長曲線測定
將活化好的優選菌株,接1環至新鮮的活化培養基,在28 ℃、150 r/min恒溫振蕩培養,在該優選菌株的最大吸收波長處,每隔2 h取一定量培養液測定其OD值,以培養時間為橫坐標,以最大吸收波長處的OD值為縱坐標繪制生長曲線。
1.3.7 氨氮降解菌菌株的初步鑒定
對優選菌種進行平板培養、革蘭氏染色,觀察其菌落形態及革蘭氏屬性。同時,參照文獻[8-10],如《伯杰氏細菌鑒定手冊》的方法,對生理生化特征等方面進行初步鑒定,如葡萄糖發酵試驗、需氧性試驗等。
1.3.8 菌株的16S rDNA測序
氨氮降解菌菌株的16S rDNA PCR擴增引物采用通用引物:正向引物27F為5′-AGAGTTTGATCC-
TGGCTCA-3′,反向引物1492R為5′-GGTTACCTTG-
TTACGACTT-3′(由上海生物工程有限公司合成),擴增產物電泳檢測后送上海生物工程有限公司測序,將測得序列通過NCBI(http://www.ncbi.nlm.nih.gov)網站的GenBank核酸序列數據庫內進行BLAST比對,找出核酸數據庫中與氨氮降解菌菌株同源性較高的菌株序列,下載這些菌株的DNA序列,然后用生物軟件MEGA4進行CLUSTAL比對并構建氨氮降解菌菌株的系統發育樹。
2 實驗結果
2.1 分離篩選高效氨氮降解菌的結果
富集實驗的情況如下:第1天富集后pH為6.10;第2天為4.5,說明富集的菌株是產酸的;分離純化試驗:從泡菜原材料中共篩選了25株能降解高濃度氨氮的菌株;最后對這25株菌進行了氨氮降解率的測定實驗。結果表明:在氨氮濃度為500 mg/L的液體培養基下,24 h內這些菌株氨氮降解率的范圍為3.85%~29.81%;48 h的氨氮降解率范圍為13.46%~43.64%,72 h的氨氮降解范圍為35.72%~64.85%。由于硫酸銨在培養基滅菌過程中會出現高溫分解,從而導致NH4-N的濃度降低,因此在培養基的配制過程中采用先不加硫酸銨滅菌后,通過過濾除菌將硫酸銨加入到培養基中后接種培養。試驗表明:LJK8菌株的降解率最高為 64.85%,因此對LJK8菌株做進一步的研究。
2.2 LJK8菌株最大吸收波長的測定
LJK8菌株吸收波長實驗結果見圖1。
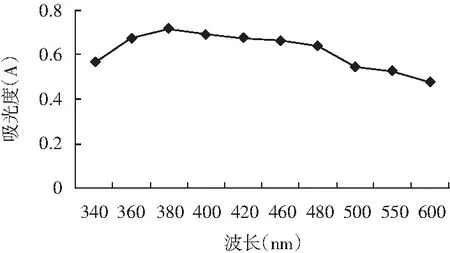
圖1 LJK8菌株吸收波長Fig.1 The maximum absorbing wavelength of LJK8 strain
由圖1可知,在波長340~600 nm之間,LJK8菌株在380 nm處有最大吸收峰,由此在380 nm處測其生長曲線,以研究其生長量與氨氮降解率之間的關系。
2.3 LJK8菌株的生長曲線測定
LJK8菌株的生長曲線測定結果見圖2。
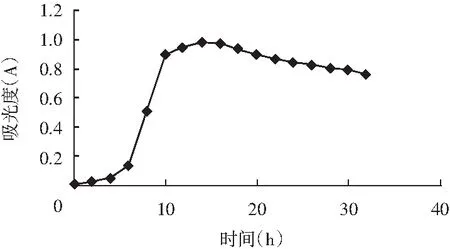
圖2 LJK8菌株的生長曲線Fig.2 The growth curve of LJK8 strain
由圖2可知,LJK8菌株在0~6 h為生長的適應期;在6~14 h為對數生長期;在14~36 h為生長的穩定期;在36 h之后才有所衰亡。LJK8菌株達到最大生長量是在培養第20 h。
2.4 LJK8菌株的初步鑒定
觀察LJK8菌株的平板培養情況,(見圖3),菌落為乳白色但不透明,圓形,邊緣整齊。菌株經革蘭氏染色后于顯微鏡下觀察(見圖4),細胞完全是細桿狀,均為紫色,因此屬于革蘭氏陽性菌且無芽孢。
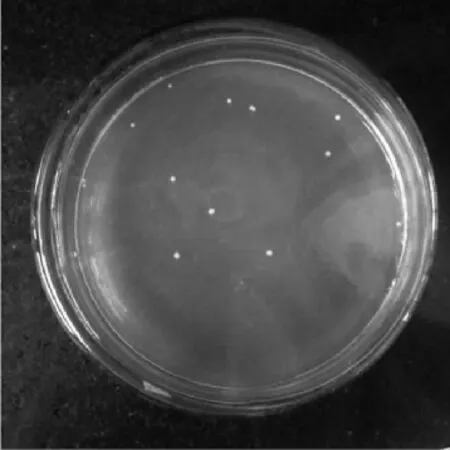
圖3 LJK8菌株的菌落形態Fig.3 Colony of LJK8 strain

圖4 LJK8菌株的革蘭氏染色圖Fig.4 Gram staining of LJK8 strain
2.5 LJK8菌株的生理生化試驗
經過一系列的生理生化試驗,觀察結果,見表1。

表1 生理生化試驗結果Table 1 The results of physiological and biochemical test
2.6 LJK8菌株的16S rDNA測定結果
將LJK8菌株的16S rDNA序列提交到GenBank數據庫并構建菌株的系統發育樹,見圖5。可以初步鑒定LJK8菌株屬于Rheinheimeraaquatica(水萊茵海默氏菌),擴增的16S rDNA與Rheinheimeraaquatica序列相似性達到99.99%,序列同源性為98%,所以初步確定該菌株為Rheinheimeraaquatica。
LJK8菌株的16S rDNA序列:
CGTAGGAAGCTACCCGATAGAGGGGGATACCAGTTGGAAACGACTGTTAATACCGCATAATGTCTACGGACCAAAGTGTGGGACCTTCGGGCCACATGCTATCGGATGCGCCTACGTGGGATTAGCTAGTTGGTGAGGTAATGGCTCACCAAGGCAACGATCCCTAGCTGGTTTGAGAGGATGATCAGCCACACTGGAACTGAGACACGGTCCAGACTCCTACGGGAGGCAGCAGTGGGGAATATTGGACAATGGGCGCAAGCCTGATCCAGCCATGCCGCGTGTGTGAAGAAGGCCTTCGGGTTGTAAAGCACTTTCAGTTGGGAGGAAGGGTTGTGTGTTAATAGTACACAGCCTTGACGTTACCAACAGAAGAAGCACCGGCTAACTCTGTGCCAGCAGCCGCGGTAATACAGAGGGTGCAAGCGTTAATCGGAATTACTGGGCGAAGCGCACGTAGGCGGTTTTTTAAGTCAGATGTGAAAGCCCCGGGCTCAACCTGGGAATTGCATTTGAAACTGGAAAACTAGAGTGTGTGAGAGGGGGGTAGAATTCCAAGTGTAGCGGTGAAATGCGTAGAGATTTGGAGGAATACCAGTGGCGAAGGCGGCCCCCTGGCACAACACTGACGCTCAGGTGCGAAAGCGTGGGGAGCAAACAGGATTAGATACCCTGGTAGTCCACGCCGTAAACGATGTCTACTAGCTGTTCGTGACCTTGTGTCGTGAGTAGCGCAGCTAACGCACTAAGTAGACCGCCTGGGGAGTACGGTCGCAAGATTAAAACTCAAATGAATTGACGGGGGCCCGCACAAGCGGTGGAGCATGTGGTTTAATTCGACGCAACGCGAAGAACCTTACCTACTCTTGACATCCAGAGAAGACTGCAGAGATGCGGTTGTGCCTTCGGGAACTCTGAGACAGGTGCTGCATGGCTGTCGTCAGCTCGTGTTGTGAAATGTTGGGTTAAGTCCCGCAACGAGCGCAACCCTTATCCTTAGTTGCCAGCGCGTAATGGCGGGAACTCTAGGGAGACTGCCGGTGATAAACCGGAGGAAGGTGGGGACGACGTCAAGTCATCATGGCCCTTACGAGTAGGGCTACACACGTGCTACAATGGTATGTACAGAGGGAGGCAAGCTGGCGACAGTGAGCGGATCTCTTAAAGCATATCGTAGTCCGGATCGCAGTCTGCAACTCGACTGCGTGAAGTCGGAATCGCTAGTAATCGCAAATCAGAATGTTGCGGTGAATACGTTCCCGGGCCTTGTACACACCGCCCGTCACACCATGGGAGTGGGTTGCAAAAGAAGTAGGTAGCTTAACCTTCGGGAGGGCGCTTACCACTTTGTGATTCATGACTGGGGTGAAGTCGTAA。
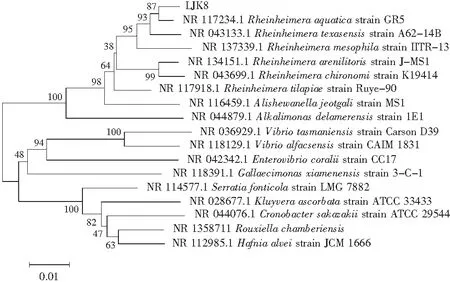
圖5 LJK8的16S rDNA序列比對結果Fig.5 16S rDNA sequence comparison results of LJK8 strain
3 討論
從鹽含量高的泡菜為原料,以硫酸銨為唯一氮源的篩選培養基,篩選出具有氨氮降解能力的微生物,再進行分離和純化,篩選出1株對高氨氮含量水相具有較高降解效率的菌株LJK8。經過測定,LJK8的最大波長及生長曲線、革蘭氏染色及對其進行的一系列生理生化試驗,可以初步了解LJK8菌株的基本屬性。LJK8菌株的最適吸收波長在380 nm處,由其生長曲線可以看出,LJK8菌株在培養14 h時達到最大生長量;當以氨氮初始含量為500 mg/L的培養基培養時,并測定其氨氮降解率,在24~72 h內的降解效率達到64.85%,通過對LJK8菌株生長量及氨氮含量變化的檢測,表明菌株生長與降解氨氮是同步進行的,說明其可在較長時間內發揮降解作用。
目前對能處理水體或者土壤中氨氮的文獻報道還比較少,而我們研究從泡菜中篩選出來的高效氨氮降解菌LJK8菌株屬于Rheinheimeraaquatica(水萊茵海默氏菌),還未見該菌用于氨氮降解的報道,LJK8如果應用于水體污染的處理方面還有很大的發展潛力,因此可對其在養殖污水、工業污水或者土壤中氨氮的深度凈化處理上的應用再進一步進行研究。不過篩選出來的LJK8菌株相對于同一時段篩選的其他菌株的氨氮降解效率雖然較高,但是在如此高濃度的氨氮條件下仍然還有相當量的氨氮殘留,因此我們后期將會研究該菌的降解工藝,并對其降解條件進行優化,增強菌株對高濃度氨氮污水的凈化能力。期望LJK8能在后期的養殖污水及水體污染處理方面發揮一定的作用。

