薄荷油納米乳液消化規律與穩定性研究
王中江 張瀟元 車佳玲 李 楊 OLGA O B 江連洲
(1.東北農業大學食品學院, 哈爾濱 150030; 2.克麥羅沃國立大學食品學科與技術學院, 克麥羅沃 650056)
0 引言
薄荷油具有多種功效[1],有著巨大的應用發展空間與潛力。然而薄荷油易揮發,對空氣、溫度、光的穩定性差以及其主要功能性成分在未到達目標位置前,被機體迅速吸收,最終會導致營養素的生物利用度降低等缺點[2],極大限制了其在食品、保健品等領域的應用。
納米乳液乳化包埋體系具有獨特的納米級粒徑和較大的比表面積。除了能很好地提高精油類生物活性物質的生物利用度以外,納米乳化包埋體系具有在儲藏、運輸過程中無絮凝、無聚集的優點[3-4]。MAJEED等[5]以改性淀粉辛烯基琥珀酸酯化淀粉作為乳化劑制備了不同粒徑的丁香酚納米乳液,通過模擬體外胃腸道消化,表明小粒徑的納米乳液生物利用度更高。RAO等[6]通過模擬體外胃腸道消化,研究了玉米油對β-胡蘿卜素納米乳液穩定性、脂肪酸釋放率及β-胡蘿卜素生物利用度的影響。研究表明油相中玉米油的存在不僅提高了機體內的消化速度,同時提高了脂肪酸釋放率以及β-胡蘿卜素的生物利用度。然而,目前國內外尚無關于薄荷油納米乳液的研究。
本文研究薄荷與納米乳液經體外胃腸液消化后其粒徑、ζ-電位的變化以及游離脂肪酸釋放率和薄荷醇的生物利用度,以及包埋后薄荷油的穩定性,以期為納米乳化包埋技術制備的薄荷油納米乳液應用于營養素的體內運載提供數據支持和科學依據。
1 材料與方法
1.1 材料與試劑
大豆分離蛋白(Soybean protein isolate,SPI),蛋白質量分數89.21%,山東省高唐藍山集團;磷脂酰膽堿(Phosphatidyl choline,PC),北京索萊寶科技有限公司;薄荷油、尼羅藍、尼羅紅、胃蛋白酶、胰蛋白酶、豬膽酸鹽,Sigma公司;氫氧化鈉、磷酸二氫鈉、磷酸氫二鈉,均為分析純試劑。
1.2 儀器與設備
T18 Basic型高速分散機(德國IKA公司);實驗型高壓均質機(英國Stansted Fluid Power公司);超凈工作臺(美國PE公司);激光掃描3D共聚焦顯微鏡(英國Malvern儀器有限公司);Zetasizer Nano ZSP型納米粒徑電位儀(英國Malvern儀器有限公司);Agilent7890-5795C型氣相色譜-質譜聯用儀(日本HITACHI公司);多重光散射穩定性分析儀(法國Formulaction公司)。
1.3 方法
1.3.1薄荷油納米乳液的制備
參照LEE等[7]方法將SPI和PC溶于0.1 mol/L、pH值7.0的磷酸鹽緩沖液中,置于25℃條件下連續攪拌120 min,形成水相,在高速分散機的攪拌下把薄荷油作為油相加到水相中,20 000 r/min剪切5 min,形成粗乳液。將粗乳液通過高壓均質機進一步均質乳化即得薄荷油納米乳液。高壓均質處理的方法及條件設定參照SORGENTINI等[8]方法進行一定修改。高壓均質機均質壓力為80 MPa,均質次數為4次,采用冰水浴保持低溫。
1.3.2納米乳液激光掃描3D共聚焦顯微鏡成像
薄荷油納米乳液體系激光共聚焦顯微鏡的檢測參照PUPPO等[9]的方法。SPI經尼羅藍染液染色后呈現綠色熒光,薄荷油經脂溶性熒光探針尼羅紅染色后呈現紅色熒光。分別將尼羅紅(0.01 g/mL)和尼羅藍(0.01 g/mL)溶解在丙醇中,漩渦混合30 s后對薄荷油納米乳液染色40 min。染色結束后取10 μL乳液于載玻片上,采用激光掃描3D共聚焦顯微鏡觀察薄荷油納米乳液的微觀結構。
1.3.3納米乳液體外模擬消化
根據人體消化道的構造以及蛋白和油脂在機體內的消化特點,參照WOOSTER等[10]的實驗方法并在其基礎上進行改進后,構建一個胃腸道模型,以模擬胃液、腸液消化。在整個實驗過程中,消化乳液樣品置于37℃恒溫振蕩搖床上,并通過磁力攪拌器持續攪拌。
(1)模擬胃階段
首先,取15 mL薄荷油納米乳液與135 mL生理鹽水混合,持續攪拌10 min,通過0.1 mol/L的鹽酸調節消化液的pH值至2.0,加入10 mL質量濃度為40 mg/mL的胃蛋白酶。然后將溶液置于37℃的振蕩搖床中模擬胃液消化1 h。
(2)模擬腸階段
在經過模擬胃液消化1 h后,使用0.1 mol/L NaOH將消化液的pH值調至7.5,并加入45 mL模擬腸液(2 mg/mL的胰酶與12 mg/mL的豬膽酸鹽),模擬腸液的消化。溶液的pH值用pH-stat法自動滴定監測,在37℃條件下反應2 h,并通過滴加0.2 mol/L NaOH溶液保持pH值為7.5,并記錄NaOH消耗量。參照NETZEL等[11]的研究方法,采用與薄荷油納米乳液中相同質量濃度的薄荷油作為空白對照。
(3)游離脂肪酸釋放率測定
模擬腸液的消化過程中,薄荷油在胰脂肪酶和豬膽酸鹽的作用下被水解為游離脂肪酸,一分子的甘油三酯在完全消化時產生一分子的甘油單酯和兩分子的游離脂肪酸,因此根據隨時間推移不斷消耗的NaOH體積計算出游離脂肪酸的釋放率,公式為
(1)
式中Y1——游離脂肪酸釋放率,%
mlipid——乳液中脂肪的總質量,g
VNaOH——所消耗的NaOH溶液的體積,L
mNaOH——滴定時選用NaOH溶液的濃度,mol/L
Mlipid——脂肪分子的平均分子量,g/mol
1.3.4薄荷醇生物可利用度測定
將消化后的乳液置于離心機中,在4℃、10 000g條件下離心45 min,上清液即為載有薄荷醇的透明膠束層,利用高效液相色譜-質譜聯用儀的方法即可計算出薄荷醇的濃度,薄荷醇的生物可利用度計算公式為
(2)
式中Y2——薄荷醇生物利用度,%
C1——膠束中薄荷醇濃度
C2——溶液中薄荷醇濃度
(1)高效氣相色譜-質譜聯用儀測定條件
氣相色譜:采用OV1701型色譜柱(30 m×0.25 mm×0.25 μm),進樣量10 μL,升溫程序設定為:40℃持續3 min,然后以4℃/min的速度上升至100℃,接著以7℃/min的速度上升至240℃,持續7 min,分流比設定10∶1。載氣為氦氣,流速設定為0.8 mL/min,進樣口溫度設定為250℃。
質譜:離子源溫度設定為200℃,檢測器電壓為350 V,電子能量設定為70 eV,燈絲發射電流200 μA,接口溫度250℃,掃描范圍(質荷比)50~500。
(2)化合物鑒定
利用Xcalibur軟件對實驗數據進行分析。通過計算機自動查找化合物,然后與譜庫NIST和Wiley的化合物進行匹配度檢測,再手動檢索核對,選擇匹配度大于800的結果,采用歸一化法得到樣品中薄荷醇的濃度。
1.3.5消化納米乳液平均粒徑及ζ-電位測定
采用Zetasizer Nano-90型粒徑分析儀測定原始納米乳液及經胃液和腸液消化后液體的平均粒徑及ζ-電位。測定前先將乳液用0.1 mol/L、pH值7.0的磷酸鹽緩沖溶液以1∶1 000比例稀釋,以防止多個角度的散射效應。
1.3.6消化乳液形態觀察
吸取一滴乳液置于載玻片上,蓋上蓋玻片,用光學顯微鏡觀察外觀形態,放大400倍并進行拍照。
1.3.7薄荷油納米乳液的穩定性分析
利用濃縮體系穩定性分析儀對薄荷油納米乳液的穩定性進行檢測,通過兩個同步探測器收集背散射光和透射光,獲得差值反射光量隨時間的動態變化情況,進而得到對納米乳液的穩定性情況。取20 mL薄荷油納米乳液置于儀器專用玻璃杯中,溫度保持在55℃,每30 min掃描一次,共掃描5次,軟件通過光信號,計算納米乳液的穩定性分析指數(TSI值)。
1.3.8數據統計分析
每次試驗做3次平行,結果用平均值±標準差表示,利用SPSS Statistics 22軟件對數據進行ANOVA差異顯著性分析,P<0.05為顯著性差異。采用Origin 9.1軟件進行數據分析、圖表處理及圖譜分析處理。
2 結果與分析
2.1 納米乳液形態的激光掃描3D共聚焦顯微鏡成像
激光掃描3D共聚焦顯微鏡更為直觀地顯示了薄荷油納米乳液納米級液滴均勻分布情況。其原理是在熒光顯微鏡的基礎上裝上激光掃描裝置,使用激光集中掃描照射樣品的表面,然后通過激發熒光探針將聚焦平面的信息投射到檢測器前面的共聚焦孔中[12]。并利用3D成像軟件進行圖像處理,進而得到納米乳液微觀結構的熒光圖像。本研究利用熒光標記蛋白技術,通過尼羅紅與尼羅藍快速標記納米乳液的脂肪和蛋白質,檢測薄荷油納米乳液體系對薄荷油的包埋效果。如圖1所示,觀察到大部分離散的球形脂肪液滴直徑在10~200 nm范圍內,由于尼羅藍覆染SPI后激發的熒光呈綠色,結果表明高壓均質處理的SPI具有較好的乳化活性,可以形成緊密的界面膜,呈現球狀形態,提高了乳化體系的穩定性。
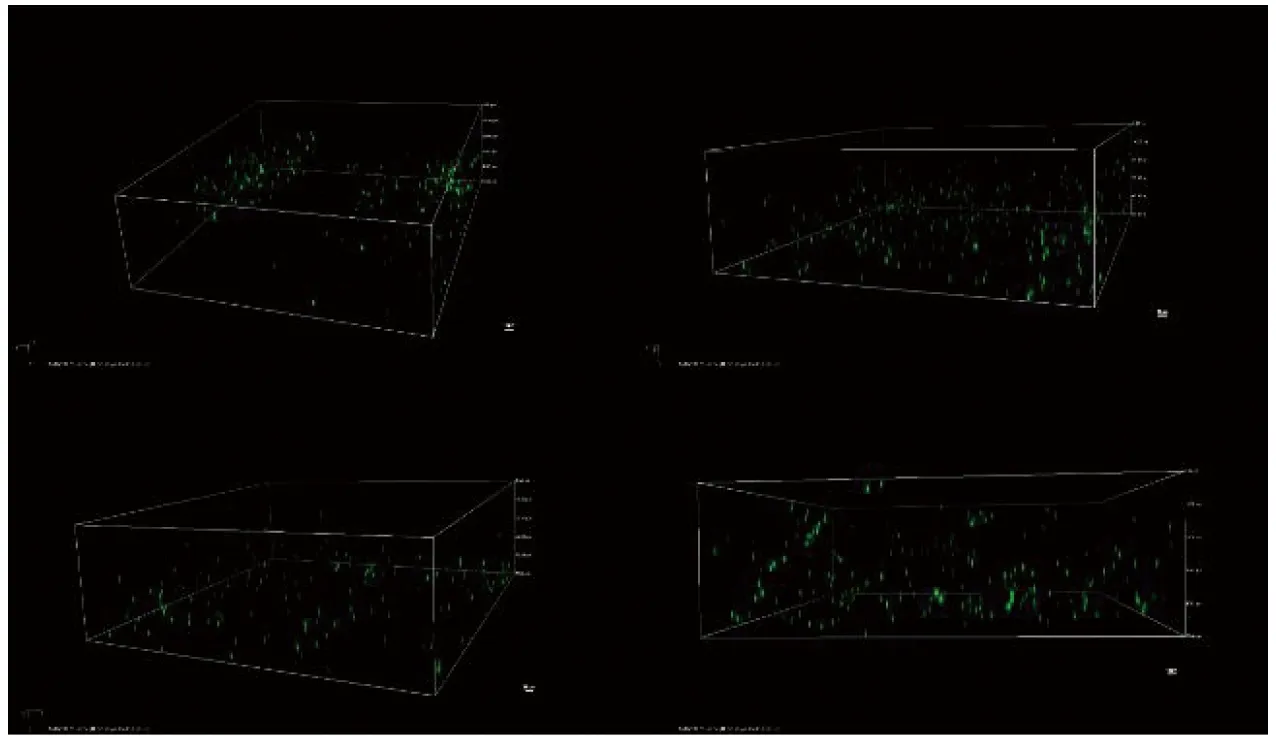
圖1 薄荷油納米乳液的激光掃描3D共聚焦顯微鏡圖像Fig.1 Microscope images of peppermint oil nanoemulsion by confocal laser scanning 3D microscopy
2.2 納米乳液在體外消化過程中的粒徑和微觀結構變化
薄荷油納米乳液通過體外模擬消化模型后,其乳化體系的組成和結構均出現了顯著變化,同時對乳液的理化穩定性影響較大。因此,在實驗過程中檢測了薄荷油原始乳液的平均粒徑以及經過模擬胃液消化60 min、模擬腸液消化120 min后的平均粒徑[13],并且利用光學顯微鏡可更為直觀地顯示乳液消化各階段的微觀結構,結果如圖2所示。在體外模擬消化的整個過程中,乳液的平均粒徑呈現先增加后下降的變化趨勢。基于SPI的薄荷油納米乳液具有相對較小的粒徑,同時油-水界面吸附著大量的蛋白,形成一層保護膜,保證乳液能維持較穩定的狀態。當乳液經過胃液時,平均粒徑顯著增加,主要原因在于胃液中的胃蛋白酶能水解吸附在薄荷油上的SPI,另一方面當胃液的pH值在SPI等電點附近且胃液中含有金屬離子時,液滴間的靜電排斥作用下降,導致乳液裂解或出現液滴聚合。這與MALAKI等[14]的研究結果一致。當乳液在腸液消化120 min后,乳液的平均粒徑降低到300 nm,主要原因在于薄荷油被腸液中的胰脂肪酶和豬膽酸鹽水解成小液滴,同時靜電排斥作用的增強以及持續的機械振蕩進一步阻止了液滴出現聚合現象。KOSSENA等[15]研究指出β-胡蘿卜素納米乳液體外模擬腸液消化過程中出現平均粒徑增大的情況。而本文所研究的薄荷油納米乳液在腸液消化后沒有出現液滴聚集現象,結果表明SPI-PC的疏水作用對薄荷油納米乳液的油-水界面膜有一定的抗液滴聚合作用。

圖2 納米乳液消化前后的光學顯微鏡圖像Fig.2 Optical microscope images of peppermint oil nanoemulsion before and after digestion
2.3 納米乳液在體外消化過程中的ζ-電位變化
薄荷油納米乳液經胃液、腸液消化前后的樣品中,ζ-電位也是決定乳液體外模擬消化過程中界面組成變化的因素,不同消化階段納米乳液ζ-電位結果表明消化乳液的ζ-電位絕對值整體呈現先下降后上升的趨勢。根據2.1節薄荷油納米乳液的激光掃描3D共聚焦顯微鏡可以看出,在薄荷油納米乳液的油-水界面吸附了大量的SPI,表明乳液在初始階段吸附大量負電荷。由于體外模擬的胃液pH值較低以及高離子強度的靜電屏蔽作用[16],乳液在進行胃液消化過程中表面負電荷密度降低,進而導致ζ-電位絕對值下降。該結果與TRONCOSO等[17]的研究結論相一致。然而,在體外模擬胃液消化過程中,消化液的ζ-電位仍然呈負值,這是因為SPI-PC的疏水作用與PC表面分子的表面空間位阻作用導致帶負電荷的PC掩蓋了SPI的正電荷。當薄荷油乳液經過腸液時ζ-電位絕對值顯著增大,分析原因如下:薄荷油在脂肪酶水解后釋放陰離子的游離脂肪酸和單甘脂導致消化液的凈電荷增加,同時在pH值為7.5的環境中,帶負電荷的脂質、蛋白、膽鹽等物質極易取代蛋白吸附到油-水界面處,導致乳液經過小腸液后帶有大量的負電荷,然而膽鹽、脂質的負電荷量低于液滴界面蛋白,因此蛋白質被置換出界面后,乳化體系總的界面負電荷量下降而沒有回到初始的ζ-電位。
2.4 納米乳液的油脂消化分析
目前,國內外很多食品、藥品領域學者利用pH-stat法檢測體外模擬腸液消化過程中油脂的游離脂肪酸釋放率變化[18]。通過測定模擬腸消化過程中游離脂肪酸的釋放率可以用來判斷薄荷油納米乳液油相的水解程度與速率。消化乳液進入小腸后,甘油三酯被胰脂酶和豬膽酸鹽脂解生成甘油單酯、甘油二酯和游離脂肪酸[19],為了保持腸液消化體系在pH值7.5條件下不變,需要不斷加入NaOH中和水解過程中生成的游離脂肪酸,同時通過計算此過程中消耗NaOH的量計算游離脂肪酸釋放率。圖3為薄荷油納米乳液體外模擬消化過程中游離脂肪酸的釋放曲線。從該圖可以看出,在游離脂肪酸的釋放率呈現先迅速增加后緩慢上升的變化趨勢,而對于空白對照薄荷油的游離脂肪酸釋放率始終趨于平緩,經過120 min模擬腸液消化后,薄荷油納米乳液的游離脂肪酸釋放率達到104.3%,與SALVIA-TRUJILLO等[13]的研究結果一致,表明薄荷油納米乳液的油相在消化過程中能被完全水解。比較發現空白對照薄荷油的游離脂肪酸釋放率僅為30.4%,表明納米乳化體系可以有效地提高油脂的游離脂肪酸釋放率。分析原因在于薄荷油脂解屬于界面反應,由于納米乳化包埋體系中的油相在一定程度上具有較大的表面積,油-水界面上吸附的蛋白減少,空間位阻作用減弱,更有利于胰脂肪酶與油脂的接觸反應,從而提高脂解效率。同時胰酶中的磷脂酶A2可促進消化PC結構中的sn-2鍵,生成2-酰基溶血磷脂,該消化產物可破壞磷脂乳化層結構,并且豬膽鹽中的膽固醇酶可激活膽固醇酶催化消化PC,進一步提高了游離脂肪酸釋放率,由于豬膽汁鹽可激活膽固醇酶催化消化PC,形成游離脂肪酸,因此納米乳化體系的游離脂肪酸釋放率高于100%,也是由于PC的消化所致。在對照組中,游離的油相不溶于水,減緩了脂解的過程,降低了游離脂肪酸釋放率。
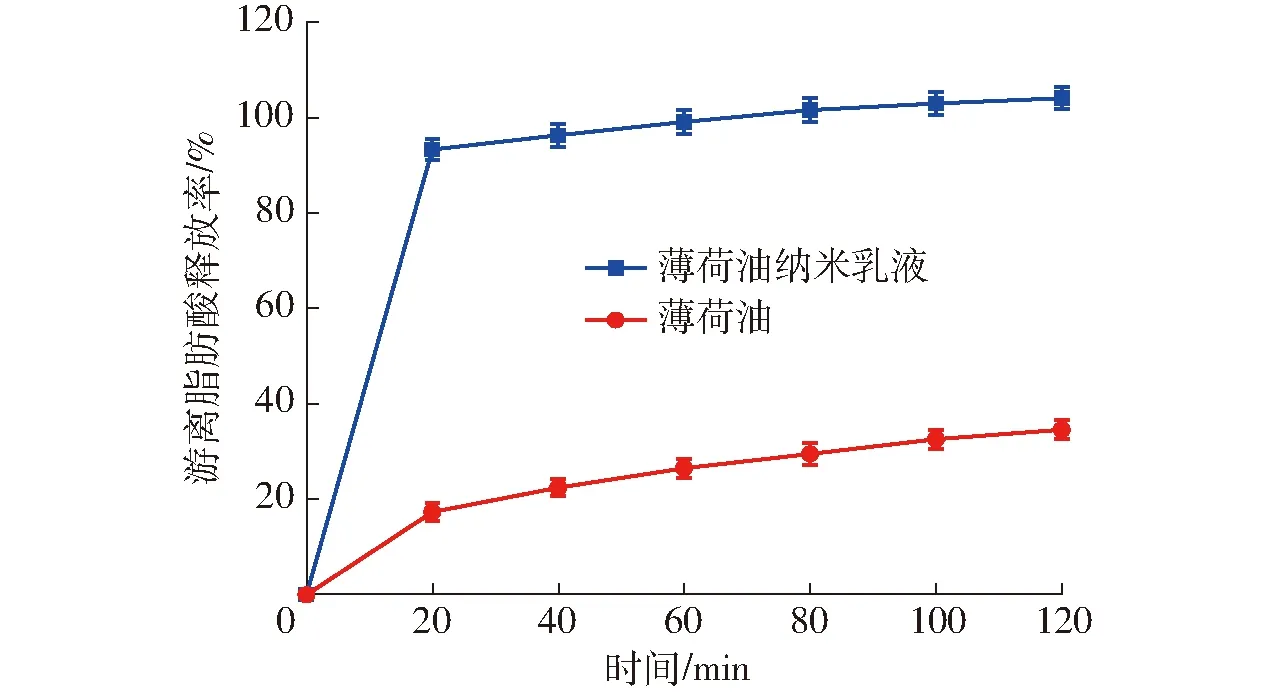
圖3 薄荷油納米乳液在腸消化中的游離脂肪酸釋放率變化曲線Fig.3 Change of FFA release rate of peppermint oil nanoemulsion in intestine digestion
2.5 納米乳液中薄荷醇生物可利用度分析
薄荷油納米乳液中的生物活性物質會在體外模擬消化過程中變化。納米乳化后的薄荷油會不斷在胰脂肪酶和豬膽酸鹽作用下水解,并被載入到由膽鹽、PC、脂肪酸組成的混合膠束中,進而被小腸上皮細胞吸收[20]。因此可以通過測定膠束中薄荷醇的濃度得到薄荷醇的生物可利用度。結果表明,與對照組薄荷油中的薄荷醇生物可利用度3.4%比較,采用納米乳化體系包埋的薄荷醇生物可利用度為84%,表明納米乳化體系提高了薄荷醇的生物可利用度,游離脂肪酸釋放率的增加有利于被包埋生物活性物質的生物可利用度的提高,YU等[21]的研究結果也表明油相的水解程度與生物活性物質的生物可利用度之間呈正相關。與其他類似生物活性物質的研究比較,發現此結果要高于WANG等[22]使用月桂酸十甘油酯作為表面活性劑時的結果。GOLDING等[23]發現,生物活性物質在體外模擬消化的膠束化過程中極易因界面上表面活性劑的競相吸附受到影響,在此過程中,膽鹽和PC替換原有表面活性劑分子而吸附到油-水界面處,形成膠束。因此,表面活性劑組分與結構特性也影響生物活性物質的膠束化過程。本文以PC作為表面活性劑,在膠束形成過程中直接用于構建膠束,SPI因生物酶水解形成氨基酸與小分子多肽降低了油-水界面處的吸附膜厚度,更容易被PC和膽鹽替換,進而得到更高的生物可利用度。
2.6 納米乳液的穩定性分析
傳統檢測乳液穩定性的方法通常采用離心加速實驗,通過觀察上浮層高度來判斷乳液的穩定性[24]。多重光散射穩定性分析技術采用激光光源將薄荷油納米乳液從底部掃描至頂部,在不利用外界作用力的情況下通過光學傳感器收集乳液樣品的透射光和背散射光隨乳液高度和時間的變化,在較短的時間內監測出乳液的穩定性并得到TSI(穩定性指數)值,具有實驗進展快速、實驗結果準確、客觀等優勢[25]。實驗結果如圖4所示,薄荷油穩定性指數結果為2.8,結果表明在掃描高度為0.085~4.97 mm的樣品瓶底部出現背散射光強度上升現象,薄荷油納米乳液的底部背散光強度范圍為33.34%~35.62%,表明薄荷油納米乳液出現輕微乳析現象,掃描高度在15~30 mm范圍內,乳液的中部背散射光強度范圍為46.56%~47.48%,表明薄荷油納米乳液很少有液滴聚合現象,掃描高度在40~43.6 mm范圍內,乳液的頂部背散射光強度在38.73%~45.89%,結果表明薄荷油納米乳液出現脂肪液滴發生輕微的上浮[26]。上述結果表明,在8 h的測量過程中,薄荷油納米乳液僅出現了由分散相與連續相的密度差引起的顆粒上浮現象,并未發生粒徑上的變化,這是因為SPI為非離子表面活性劑,在乳液中不存在因電荷作用引起的液滴之間的吸附或排斥。因此通過高壓均質制備得到的薄荷油納米乳液穩定性良好。
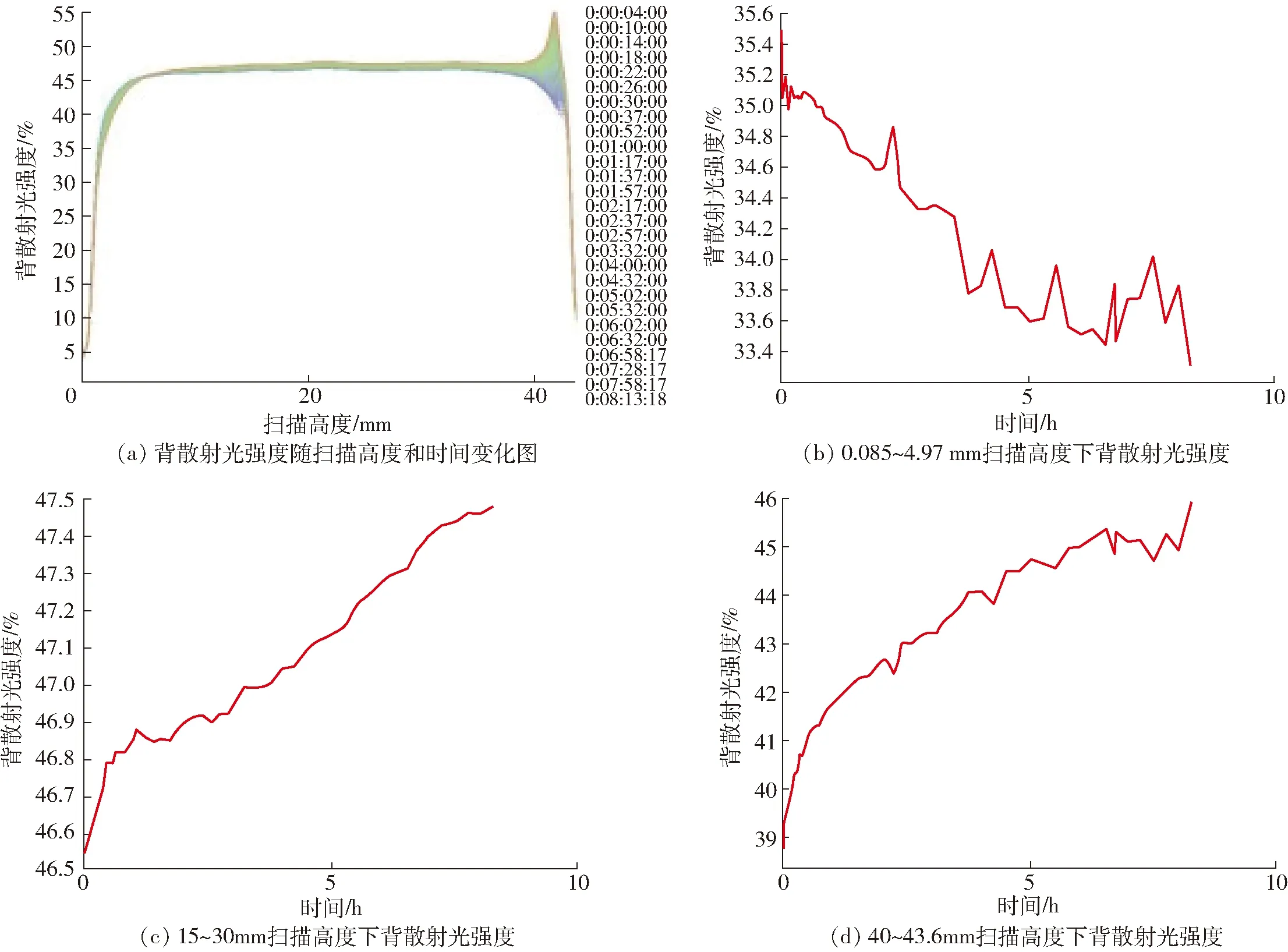
圖4 薄荷油納米乳液的穩定性分析圖Fig.4 Analysis diagrams of stability of peppermint oil nanoemulsion
3 結束語
本研究考察薄荷油納米乳液在體外模擬消化過程中乳液包埋對平均粒徑、ζ-電位、游離脂肪酸釋放率以及薄荷醇生物可利用度的影響。激光掃描3D共聚焦顯微鏡結果表明納米乳液中薄荷油完全被SPI包埋,呈核殼狀結構。高壓均質處理制備的薄荷油納米乳液的游離脂肪酸釋放率及薄荷醇生物可利用度遠大于薄荷油的對照組。薄荷油納米乳液在模擬胃消化階段,乳液的平均粒徑、ζ-電位均變大,乳液的微觀結構表明消化體系出現液滴聚合現象;在模擬腸液消化后,薄荷油納米乳液的界面蛋白被水解,油滴被消化,乳液的平均粒徑減小、ζ-電位絕對值增加。根據多重光散射穩定性分析儀掃描圖譜可知,薄荷油納米乳液在55℃條件下檢測8 h并未出現乳液上浮和絮凝等現象,結果表明高壓均質制備的納米乳液具有良好的穩定性。

