miR-495在骨肉瘤組織中的表達變化及意義
宮錦蕾,王美鳳,邢國英,孫英華,夏海,王復超,張兆卿
(1濰坊醫學院附屬益都中心醫院,山東濰坊262500;2大連醫科大學附屬第一醫院)
骨肉瘤是一種高度惡性的原發性骨腫瘤,好發于青少年,早期易發生肺轉移,5年生存率低[1,2]。15%~20 %的骨肉瘤患者在初診時影像學已發現肺轉移,約50 %的骨肉瘤患者在晚期治療期間發生肺轉移,最終發生肺轉移的患者可高達80%[3]。近年來骨肉瘤在病因、發生發展機制、早期診斷和治療方面取得了一定的進展,但在骨肉瘤發生、發展過程中起關鍵作用的基因尚不明確,臨床上也缺乏有效的靶向治療藥物及分子生物學標志物。微小核糖核酸(miRNA)是一類高度保守的內源性非編碼小RNA,參與調控眾多關鍵的細胞通路及腫瘤的發生、發展過程[4,5]。但目前有關miR-495在骨肉瘤中的作用研究甚少,為此,我們進行了如下研究。
1 臨床資料
選擇2012年2月~2013年1月在濰坊醫學院附屬益都中心醫院行手術治療的骨肉瘤患者56例,男34例、女22例,年齡>20歲16例、≤20歲40例,腫瘤部位在四肢49例、其他7例。排除合并嚴重心腦血管疾病、肝腎功能不全及其他腫瘤患者。患者術前均未行放化療及生物免疫治療。56例均經術后病理檢查確診為骨肉瘤,腫瘤直徑>5 cm 40例、≤5 cm 16例,Enneking分期Ⅰ~Ⅱa期14例、Ⅱb~Ⅲ期42例,淋巴結遠處轉移18例、無遠處轉移38例。本研究通過醫院醫學倫理委員會批準,患者及家屬均知情同意。
2 方法與結果
2.1 骨肉瘤組織及其癌旁組織miR-495表達檢測 收集患者術中切除的骨肉瘤組織及其對應的癌旁組織(距離腫瘤邊緣>5 cm,病理檢查證實為正常組織)標本各56例份,取材后迅速置入液氮中,-70 ℃保存,采用real-time PCR法檢測miR-495表達。具體方法:取液氮中保存的骨肉瘤組織及其對應的癌旁組織,研磨后采用TRIzol試劑盒(美國Invitrogen公司)提取組織總RNA,分光光度儀檢測總RNA的純度及濃度,以OD260/OD280為1.9~2.0作為合格標準。按逆轉錄試劑盒(大連寶生物工程有限公司)說明書將RNA逆轉錄得到cDNA,以cDNA為模板,參照實時熒光定量PCR試劑盒(大連寶生物工程有限公司)說明書配置real-time PCR體系進行PCR反應。miR-495引物序列:上游引物為5′-TCCGATTCTTCACGTGGTAC-3′,下游引物為5′-GTGCAGGGTCCGAGGT-3′;內參U6引物序列:上游引物為5′-TCCGATCGTGAAGCGTTC-3′,下游引物為5′-GTGCAGGGTCCGAGGT-3′。PCR反應條件:94 ℃、2 min,94 ℃、20 s,60 ℃、30 s,共40個循環。采用2-ΔΔCt法計算miR-495相對表達量。結果顯示,骨肉瘤組織及其癌旁組織miR-495相對表達量分別為0.42±0.16、1.01±0.05,兩者比較P<0.01。骨肉瘤組織miR-495相對表達量的均值為0.42。56例患者中,miR-495相對表達量≤0.42者31例、>0.42者25例。
2.2 骨肉瘤組織miR-495表達與患者臨床病理參數及預后的關系 收集患者的臨床資料,包括性別、年齡、腫瘤直徑、腫瘤部位、Enneking分期、淋巴結遠處轉移等。對所有患者進行隨訪,采用門診或者住院復查及電話隨訪的方式進行,以手術出院當日作為隨訪起點。總生存期定義為從隨訪起點開始到死亡日期或最終觀察日期2018年1月,失訪及其他原因導致的死亡按截尾數據處理,計算5年生存率。分析miR-495表達≤均值與患者臨床病理參數及預后的關系。
結果顯示,骨肉瘤組織miR-495表達≤0.42與患者Enneking分期、淋巴結遠處轉移有關(P均<0.01),與患者性別、年齡、腫瘤直徑及腫瘤部位均無關(P均>0.05)。見表1。
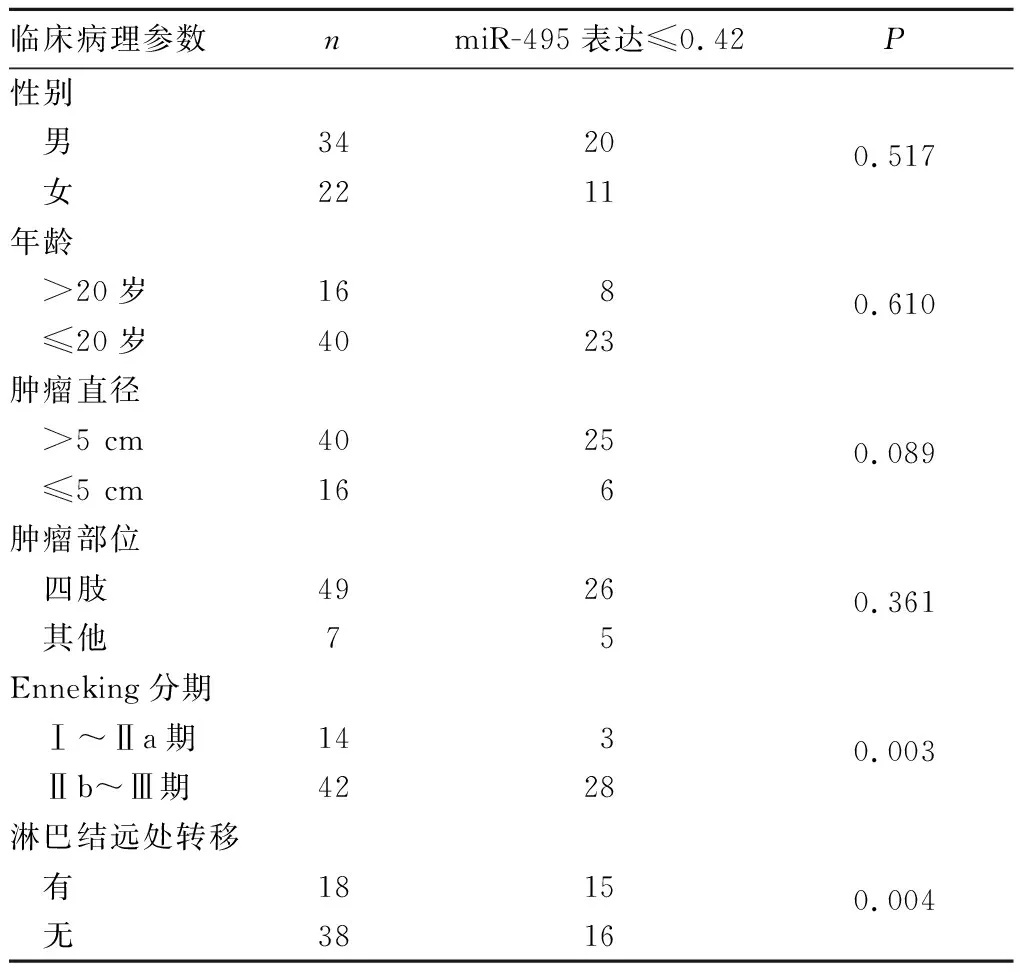
表1 骨肉瘤組織miR-495表達≤0.42與患者臨床病理參數的關系(例)
骨肉瘤組織miR-495表達≤0.42者5年生存率為26%,>0.42者5年生存率為48%;二者比較P<0.01。見圖1。COX比例風險回歸模型結果顯示,miR-495表達≤0.42是影響骨肉瘤患者預后的獨立危險因素(HR=3.699,95%CI:1.985~6.941,P<0.05)。
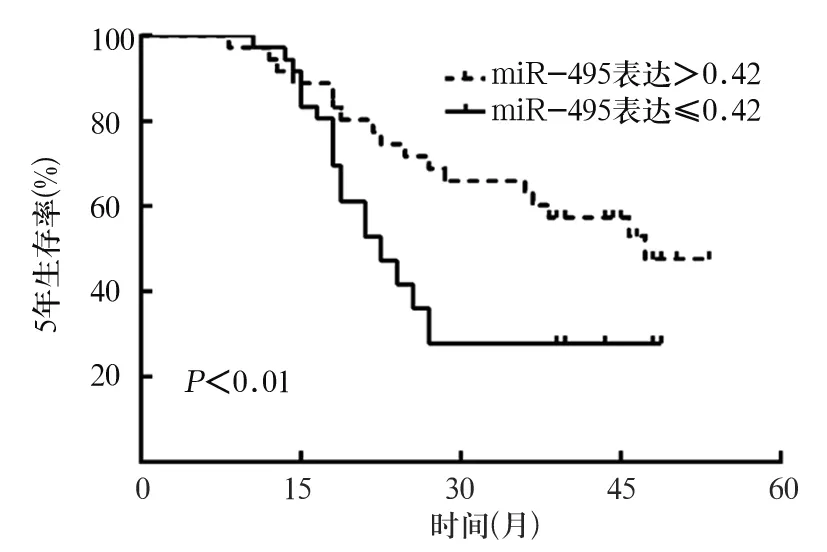
圖1 miR-495表達與骨肉瘤患者生存期的關系
3 討論
病理學分期是預測骨肉瘤生物學行為及患者預后的傳統手段,但其存在明顯的局限性。目前臨床急需尋找有效而準確的早期診斷及判斷預后的骨肉瘤分子生物學標志物。研究證實,基因表達異常與腫瘤的發生、發展密切相關[6],異常表達的基因有可能成為惡性腫瘤有效而準確的分子生物學標志物[7,8]。miRNA是近年來發現的一類長度為20~25個核苷酸非編碼小分子RNA,雖然miRNA僅占人體基因總數的2%,但卻參與調控人體30%以上的基因表達[9,10]。研究發現,多種miRNA參與調控骨肉瘤細胞增殖、凋亡、侵襲及遷移等惡性生物學行為,從而參與骨肉瘤的發生、發展過程[11]。Li等[12]研究發現,miR-34a、miR-143、miR-145、miR-200b在骨肉瘤細胞中的表達均降低,并與骨肉瘤的侵襲與轉移有關。Wang等[13]報道,與正常骨組織比較,骨肉瘤組織中miR-214表達明顯增高,并且高表達的miR-214與腫瘤遠處轉移及化療耐藥有關。miR-495是近期發現的miRNA家族重要成員之一。研究發現,miR-495在食管癌、前列腺癌、非小細胞肺癌等惡性腫瘤中表達降低[14~16],而在肝細胞癌、乳腺癌等惡性腫瘤中表達升高[17,18],提示miR-495存在組織和細胞的特異性,在不同的腫瘤中可能發揮不同作用。
目前有關miR-495在骨肉瘤組織中表達變化的研究甚少。本研究結果顯示,骨肉瘤組織miR-495相對表達量明顯低于癌旁組織,提示miR-495表達異常下調可能參與了骨肉瘤的發生。本研究結果顯示,骨肉瘤組織miR-495相對表達量≤0.42與患者Enneking分期、淋巴結遠處轉移有關,與患者性別、年齡、腫瘤直徑及腫瘤部位均無關;說明miR-495異常低表達可能參與了骨肉瘤的轉移過程。miRNA的功能主要取決于其下游靶基因的生物學效應,目前miR-495調控骨肉瘤發展轉移的具體下游分子機制尚不完全清楚。Zhang等[19]研究證實,miR-495通過負調控下游靶基因MYB表達而抑制膠質瘤瘤細胞增殖、遷移和侵襲,并誘導細胞凋亡。Chu等[20]研究發現,miR-495通過靶向調控MTA3基因而抑制非小細胞肺癌細胞的增殖及轉移。但miR-495在骨肉瘤中的下游調控靶基因尚有待進一步探討。
目前有關miR-495對惡性腫瘤患者預后影響的研究較少。Wang等[21]在對62例髓母細胞瘤患者的隨訪研究中發現,miR-495低表達與髓母細胞瘤患者的不良預后密切相關。也有研究發現,非小細胞肺癌組織中miR-495表達與患者預后無關[22]。目前尚未見miR-495對骨肉瘤患者預后影響的報道。本研究結果顯示,骨肉瘤組織miR-495表達≤0.42者5年生存率低于miR-495表達>0.42者,miR-495表達≤0.42是影響骨肉瘤患者預后的獨立危險因素;說明骨肉瘤組織miR-495表達≤0.42提示患者預后較差。
綜上所述,骨肉瘤組織中miR-495表達降低,miR-495異常低表達可能參與了骨肉瘤的發生、發展及轉移,并且與患者預后不良有關。miR-495有望成為骨肉瘤早期診斷及判斷預后的分子生物學標志物,但其在骨肉瘤中的具體作用機制尚有待進一步研究。

