Th17通過NF-κB和P38調控急性腦梗死大鼠炎性損傷的實驗研究
田嘉瑩, 盛寶英, 韓 鳳, 姜堯佳, 李叢言, 畢 勝
急性腦梗死是目前致殘率、病死率最高的疾病之一,因其易復發、預后差等特點引起了人們的重視[1]。急性腦梗死后可引起缺血中心區和周圍區神經元損傷,其致病機制之一是全身炎癥反應綜合征。然而需要特殊強調的是腦內的強炎性反應引起腦組織病灶區的損傷比缺血本身更嚴重[2]。因此,恢復及保持腦梗死后機體免疫系統功能的正常對腦梗死患者具有重要的臨床意義。
輔助性T細胞17( T helper 17 cells,Th17)是最近新發現的一群獨特的CD4+輔助性T細胞亞群。相關研究認為,炎癥反應及自身免疫性疾病中Th17細胞發揮著至關重要的作用。研究表明,急性腦梗死患者缺血部位Th17浸潤、活化后可有效透過血-腦脊液屏障、高表達顆粒酶 B、導致神經元損傷并分泌多種細胞因子,參與自身免疫應答[3]。本實驗通過觀察Th17及其效應分子的動態變化,確定其在急性腦梗死發生發展中的免疫調節作用。以期為急性腦梗死后炎癥反應的有效控制降低腦損傷程度提供可靠的理論依據。
1 材料和方法
1.1 實驗試劑 BCA蛋白定量試劑盒(BOSTER,Prod:AR0146),兔源β-Actin 單克隆抗體(Cell signaling,13E5),兔源NF-κB P-65多克隆體抗(Affinity,AF5006),兔源p-P38 單克隆抗體(Cell signaling,D3F9)。
1.2 急性腦梗死大鼠模型構建 按照常規方法-線栓法[4]通過手術制備大腦中動脈閉塞 (middle cerebral artery occlusion,MCAO)模型。水合氯醛腹腔注射麻醉,劑量為300 mg/kg。頸部正中縱行切開,暴露左側頸總和頸外動脈,分離迷走神經以防損傷。阻斷頸總動脈的近心端下微血管血流后,在頸外動脈遠心端和近心端之間插入普通尼龍線栓,使一側大腦中動脈閉塞。120 min后拔出線栓,縫合、消毒。假手術組僅分離頸總動脈,隨即縫合切口。
1.3 實驗動物及分組 8~10周齡的雄性SD大鼠,體重250~300 g,共20只,由哈爾濱醫科大學動物中心提供。隨機分為3組,MCAO 24 h、72 h和假手術組,5只/組。
1.4 模型評價 模型制備后24 h,動物應清醒。隨即采用Bederon[4]等的方法通過神經功能評分確定模型是否構建成功。 計分方法如下:(1)提大鼠尾巴,觀察右前肢內收、內旋情況,根據輕重程度,評分為1~3分。4分:大鼠身體右側旋轉。(2)大鼠肌張力評定:借助金屬網,通過向后輕拉大鼠尾巴觀察雙側前肢肌張力,根據輕重程度,評分為0~2分。(3)借助光滑平面,觀察側向推擋阻力。0分:兩側推無顯著差別;1分:右側明顯弱于左側;2分:向右推大鼠向右側傾倒。(4)大鼠左上眼瞼下垂且分泌物增多,評為2分。總分10分。以上評分相加為最后得分,大于3分屬于造模成功,低于3分直接剔除。
1.5 外周血Th17細胞數量的檢測 制備流式細胞儀樣品,三色標記Th17細胞:抗CD3-FITC單克隆抗體、抗CD4-PE單克隆抗體和抗IL-17A-APC單克隆抗體,另設陰性對照管。流式細胞儀專用染色管中加入EDTA抗凝血0.1 ml,紅細胞裂解液裂解3次,3%FCS洗滌3次后加入CD3-FITC單克隆抗體、抗CD4-PE單克隆抗體抗體孵育30 min進行表面染色,3%FCS洗滌后加入固定透膜劑孵育,隨后加入抗IL-17A-APC熒光抗體進行細胞內染色。流式細胞儀(FACSCalibur,美國B&D公司)檢測,應用FACSCELLQUEST軟件,每個樣品分析10000個細胞,以陰性對照為參考,將對照管所示的非特異熒光的99%以上作為本底扣除,以二維點陣圖顯示,記錄Th17細胞的百分率。
1.6 Western blotting檢測大鼠腦組織中NF-κB P65和p-P38表達水平 動物脫臼處死,取出大腦,冰凍的PBS清洗組織表面血液,取梗死部位大腦組織,置于玻璃勻漿器內,加蛋白裂解液均漿后BCA法測蛋白濃度,上清液-80 ℃保存。適量蛋白上樣后行聚丙烯酰胺凝膠電泳,濕轉后5%脫脂奶粉室溫下封閉1 h,分別加NF-κB p65 (1∶1000)、p- P38(1∶1000) 和β-actin抗體,4 ℃ 孵育過夜,室溫下HRP標記的二抗(1∶10000)孵育1 h,ECL化學發光法顯影。采用 Image-J圖像分析軟件,計算各指標相對于內參的相對吸光度值。
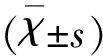
2 結 果
2.1 大鼠外周血中Th17細胞數量變化 與假手術組(Sham)相比,急性腦梗死大鼠出血24 h(MCAO 24 h)和72 h(MCAO 72 h)組外周血中Th17細胞數量均明顯增加(P<0.01);與MCAO 24 h組相比,MCAO 72 h組外周血中Th17細胞數量增加,有統計學意義(P<0.05)(見圖1)。
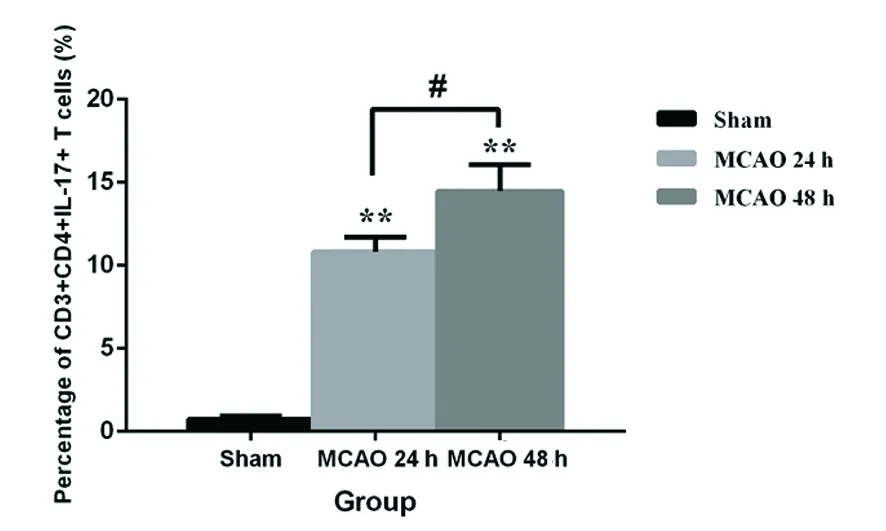
2.2 大鼠腦組織中NF-κB P65蛋白表達變化 與Sham組相比,MCAO 24 h和72 h組腦組織中NF-κB P65蛋白表達明顯增加(P<0.01);但是腦梗死后的時間并沒有明顯影響腦組織中NF-κB P65蛋白的表達(P<0.05)(見圖2)。
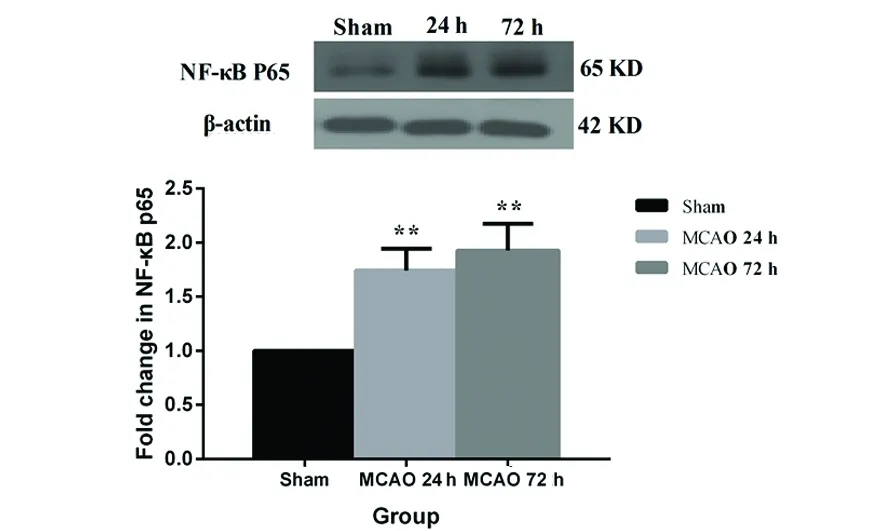
2.3 大鼠腦組織中p-P38蛋白表達變化 與Sham組相比,MCAO 24 h和72 h組腦組織中p-P38蛋白表達明顯增加(P<0.05,P<0.0,1);但是腦梗死后的時間并沒有明顯影響腦組織中p-P38蛋白的表達(P<0.05)(見圖3)。
與Sham組比較**P<0.01; 與MCAO 24 h組比較#P< 0.05
圖1 急性腦梗死大鼠外周血中Th17細胞數量變化
與Sham組比較**P< 0.01
圖2 急性腦梗死大鼠腦組織中NF-κB P65蛋白表達變化
與Sham組比較*P< 0.05,**P< 0.01
圖3 急性腦梗死大鼠腦組織中p-P38蛋白表達變化
3 討 論
感染并發癥在腦梗死患者中的發生率約為21%~65%[5,6],是腦組織損傷的主要誘因,與腦梗死患者的臨床結局和長期預后密切相關[7]。然而,關于腦梗死后機體如何發揮抗感染免疫調節機制,迄今為止仍然存在大量未知領域。相關研究表明,CD4+T細胞亞群之間的相互作用是免疫調節平衡作用的關鍵因素之一。CD4+T細胞的免疫失調在急性腦梗死的發生、發展中具有重要作用。然而,Th17作為致炎性細胞因子IL-17的主要來源,是否參與了急性腦梗死后炎癥反應導致的繼發性腦水腫和腦損害,目前尚無定論。
相關研究證明,Th17可能參與了頸動脈粥樣硬化的發生/發展,腦梗死患者外周血的Th17比例及IL-17水平越高,頸動脈斑塊越大[8]。然而動脈粥樣硬化是急性腦梗死發生的主要原因。Shichita等研究發現,急性腦梗死發生后出血周圍的腦組織中大量T細胞浸潤,并且腦組織的損傷及神經功能的缺失與IL-17和IL-23水平升高密切相關[9]。由此可見,Th17不僅參與了急性腦梗死的發生,而且在急性腦梗死后繼發性腦水腫和腦損傷的病理過程中也占有重要一席。本實驗結果發現,與假手術組相比,急性腦梗死大鼠外周血中Th17細胞數量明顯增加,并與出血時間呈正相關(見圖1)。相關文獻報道,腦出血后血腫周圍組織在發病24~72 h炎癥反應及組織損傷最為嚴重。與本實驗結果相一致,Th17在外周血中的增加與腦組織炎癥反應及損傷時間上一致,進一步證實急性腦梗死后Th17參與了腦組織的炎癥反應。Th17細胞及其分泌的細胞因子在炎癥反應及自身免疫性疾病等方面發揮重要作用。IL-17作為Th17的特征性/效應性細胞因子,與受體結合后通過活化MAPK(絲裂原而活化蛋白激酶)和NF-κB(核因子κB)激活多種免疫細胞(包括樹突狀細胞、單核細胞、成纖維細胞),尤其是中性粒細胞,誘導多種促炎性因子調控固有和特異性免疫應答引起組織炎性細胞浸潤并導致組織破壞[10]。為了明確Th17是如何參與急性腦梗死大鼠腦部免疫細胞的活化和誘導,在本實驗中檢測了p-P38和NF-κB P65蛋白的表達。實驗結果發現,兩種蛋白的表達趨勢與Th17在外周血中的百分比完全一致。由此證明Th17細胞可通過調控NF-κB和P38的活化調控急性腦梗死大鼠腦部炎癥反應。
卒中后的免疫炎性反應對機體來說是一把雙刃劍。根據卒中后缺血發生的時間長短、免疫細胞的種類和數量或者小膠質細胞的活化程度等來評定免疫細胞是發揮損傷性作用還是保護性作用[11]。因此我們發現,如果腦梗死發生后的免疫炎性反應能夠進行人為調控,誘導免疫炎性反應適度從而對機體產生保護性作用,達到操控腦梗死的臨床過程和預后。本實驗發現在急性腦梗死后發生的炎性反應與Th17細胞密切相關,因此臨床上可以通過調控IL-17的水平改善卒中后的炎性反應,為其后發生的腦水腫和腦損傷提供新的治療途徑。

