植物花青素生物合成代謝途徑及調控因子研究
吳雪霞,張愛冬,朱宗文,姚 靜,查丁石,李 賢?
(1上海市農業(yè)科學院設施園藝研究所;2上海市設施園藝技術重點實驗室,上海201403;3臨沂市農業(yè)局,臨沂276001)
花青素(Anthocyanins)是一類水溶性天然色素,基本結構為3,5,7-羥基-2-苯基苯并吡喃,屬于類黃酮化合物,在細胞質中合成,但在液泡中積累[1-2]。花青素在植物的花瓣、果實、葉和莖等中廣泛分布,使植物呈現(xiàn)紅、藍、紫等顏色[3-4]。
植物中常見6種花青素:天竺葵色素(Pelargonidin,Pg)、矢車菊色素(Cyanidin,Cy)、飛燕草色素(Delphinidin,Dp)、芍藥花色素(Peonidin,Pn)、牽牛花色素(Petunidin,Pt)和錦葵色素(Malvidin,Mv)[2,5-7]。
研究表明,花青素與植物抗逆性相關,能提高植物抗低溫、干旱和強光等逆境的能力,降低植物紫外輻射和病害的程度,保護植物,減輕損傷[7-8]。同時,因其具有清除自由基、提高抗氧化性、保護血管、降低血脂、抗腫瘤等一系列生理功能,被廣泛應用于藥品、保健品、化妝品以及動物生產等多個領域[9-10]。因此,花青素的研究越來越受到人們的重視,花青素作為一種次生代謝產物,其合成代謝受多種調控因子及酶影響,研究花青素生物合成過程及代謝過程中的關鍵酶、調控基因及環(huán)境因子對花青素的調控,有利于深入理解花青素的合成機理,對于進一步開發(fā)利用花青素具有重要意義。
1 植物花青素生物合成途徑及碳骨架修飾
1.1 植物花青素生物合成途徑
植物花青素生物合成屬于次生代謝產物黃酮類的分支途徑,關于花青素合成過程及關鍵酶類均已研究的比較清楚。雖然不同物種在花青素組成及積累模式上存在差異,但花青素合成的主要反應是類似的[3,10]。花青素合成路徑主要分為以下三個階段(圖1)。
第一階段,類黃酮代謝的初始反應。前體物質苯丙氨酸經苯丙氨酸裂解酶(Phenylalanine ammonialyase,PAL)、肉桂酸羥化酶(Cinnamate 4-hydroxylase,C4H)和4-香豆酰CoA連接酶(4-coumarate CoA ligase,4CL)合成4-香豆酰CoA[11-12]。
第二階段,類黃酮代謝的重要反應。4-香豆酰 CoA和丙二酰 CoA經查爾酮合成酶(Chalcone synthase,CHS)催化合成四羥基查爾酮,查爾酮經查爾酮異構酶(Chalcone isomerase,CHI)的異構化作用形成無色化合物三羥基黃烷酮,隨后進一步經黃烷酮-3-羥化酶(Flavanone 3-hydroxylase,F3H)催化合成黃烷酮和二氫黃酮醇[2,5]。
第三階段,各種花青素的合成階段。黃烷酮和二氫黃烷酮經二氫黃酮醇還原酶(Dihydroflavonol 4-reductase,DFR)催化作用,還原C環(huán)4位生成不同的無色花色素。隨后,這些無色花色素經花青素合成酶(Anthocyanidin synthase,ANS)催化作用產生有色花色素;類黃酮3-葡糖基轉移酶(Flavonoid 3-O-glucosyltransferase,3GT∕UFGT)催化有色花色素與糖苷結合轉化成有色的花色苷[2,5,11]。
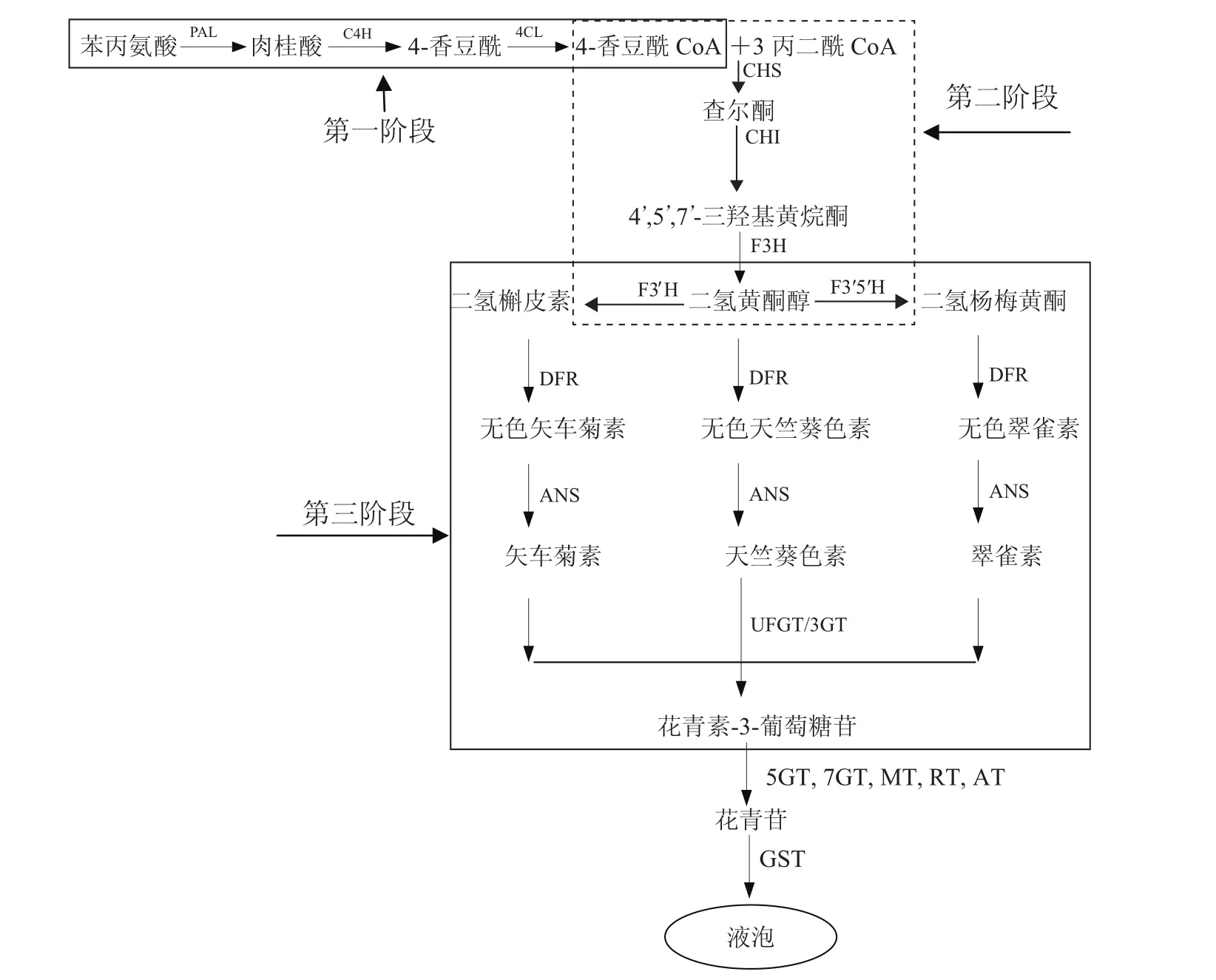
圖1 植物花青素生物合成途徑Fig.1 Biosynthesis pathway of plant anthocyanin
1.2 花青素碳骨架修飾
花青素碳骨架修飾主要包括糖基化、酰基化和甲基化,不同的修飾形成了不同的花青素[5,12],目前關于這方面的研究才剛剛起步。花青素糖基化主要通過3GT實現(xiàn),也存在第5位或第7位的鼠李糖及其他糖類的修飾。矮牽牛花、金魚草的花青素修飾是通過鼠李糖糖基化產生花青素-3-蕓香糖苷,非釀酒葡萄品種發(fā)生在C3和C5位,形成3,5-O-二糖苷花青素。花青素酰基化增強花青素的穩(wěn)定性,阻止花青素水解為無色的查爾酮;甲基化使得花青素的結構、顏色具有多樣性。花青素酰基化和甲基化過程涉及甲基轉移酶和酰基轉移酶的參與[7]。例如,有多種底物特異性的酰基轉移酶BAHD家族,依賴于S-腺苷蛋氨酸的花青素甲基轉移酶。
2 植物花青素生物合成途徑中關鍵酶基因
植物花青素生物合成途徑主要包括編碼花青素代謝生物合成過程中的關鍵酶CHS、CHI、F3H、DFR、ANS和UF3GT等結構基因,這些結構基因的表達不僅受轉錄因子MYB、bHLH和WD40的調控,還受外在環(huán)境因子的影響[13-15]。克隆鑒定與花青素合成相關的結構基因和調控基因,進而分析出它們的功能,成為近年來花青素相關基因研究的熱點。外在環(huán)境因子通過對花青素苷合成途徑中的結構基因和調控基因進行調節(jié)來影響花青素苷合成。
2.1 植物花青素生物合成途徑中主要結構基因
2.1.1 查爾酮合成酶基因
CHS是花青素生物合成途徑中的第1個關鍵酶,CHS基因已從多種植物中分離克隆出來[16]。CHS基因的表達影響著植物花色的變化,將CHS基因在矮牽牛中過量表達,導致CHS基因和內源基因發(fā)生共抑制,產生白色或斑點狀的花[17];CHS基因表達量減少,矮牽牛花色由紫色變?yōu)榘咨玔18]。Schijlen等[19]利用RNAi技術抑制番茄CHS的表達,發(fā)現(xiàn)轉基因番茄花青素含量、Chs1和Chs2轉錄水平及CHS酶活性均比野生型的低,果實顏色比野生型的淺,且果實無籽,說明番茄CHS不僅參與花青素生物合成,還有其他生物功能,需要后續(xù)試驗驗證。
2.1.2 查爾酮異構酶基因
CHI是花青素生物合成途徑中的第2個關鍵酶,CHI基因最早從豌豆中分離出來,目前,該基因已從矮牽牛、菜豆和豌豆等植物中分離并克隆[14-15]。CHI酶能催化4’,5’,7’-三羥基黃烷酮轉化為無色柚皮素,4’,5’,7’-三羥基黃烷酮是合成黃色花色素的重要底物,因此黃色的形成與CHI基因表達有關。Nishihara等[20]利用RNAi技術使煙草的CHI基因受到抑制,煙草花瓣中的4’,5’,7’-三羥基黃烷酮含量降低,查爾酮含量增加,花瓣變成黃色。祝欽瀧[21]在深紅色的矮牽牛中導入水母雪蓮(Saussurea medusa)的CHI基因,發(fā)現(xiàn)矮牽牛花色變淺粉紅并出現(xiàn)深色網狀紋路。
2.1.3 黃烷酮3-羥化酶基因
F3H是花青素生物合成早期途徑中的關鍵酶之一,F3H基因最先從金魚草中克隆得到,目前已從多種植物中分離得到[21]。F3H調控黃酮與花青素苷產物的合成,Jiang等[22]運用RNAi技術,用含有F3HRNAi載體的農桿菌GV3101侵染授粉14 d的草莓果實,發(fā)現(xiàn)侵染果實中F3H基因的表達水平與對照相比下調約70%,同時花青素和黃酮醇含量均顯著減少。姜伊娜[23]、柳青等[24]利用RNAi技術,抑制大豆F3H基因表達,發(fā)現(xiàn)轉化生成的大豆黃烷酮的含量明顯高于對照。
2.1.4 二羥基黃酮醇還原酶基因
DFR是花青素生物合成途徑中把二羥基黃酮醇轉變?yōu)榛ㄉ胤磻牡谝粋€酶,決定著花色素苷的形成。O'Reilly等[25]采用轉座子標簽技術首次從玉米和金魚草中分離DFR基因。DFR有3種底物DHK,DHQ和DHM,底物不同,合成花色不同。Meyer等[26]、Johnson等[27]分別將還原DHK的DFR基因導入矮牽牛,矮牽牛花色均變?yōu)榇u紅色。李軍等[28]利用農桿菌介導的遺傳轉化技術,將MaDFR基因轉入栽培煙草中,發(fā)現(xiàn)轉基因煙草花冠顏色加深,但花青素的種類沒有改變。因此,認為通過生物技術調節(jié)DFR基因改造花色也是未來主要的研究方向之一。
2.1.5 花色素苷合成酶基因
ANS是植物花青素生物合成途徑末端的關鍵酶,主要作用是將無色花青素轉化為有色花青素,是花卉色彩形成的基礎物質[29-30]。ANS基因最初從玉米的A2突變體中克隆得到,目前已從紫蘇、玉米、金魚草等植物中分離出來[31]。王麗輝等[32]通過VIGS方法構建ANS基因載體并轉染‘紅星’蘋果,發(fā)現(xiàn)轉染的蘋果組織中ANS基因表達量下調98.1%,同時花色苷和類黃酮合成受阻。亓希武等[33]報道在結紫色果的桑品種‘粵椹’中ANS基因表達具有組織特異性,且隨著果色加深其表達水平呈上升趨勢;結白色果的桑品種‘珍珠白’各個組織部位和各個成熟時期ANS基因均不表達。Ahn等[34]報道紫色品種‘結縷草’ANS基因在穗尖及匍匐莖中表達水平較高,綠色品種中表達量明顯較低。
2.1.6 類黃酮3-O-糖基轉移酶基因
3GT是花青素生物合成途徑的最后一個關鍵酶,主要負責將不穩(wěn)定的花色素轉變?yōu)榉€(wěn)定的花色苷。王惠聰等[35]研究表明,荔枝花青素的積累與3GT基因活性呈顯著正相關。Kobayashi等[36]認為葡萄表現(xiàn)型由白色向紅色的轉變是因為3GT基因表達活性變化的結果。韋青[37]通過組培技術向馬鈴薯中導入3GT基因,發(fā)現(xiàn)轉基因植株的塊莖和匍匐莖中該基因表達量明顯高于對照。
2.2 花青素生物合成過程中主要調控基因
花青素生物合成過程中主要調控基因有3類:MYB、bHLH和WD40轉錄因子,這些轉錄因子可形成復合體,激活或者抑制結構基因的時空表達,調控花青素在植物中的積累。
2.2.1 MYB轉錄因子
MYB轉錄因子包含一段保守的MYB結構域,為51—52個氨基酸的肽段。根據MYB結構域的個數可分為3類:含有1個結構域的R3-MYB,含有2個結構域的R2R3-MYB和含有3個結構域的R1R2R3-MYB。MYB轉錄因子在調控花青素合成過程中起著重要的作用,尤其是R2R3-MYB[38]。杜海等[39]報道將編碼R2R3-MYB轉錄因子的大豆GmMYB042基因在煙草中過表達,使類黃酮代謝途徑中PAL、CHS和FLS基因的表達上調,總黃酮含量明顯高于對照。Deluc等[40]在煙草中過表達葡萄VvMYB5a基因,影響煙草中花青素、黃酮醇、單寧酸和木質素的代謝。而李軍等[41]研究發(fā)現(xiàn),與花青素合成相關的MnMYBJ和MnMYB4基因表達量隨著桑樹果實發(fā)育呈下調趨勢,基因MnMYB330顯著上調,表明前者在花青素合成過程中起負調控作用,后者起正調控作用。
2.2.2 bHLH轉錄因子
bHLH轉錄因子包含一段保守的bHLH結構域,約60個氨基酸殘基組成。bHLH轉錄因子是調節(jié)類黃酮和花青素合成的一類重要基因。Park等[42]研究表明,將bHLH2基因插入轉座子形成的圓葉牽牛ivs(ivory seed)突變體,突變體花色變?yōu)榘咨?種子顏色深棕色變?yōu)槿榘咨utelli等[43]研究發(fā)現(xiàn),轉基因MYB類轉錄因子Ros1、bHLH轉錄因子Del的番茄花青素合成關鍵酶PAL和CHI活性增加,花青素含量提高。金萬梅等[44]研究表明,轉Ros1和Del基因草莓花青素合成途徑中的結構基因表達量上調,其中CHI上調幅度最大,根和葉的顏色變成紅紫色。
2.2.3 WD40轉錄因子
WD40轉錄因子一般有4—16個WD重復基元組成,每個WD基元約由40個高度保守的氨基酸殘基組成。目前,已經從矮牽牛、擬南芥、紫蘇、玉米和蘋果克隆出編碼WD40蛋白的基因AN11、TTG1、PFWD、PAC1和MdTTG1[45]。Selinger等[46]研究表明,編碼WD40蛋白的玉米PAC1基因與矮牽牛AN11、擬南芥TTG1類似,可以調節(jié)整個花色苷合成途徑中的不同結構基因;該基因調節(jié)玉米糊粉層顏色,不影響營養(yǎng)組織中的含量。羅遵喜等[47]研究發(fā)現(xiàn),馬鈴薯基因STWD40和矮牽牛花青素轉錄調控基因AN11相似性達86%,且在馬鈴薯的不同組織部位均表達,該基因在紫色馬鈴薯中的表達量均高于白色馬鈴薯相同部位的表達量。
2.3 環(huán)境因子
影響花青素苷生物合成過程的外界環(huán)境因子主要指光、溫度和糖等[17,35]。光主要包括光強與光質,是影響花青素積累的主要環(huán)境因子之一。李運麗等[48]研究表明,強光促進紫羅勒單位葉面積葉綠素和花青素含量。李國良等[49]研究發(fā)現(xiàn),與白光相比,藍光有利于甘薯新生葉片花青素的積累,紅光則有抑制作用。Zoratti等[50]研究表明,與白光相比,紅光促進了覆盆子果實的黃酮類物質合成,黑暗和遠紅光相反;紅光對原花青素含量影響不大,黑暗和遠紅光則使之提高。Wang等[37]研究發(fā)現(xiàn),UV-A和UV-B均能促進蘿卜塊根花青素合成。
溫度是影響花青素積累的另一個主要環(huán)境因子。前人報道低溫能誘導花青素合成相關基因的表達,提高花青素含量;高溫抑制相關基因的表達,降低花青素苷的含量[51]。李國良等[49]研究表明,高溫處理下,甘薯葉片DFR和F3H的表達受到抑制,花青素含量降低。Mori等[52]報道夜間高溫會抑制葡萄轉色期前CHS、F3H、DFR、LDOX、UFGT基因表達,轉色期后UFGT活性增加。
糖作為一種信號分子,通過信號轉導途徑,可以調節(jié)花青素合成相關酶基因的表達而影響植物花青素的積累。研究表明,糖可以顯著誘導擬南芥和葡萄花青素苷的積累[53]。Minakuchi等[54]發(fā)現(xiàn),增加保鮮液中蔗糖含量,可以使切花香石竹花瓣的顏色加深。
3 展望
通過植物突變體、RNA干涉技術和轉基因技術,篩選、克隆和鑒定植物花青素生物合成過程中相關的基因,了解植物的花青素合成代謝過程與調控機制,目前在許多模式植物中研究的已較為深入。但是花青素的生物合成過程是非常復雜的,不同的基因調控不同的花青素合成階段,不同基因之間也相互影響。隨著分子生物技術(轉錄組學、蛋白質組學和代謝組學等)的進一步發(fā)展,鑒定花青素生物合成過程中的結構基因和調控因子,深入了解植物花青素合成調控機制,對理解以及利用基因工程開展作物遺傳改良具有理論指導作用。
植物花青素積累除受到內在基因的控制外,還受到各種環(huán)境因素光、溫度、糖、激素、病原激發(fā)子等刺激因子的影響。目前外界因素對花青素的生物合成主要集中于單一因素,而多種外界因素的交叉、協(xié)同調控花青素苷呈色的分子機制研究的較少,因此,研究各種環(huán)境因素對花青素生物合成的綜合效應和分子機制,環(huán)境外在因子和內在因子的互相影響,是今后的研究方向之一。

