角蛋白降解菌Keratinibaculum paraultunense對廢棄羽毛的發酵特性研究
羊 希,李 霞,余 康,廖學品,2,3*,石 碧,2,3
(1.四川大學 輕紡與食品學院,四川 成都 610065;2.四川大學 皮革化學與工程教育部重點實驗室,四川 成都 610065;3.四川大學 制革清潔技術國家工程實驗室,四川成都 610065)
羽毛是一種豐富的可再生生物質資源。據報道,中國的家禽加工廠每年大約產生幾百萬t的羽毛副產物[1]。羽毛中含有大量的蛋白質,其中角蛋白是廣泛存在于羽毛中的一種硬性蛋白,該蛋白富含色氨酸、谷氨酸、甘氨酸、異亮氨酸、甲硫氨酸和半胱氨酸等[2],營養十分豐富。然而,目前羽毛資源并未得到合理有效的利用,大部分作為廢棄物,不僅浪費資源,而且有可能造成環境污染。
傳統的物理、化學方法降解羽毛會破壞角蛋白中一些必需氨基酸,如甲硫氨酸、賴氨酸和色氨酸等,這類方法不僅生產成本高,而且還會帶來一系列環境污染問題[3]。相對而言,生物降解廢棄羽毛更加綠色環保。但羽毛的組成結構特殊,主要由α-角蛋白(α-螺旋)或β-角蛋白(β-折疊)中的多肽鏈緊密堆積而成,其內部的半胱氨酸二硫鍵可作為連接橋形成復雜的交聯網[4]。因此,羽毛難以被木瓜蛋白酶、中性蛋白酶、堿性蛋白酶等常見的蛋白酶所降解[5]。有研究報道,利用微生物降解羽毛后可以增強羽毛的消化率和可溶性,提高羽毛的利用價值[6]。自然界中可以降解羽毛角蛋白的微生物較多,主要包括細菌類的芽孢桿菌屬(Bacillussp.)[7-8]、真菌類的曲霉屬(Aspergillussp.)[9]、放線菌的鏈霉菌屬(Streptomycessp.)[10]。但是采用微生物降解羽毛通常會面臨蛋白酶酶活低和降解羽毛時間長等問題,使得羽毛的利用程度較低,不能得到有效地資源化應用。因此,需要尋找和開發能高效降解羽毛廢棄物的降解菌。
目前,我國對羽毛降解的研究基本停留在角蛋白酶菌的分離、篩選及角蛋白酶作用機制的初步研究上,而角蛋白酶具有廣闊的應用前景使得角蛋白酶倍受關注。利用羽毛角蛋白酶降解羽毛轉化為可溶性蛋白、多肽和氨基酸來豐富飼料的營養[11];角蛋白酶應用于皮革脫毛[12-13];洗滌劑工業中添加角蛋白酶[14],達到快速清除血跡的作用;利用角蛋白酶降解羽毛,將有機氮輸入農業土壤作為重要化肥原料等[15]。
Keratinibaculum paraultunens是從養雞場附近土壤中分離得到的一株厭氧細菌,具有高效降解角蛋白的能力,可有效打破好氧細菌降解角蛋白時溶解氧的局限。本研究利用角蛋白降解菌K.paraultunense發酵雞羽毛,考察了菌株對羽軸、羽枝和羽片的降解特性;探究了不同培養基對該菌發酵產物的影響;此外,還研究了在羽毛底物不同添加量的情況下該菌的發酵性能。為進一步掌握K.paraultunense對雞羽毛的降解特性及產角蛋白酶、可溶性蛋白特性,以及雞羽毛的綜合利用提供依據。
1 材料與方法
1.1 材料與試劑
1.1.1 菌種
角蛋白降解菌株Keratinibaculum paraultunense:綿陽禾本生物工程有限公司。
1.1.2 雞毛
在當地大型家禽屠宰場收集雞毛,經過洗滌劑清洗,自來水反復沖洗后121℃滅菌30 min,80℃烘干至恒質量后,將羽片(the whole feather,C)分為羽軸(feather rachis,A)和羽枝(feather barblues,B)(見圖1),將三者分別用切割研磨機進行粉碎并過25目篩子,密封保存備用。

圖1 羽毛的構成部分Fig.1 Composition of feathers
1.1.3 化學試劑
氯化鈉、磷酸二氫鉀、磷酸氫二鉀、尿素(均為分析純):成都金山化學試劑有限公司;硫酸鎂(分析純)、L-半胱氨酸鹽酸鹽(分析純):成都市科龍化工試劑廠;茚三酮(分析純)、考馬斯亮藍(分析純):成都市科隆化學品有限公司;牛血清蛋白(純度≥98%):上海伯奧生物科技有限公司。
1.1.4 培養基
全培養基(I)、無機鹽培養基(II)和純水培養基(III)的組分濃度如表1所示,初始pH值為8.0,培養基分裝到厭氧瓶,厭氧瓶裝液量為100 mL/250 mL。121℃滅菌30 min。
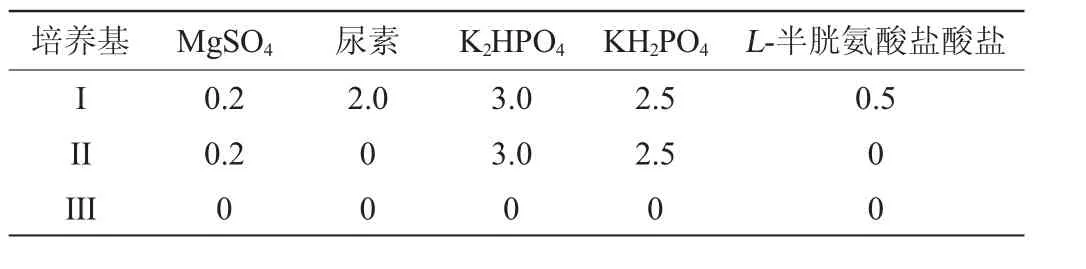
表1 實驗所用發酵培養基配方Table 1 Formula of fermentation medium used in the research g/L
1.2 儀器與設備
SM100切割研磨機:德國萊馳公司;UV-1800PC紫外可見分光光度計:上海美譜達儀器有限公司;SW-CJ-2F型雙人雙面凈化工作臺:蘇州凈化設備有限公司;A300型自動氨基酸分析儀:德國MembraPure GmbH公司;HYQX-II厭氧培養箱、HH·B11-BS-II電熱恒溫培養箱:上海躍進醫療器械有限公司。
1.3 方法
1.3.1 角蛋白降解菌發酵廢棄羽毛
將活化好的角蛋白降解菌以1%的接種量接入含有1%羽片的全培養基中,通過預實驗確定較佳的pH值為8.0,溫度為55℃,厭氧培養72 h,在此條件下進行發酵并觀察羽片的降解過程。
1.3.2 羽片降解特性分析
將粉碎后的羽軸、羽枝和羽片分別加入1%于全培養基中,活化好的菌液添加量為1%,55℃培養72 h,每間隔12 h取適量的發酵液,并將其離心(12 000 r/min、10 min),取上清液,分別測定其游離氨基酸總量、角蛋白酶的酶活力、pH和可溶性蛋白含量,并分析發酵過程中羽毛降解率的變化。
(1)游離氨基酸的測定
取適量的發酵液離心,將上清液與10%的磺基水楊酸按4∶1混合均勻,經0.22 μm微孔膜過濾后,將過濾液放置于4℃的冰箱冷藏1 h,離心取上清液,用樣品稀釋液稀釋適當倍數,最后由0.22μm過濾器再次過濾后上氨基酸分析儀進行測定[16]。
(2)角蛋白酶酶活的測定
按照文獻[17]方法略有改進:以酪蛋白為底物,實驗組取1.5 mL酪蛋白底物(10.0 g/L,pH 7.5)于離心管中,加入1.0 mL粗酶液(發酵液經8 000 r/min離心5 min,上清液即為粗酶液),80℃條件下恒溫水浴反應10 min,加10%三氯乙酸1.0 mL終止反應;對照組取1.0 mL粗酶液于試管中,加入1.0mL10%三氯乙酸,80℃條件下恒溫水浴反應10min,反應終止時加1.5mL酪蛋白底物。將反應產物于12000r/min條件下離心10min,取上清液測定其波長280nm處的吸光度值。
角蛋白酶酶活定義:在pH值為7.5,溫度為80℃的條件下,每1.0 mL酶液反應10 min后,A280nm每增加0.01為一個酶活單位(U/mL)。
(3)可溶性蛋白含量的測定
采用考馬斯亮藍G-250染色法測定發酵過程中可溶性蛋白的含量[18],以牛血清蛋白為標準蛋白制作標準曲線:準確配制0.01 mg/mL、0.02 mg/mL、0.03 mg/mL、0.04 mg/mL、0.05 mg/mL、0.06 mg/mL、0.08 mg/mL、0.1 mg/mL的牛血清蛋白標準溶液,將5 mL考馬斯亮藍G-250染液與上述牛血清蛋白標準溶液充分混合,室溫下反應5 min后,測定其在波長595nm處的吸光度值,每組做三個平行實驗。以牛血清蛋白質量濃度(x)為橫坐標,吸光度值(y)為縱坐標繪制出牛血清蛋白標準曲線。得到標準曲線回歸方程y=6.7960x+0.0119 5(相關系數R2為0.998),根據回歸方程,計算樣品中可溶性蛋白含量。
(4)羽毛降解率的計算

式中:W1為發酵前添加的干羽毛質量,g;W2為發酵后未降解羽毛干燥至恒質量的殘渣質量,g。
1.3.3 不同培養基對羽片降解過程的影響
將10 g/L粉碎的羽片分別加入全培養基、無機鹽培養基和純水培養基中,55℃培養72 h,每間隔12 h取發酵液離心,測定上清液中游離氨基酸總量、酶活、pH和可溶性蛋白含量,并分析發酵過程中羽片降解率的變化。
1.3.4 羽片添加量對角蛋白降解菌發酵性能的影響
將活化好的角蛋白降解菌以5%的接種量分別加入含有10 g/L、50 g/L、100 g/L、150 g/L和200 g/L羽片底物的全培養基中,于55℃條件下培養48 h,測定各發酵液的角蛋白酶酶活和可溶性蛋白含量,以考察羽片底物的添加量對角蛋白降解菌發酵性能的影響。
此外,選取含有100 g/L羽片的全培養基為研究對象,接入5%活化好的角蛋白降解菌,于55℃培養84 h,從24 h開始,每12 h取10 mL發酵液離心,測定上清液中角蛋白酶酶活和可溶性蛋白含量。
1.3.5 數據統計與分析
每組實驗重復操作3次,采用SSPS 18軟件進行數據分析,使用Origin Pro 8.5繪圖,實驗結果以“平均值±標準差”表示,顯著性差異P<0.05。
2 結果與分析
2.1 角蛋白降解菌對羽片的降解
羽片添加量為10 g/L,活化好的角蛋白降解菌接種量為1%,培養基為表1中的I號培養基,發酵條件如1.3.1所述。角蛋白降解菌對羽片的降解過程如圖2所示。
由圖2可知,一根完整的羽片在發酵24 h后,羽枝被完全降解,而羽軸經過48 h才被降解完全,可見,羽軸的降解要比羽枝難一些,主要是因為羽枝和羽軸的本身的化學特性存在一定的差異,而且羽軸的比表面積較羽枝小,因此與角蛋白降解菌的接觸面積更少,從而增大了降解的難度[19]。

圖2 Keratinibaculum paraultunense在全培養基中降解羽片的過程Fig.2 Degradation process of pinna byKeratinibaculum paraultunensein the whole medium
2.2 羽毛不同部位的降解特性
TESFAYE T等[20]對羽軸和羽枝的形態結構和物理性質進行研究,發現羽軸和羽枝屬于一種蛋白纖維,具有低密度、高柔韌和中空蜂窩結構等特性。將培養基中的羽毛底物設置為羽軸、羽枝和羽片,這三者的添加量均為10g/L,活化好的角蛋白降解菌接種量為1%,培養基為表1中I號培養基,發酵條件如1.3.2所述,對羽毛不同部位的降解特性進行研究,結果如圖3所示。羽軸、羽枝和羽片在被K.paraultunense降解時的降解率隨時間的變化如圖3a所示。由圖3a可知,菌株在全培養基中對三者的降解率,羽軸、羽枝和羽片在24 h時就可達到95%,而三者在36 h羽毛的降解率達到98%,與未粉碎的羽片(見圖2,36 h時還殘留較多的羽軸)相比,發酵效率明顯提高。可見,將羽片進行粉碎后,可以在一定的程度上加速羽片的降解,同時,粉碎羽片后,可以減小羽軸和羽枝在降解率上的差距。
角蛋白酶的酶活隨時間的變化結果如圖3b所示。由圖3b可知,從整體上看,發酵過程中角蛋白酶的酶活均呈現先升高后降低的趨勢,0~12 h角蛋白酶酶活升高緩慢,這可能是此階段的角蛋白降解菌處于適應期,從而使得菌株產角蛋白酶較少;在48h時,該菌發酵羽軸、羽枝和羽片所產的角蛋白酶的酶活均達到最高,分別為羽軸5174U/mL、羽枝6 776U/mL和羽片5456U/mL。可見,該菌株不僅對羽片降解率高,所產的角蛋白酶的酶活也可達到較高的水平,是一種能高效降解羽片的微生物[21]。
由圖3c和3d可知,可溶性蛋白含量和游離氨基酸含量隨著發酵時間增加在不斷積累,在24 h時,含量已達到最大,隨著發酵過程的進行,24 h至48 h可溶性蛋白含量基本維持一個穩定值,48 h后可溶性蛋白含量開始逐漸下降,而游離氨基酸總量在24 h后逐漸下降。這可能是因為菌株在24 h時羽片的降解率接近95%,羽片基本被降解完全,而菌株為維持自身生長代謝需要消耗大量的可溶性蛋白和游離氨基酸,可溶性蛋白的分子量較游離氨基酸大,因此游離氨基酸更易、更快被菌體利用[22]。其中,羽軸在全培養基中產生的游離氨基酸總量最多,而產生的可溶性蛋白含量最低,這可能是由于在羽軸作為底物的培養基中,角蛋白降解菌進一步將可溶性蛋白轉化為游離氨基酸。這表明,該菌在發酵羽軸和羽枝產可溶性蛋白和游離氨基酸上是有區別的,而從整體上看,粉碎后的羽片具備羽枝和羽軸的優點。實驗結果表明羽片經過粉碎后,可有效解決羽軸較羽枝難降解這一問題,并且菌株可產生大量的可溶性蛋白和游離氨基酸。
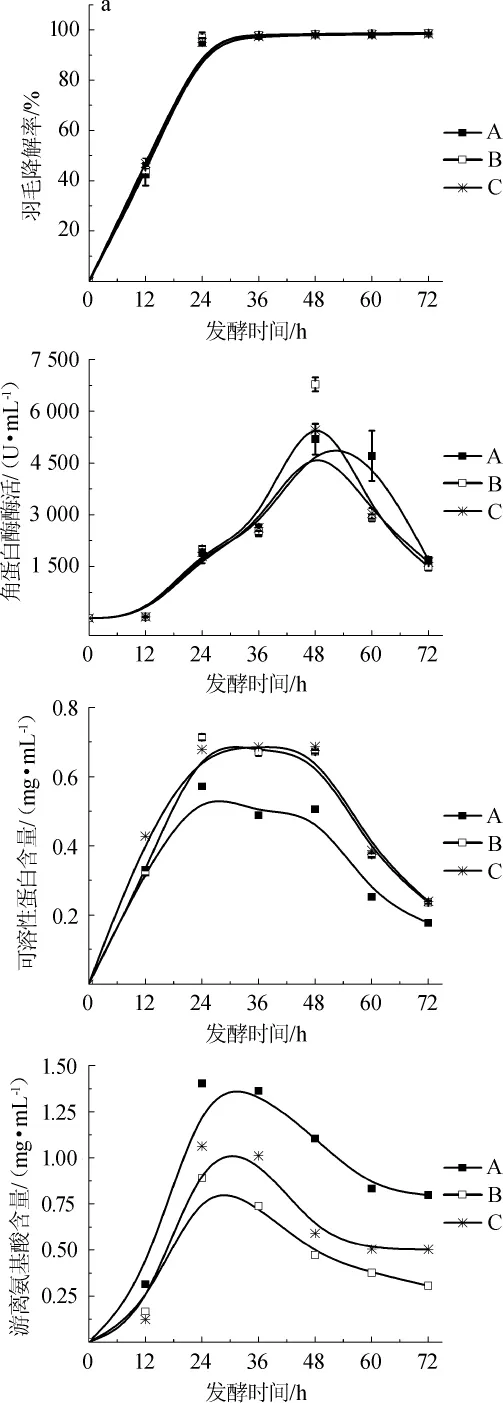
圖3 Keratinibaculum paraultunense在全培養基中對降解羽軸(A)、羽枝(B)和羽片(C)的影響Fig.3 Effect ofKeratinibaculum paraultunenseon the degradation of pinna rachis(A),barbs(B)and pinna(C)over time in the whole medium
2.3 不同培養基對羽片降解過程的影響
采用表1中的I、II和III三種培養基,選定羽片為發酵底物,活化好的角蛋白降解菌接種量為1%,其他發酵條件如1.3.3所述,研究了不同培養基對羽片降解過程的影響,結果如圖4所示。由圖4a可知,培養基I、II和III中的酶活大小有明顯的差別。其中,III為純水培養基,羽片是微生物發酵唯一的碳和氮來源,而整個培養階段III中的酶活保持在50U/mL左右,這進一步表明該菌株是可以產生角蛋白酶的。但是,與I和II培養基相比,培養基III中的角蛋白酶的酶活是最低的,可見純水培養基不利于該菌株產角蛋白酶。與培養基II相比,培養基I中K.paraultunense所產的角蛋白酶的酶活較高,且達到最高酶活時間比II所需時間少,在48 h時,培養基I中K.paraultunense所產的角蛋白酶的酶活可達到最大值5 449 U/mL,而II中前24 h酶活都非常低,這可能是因為培養基II中,只含無機鹽和羽片,因此菌株生長遲緩,需要較長的時間適應外部環境。而培養基I中,除了培養基II所包含的成分外,還添加了L-半胱氨酸鹽酸鹽和尿素這兩種有機氮源,可以促進這株厭氧型角蛋白降解菌快速生長,增強該菌產角蛋白酶的能力,從而提高該菌的發酵效率[25]。該菌株接種在培養基I、II和III的產酶能力的順序是培養基I>II>III。
發酵過程中菌株所產的角蛋白酶的酶活會直接影響羽片降解率[26]。由圖4b可知,自發酵開始至24 h,菌株在培養基I和II中羽片降解率不斷增大,24 h以后基本降解,最終羽片降解率在98%左右。但前24h,培養基I中的羽片降解率比II中的高,很可能是菌株在培養基I中有可直接利用碳源和氮源,所以在培養基I中菌株降解羽片比培養基II更快。而在培養基III中菌株降解羽片的最終降解率非常低,在72 h,只有30%的羽片被降解,這表明這株厭氧菌能在純水做培養基的條件下,產生酶和降解部分羽片,進一步驗證了該菌株具備產角蛋白酶的能力。三種培養基中的羽片降解率由大到小依次為培養基I>II>III。
發酵過程中可溶性蛋白含量和游離氨基酸總量隨發酵時間的延長而變化,結果見圖4c和4d。由圖4c和4d可知,培養基III中的游離氨基酸總量非常少,而I中的游離氨基酸總量在24h達到最大值1.06mg/mL,培養基II中的游離氨基酸總量在48 h達到峰值0.85 mg/mL。由表1可知,培養基II的成本明顯低于I。值得注意的是,雖然培養基I中角蛋白酶的酶活和游離氨基酸的總量整體上要比培養基II中的高,但培養基II中可溶性蛋白達到的最大含量明顯比I中高,在36 h時,培養基II中可溶性蛋白的含量高達0.93 mg/mL,而培養基I中最大可溶性蛋白含量是0.69 mg/mL。這可能是在培養基I中,主要以產角蛋白酶為主,其酶活較高,且培養基I中游離氨基酸含量較高;而在培養基II中,主要是以產可溶性蛋白為主,其可溶性蛋白含量高。可見,降解羽片的過程中,培養基的種類對該菌的發酵性能影響較大,全培養基更適合產角蛋白酶,而無機鹽培養基更有利于得到高濃度的可溶性蛋白。

圖4 在不同種類的培養基對廢棄羽片降解過程的影響Fig.4 Effect of different medium on degradation process of waste feathers
2.4 羽片添加量對角蛋白降解菌發酵性能的影響
基于以上的研究,可以發現該菌株具有高效降解羽片的能力。因此本文考察了羽片底物的添加量對角蛋白降解菌發酵性能的影響。當羽片添加量為10 g/L,活化好的菌液添加量為1%,選擇表1中的I號培養基,其他發酵條件如1.3.4所述,結果如圖5所示。

圖5 Keratinibaculum paraultunense在全培養基中發酵48 h時羽片添加量對角蛋白酶酶活和可溶性蛋白含量的影響Fig.5 Effect of feathers addition on keratinase activity and soluble protein contents byKeratinibaculum paraultunense fermented for 48 h in the whole medium
由圖5可知,角蛋白酶的相對酶活力和可溶性蛋白含量隨羽片底物質量濃度在0~200 g/L范圍內的增加而先增大后降低。其中當羽片添加量為50 g/L,酶活達到最大,為11 520 U/mL;而當羽片添加量為100 g/L,可溶性蛋白含量達到最高為1.58 mg/mL。而當羽片底物添加量過高時,角蛋白酶的酶活和可溶性蛋白的含量反而降低。這可能是因為培養基中羽片濃度過高,會使得發酵液變得黏稠,影響微生物與營養物質之間的傳質過程,從而影響角蛋白酶和可溶性蛋白的生成。
當羽片添加量為100 g/L時,角蛋白酶酶活和可溶性蛋白含量隨發酵時間的變化如圖6所示。
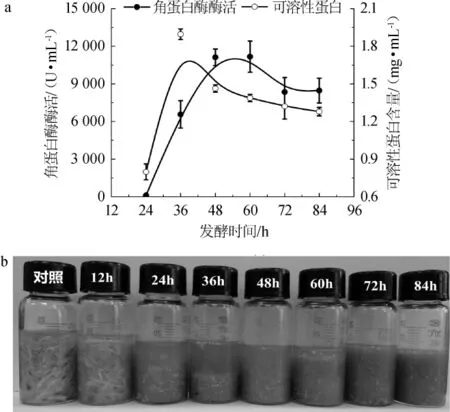
圖6 Keratinibaculum paraultunense在全培養基中發酵84 h時角蛋白酶酶活和可溶性蛋白含量(a)及降解羽片的過程(b)Fig.6 Keratinase activity and soluble protein content(a),the degradation process of feathers(b)byKeratinibaculum paraultunensefermented for 84 h in the whole medium
由圖6a可知,發酵48 h得到最大酶活為11 179 U/mL,而發酵36h得到最大可溶性蛋白含量為1.83mg/mL。與圖4a和4b相比,發現羽片的添加量和菌種接種量提高到100 g/L和5%時,菌株所產角蛋白酶的酶活和產可溶性蛋白的濃度都提高了兩倍左右。可見,該菌可以利用高濃度的羽片廢棄物,并產生大量的可溶性蛋白和角蛋白酶。此外,不同發酵時間段的羽片降解情況如圖6b所示。由圖6b可知,即使在羽片濃度較高的條件下,該菌株仍然可以對其高效降解,這表明該菌株可以達到較大的發酵負荷。
3 結論
角蛋白降解菌(Keratinibaculum paraultunense)在厭氧條件下通過微生物發酵對廢棄羽片的不同部位進行了降解分析,研究發現,羽軸比羽枝更難被降解,羽軸經粉碎后,降解效果較好。采用無機鹽培養基發酵時,主要降解產物是可溶性蛋白,含量可達0.93 mg/mL。采用全培養基發酵時,主要發酵產物是角蛋白酶和游離氨基酸,當羽片底物量提高到100 g/L,角蛋白酶的酶活高達11 179 U/mL。角蛋白降解菌能快速高效地降解高濃度的廢棄羽片,可生產大量的可溶性蛋白和高活力的角蛋白酶。本研究具有較好的應用前景。可溶性蛋白和游離氨基酸可豐富飼料營養,同時可溶性蛋白作為填充劑應用到皮革,能賦予皮革較好的柔軟性和豐滿性,而高活力的角蛋白酶可應用到皮革脫毛以及醫藥等行業。

