PGAM1通過激活Warburg效應調控宮頸癌細胞惡性生物學行為的機制研究
傅柳陶,王青元,衛 兵,王文艷
在我國,宮頸癌是致死率較高的婦科惡性腫瘤之一[1]。由于宮頸癌起病隱匿,早期缺乏典型的臨床癥狀,加之惡性化程度高,進展迅速,大部分患者確診時已至中晚期,從而錯過了手術的最佳時機,因此中晚期患者的復發和轉移率一直居高不下[2-3]。因此實現對于宮頸癌患者的早診斷、早治療是降低患者死亡率的關鍵。腫瘤細胞因線粒體功能缺陷導致糖代謝異常被公認為是腫瘤細胞的重要特征之一[4]。但是有氧糖酵解途徑的發生機制和調控方式一直未有明確研究。磷酸甘油酸變位酶1(phosphoglycerate mutase1,PGAM1)作為糖酵解途徑中的關鍵酶,可催化3-磷酸甘油生成2-磷酸甘油,并且有研究[5]證實,PGAM1是唯一受抑癌基因P53調控的糖酵解相關酶。該研究首先通過免疫組化法探討PGAM1在宮頸癌組織中的表達情況,并通過機制研究進一步分析PGAM1在腫瘤細胞糖酵解及發生發展中的作用,從而為臨床治療和藥物研發提供新的靶點。
1 材料與方法
1.1病例資料收集2016年7月~2017年10月在安徽醫科大學第二附屬醫院行手術切除的67例宮頸癌患者的新鮮宮頸癌組織(排除腫瘤壞死區)及配對的癌旁正常組織(距離腫瘤邊緣>3 cm),將一部分組織標本立即置于液氮中,然后轉移至-80 ℃ 保存以備RNA和蛋白提取用;另一部分組織標本經石蠟包埋,以進行免疫組織化學染色用。患者年齡30~65(47.50±2.46)歲。納入標準:由兩名以上經驗豐富的病理科醫師對組織切片進行閱片并同時確診;所有患者術前未接受過放療、化療或其他輔助治療。
1.2受試細胞人宮頸癌細胞株Hela以及HEK293T細胞均購自美國Type Culture Collection公司。
1.3主要試劑胎牛血清(FBS)、RPMI1640培養基、DMEM高糖培養基、胰蛋白酶-EDTA細胞消化液(0.25%)(美國GIBCO公司);MTT(美國Sigma公司);青霉素和鏈霉素(山東醫藥股份有限公司);二甲基亞砜(DMSO)(江西省江藍純生物試劑有限公司);S-P免疫組化試劑盒、DAB顯色試劑盒(北京中杉金橋生物技術有限公司);PGAM1抗體、辣根酶標記的二抗(美國Abcam公司);TRIzol總RNA提取試劑盒、細胞轉染試劑 LipofectamineTM2000、Opti-MEM(美國Invitrogen公司);Taqman? RNA reverse transcription kit、Taqman? RNA assay kit(日本Takara公司);cDNA合成試劑盒(美國OMEGA公司);SYBR Green PCR Mix、M-MuLV逆轉錄酶(美國ABI公司)。PCR引物以及siRNA干擾靶序列由上海生工生物工程有限公司合成并提供。
1.4主要儀器HERcell1501型CO2細胞培養箱和超凈工作臺(美國Thermo Scientific公司);Eppendorf 5427 R臺式高速冷凍離心機以及各種型號的移液器(德國 Eppendorf公司);實時定量PCR儀、iMake多功能酶標儀、SDS-PAGE電泳儀和電轉膜儀(美國Bio-Rad公司);CX41倒置光學顯微鏡(日本OLYMPUS公司);Amersham電泳儀(瑞典Bioscience公司);LAS-4000min凝膠成像數碼分析系統(日本FujiFilm公司)。
1.5方法
1.5.1免疫組化 取石蠟包埋組織進行切片(1~2 μm)后行免疫組織化學染色,嚴格按照SP試劑盒說明書進行操作。隨機選擇10個視野,觀察PGAM1在不同組織中的染色強度以及陽性細胞的百分比。PGAM1呈細胞質棕黃色染色。結果判定標準為觀察細胞染色強度:0分(陰性),1分(弱染色),2分(中度染色),3分(強染色),然后計算10個視野的平均染色分值。同時觀察視野中染色細胞的百分比:0分(陽性率為0),1分(陽性率≤25%),2分(陽性率25%~50%),3分(陽性率50%~75%),4分(陽性率>75%)。染色指數(labeling index,LI)=陽性細胞率×染色強度,LI≤6分為低表達或不表達,LI>6分為高表達。
1.5.2細胞培養 將細胞培養在含有10%FBS的完全RPMI 1640培養基中,將細胞置于37 ℃、5% CO2細胞培養箱中進行培養。24~48 h更換培養液,48 h傳代1次。
1.5.3構建PGAM1基因沉默穩轉細胞株 ① 構建慢病毒干擾載體:從GenBank 中獲得編碼人PGAM1基因(NM-003483)的序列;選擇pGMLV-GFP RNAi慢病毒載體,構建慢病毒重組質粒,并轉染至感受態細胞DH5α中。采用質粒抽提試劑盒提取慢病毒重組質粒和包裝質粒,并轉染至293T細胞中,測定慢病毒滴度。② PGAM1基因沉默穩定細胞系的建立:提前1 d在相應備行轉染的6孔板上接種5×105個細胞,培養24 h后,待融合率達到 50%~60%時,按照脂質體轉染說明書,將PGAM1 shRNA或shRNA-NC治療轉染至細胞,置于37 ℃、5% CO2細胞培養箱中培養24~48 h。提取細胞RNA及蛋白,驗證目的基因表達情況及轉染效率。
1.5.4MTT法檢測細胞增殖 將各組細胞(1×104個/孔)單層接種至96孔板中正常培養,每組設置8個平行孔,分別培養24、48、72、96 h后,加入20 μl MTT,置于37 ℃、5% CO2細胞培養箱中孵育4 h后,棄除上清液,每孔加入200 μl DMSO,使紫色結晶物充分溶解。將96孔板放置于酶標儀卡槽上,檢測波長為570 nm,參比波長為450 nm處的吸光度值(OD值),計算平均值。
1.5.5流式細胞術檢測細胞凋亡 收集細胞,采用預冷的PBS洗滌3次后,離心,棄上清液;加入500 μl Binding Buffer重懸,細胞數量約為1×104個/100 μl;加入Annexin V 5 μl,避光孵育15 min;離心,棄上清液;加入500 μl Binding Buffer重懸;加入PE 5 μl,避光孵育15 min;離心,棄上清液;加入300 μl結合緩沖液;上機檢測。所有操作嚴格按照試劑盒說明書操作進行。采用流式細胞儀(Ex=488 nm,Em=530 nm)檢測細胞凋亡情況。
1.5.6熒光定量實時PCR(quantitative realtime PCR,qRT-PCR) ① 總RNA提取:采用分光光度計檢測RNA濃度。② RNA逆轉錄為cDNA:根據試劑盒說明書操作進行。將cDNA保存至-20 ℃保存備用。③ qRT-PCR:根據NCBI數據庫資料設計引物序列,以細胞或組織cDNA為模板,以β-actin作為內參。PCR結果判斷:根據使用說明調整基線,將閾值設定在熒光值對數圖的線性部分,從軟件中讀取Ct值。
1.5.7Western blot實驗 提取蛋白樣品,蛋白樣品凝膠電泳,轉膜,封閉,加入一抗(按照一抗說明書,將100 μl NGS加入10 ml Western一抗稀釋液中混勻)孵育,室溫下震蕩搖床搖動2 h;加入二抗[參考二抗說明書,將Western二抗稀釋液(P0023D) 100 μl加入辣根過氧化物酶(HRP)標記的二抗10 ml中混勻]孵育,室溫下震蕩搖床搖動2 h,顯影,采用FluorChem FC3凝膠成像數碼分析系統進行定量分析,以積分光密度(IOD)表示灰度值。
1.5.8細胞葡萄糖消耗和乳酸生成檢測 按照韓文祺 等[6]描述的實驗步驟進行。每個樣品重復測量3次,取平均值。
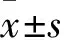
2 結果
2.1不同組織中PGAM1的表達情況免疫組化結果顯示,宮頸癌組織中PGAM1高表達率為58.21%,明顯高于癌旁組織(P<0.05)。見表1。

表1 不同組織中PGAM1的表達情況[n(%)]
2.2兩組患者一般臨床資料比較不同臨床分期、分化程度、浸潤深度的患者PGAM1的高表達率差異有統計學意義(P<0.05),其他臨床資料基本一致,差異無統計學意義(P>0.05)。提示PGAM1高表達可能與宮頸癌發生、侵襲、分化等密切相關。見表2。

表2 宮頸癌患者臨床病理資料與PGAM1表達的關系[n(%)]
2.3PGAM1對Hela細胞增殖活性的影響經MTT法檢測,Hela細胞shPGAM1基因沉默后,與NC組比較,細胞增殖活性明顯受到抑制,經重復測量方差分析,差異有統計學意義(F=98.766,P<0.05)。見圖1。
2.4PGAM1對Hela細胞凋亡活性的影響細胞培養48 h后,經流式細胞術檢測,Hela細胞shPGAM1基因沉默后,與NC組比較,細胞凋亡率明顯增加,差異有統計學意義(t=9.706,P<0.05)。見圖2。
2.5PGAM1對Hela細胞葡萄糖消耗和乳酸產量的影響細胞培養48 h后,取上清液,檢測細胞上清液中葡萄糖含量和乳酸含量,結果顯示,Hela細胞shPGAM1基因沉默后,與NC組比較,葡萄糖消耗和乳酸產量均明顯降低,差異有統計學意義(t=16.060、15.926,P<0.05)。見圖3。

圖1 MTT法檢測PGAM1對Hela細胞增殖的影響與NC組比較:*P<0.05

圖2 流式細胞術檢測PGAM1對Hela細胞凋亡的影響與NC組比較:*P<0.05
2.6PGAM1基因沉默對Hela細胞糖代謝相關基因和蛋白表達的影響磷酸酯酶與張力蛋白同源物(phosphatase and tensin homolog,PTEN)、磷酸化絲氨酸-蘇氨酸蛋白激酶(phosphorylation auto-ja kuljetusalan,p-Akt)、哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)都屬于Akt/mTOR信號通路中的關鍵分子。通過qRT-PCR法和Western blot法證實,Hela細胞shPGAM1基因沉默后,與NC組比較,PTEN mRNA和蛋白相對表達量明顯上調,而p-Akt、p-mTOR mRNA和蛋白相對表達量明顯降低,差異有統計學意義(P<0.05)。見圖4。
3 討論
在前期研究中,通過高通量基因芯片技術篩選了與正常宮頸黏膜組織存在表達差異的宮頸癌組織基因譜,其中PGAM1基因的表達量明顯上調,與以往關于乳腺癌、腎癌、肺癌等組織的研究[7-9]結果基本一致。說明PGAM1可能參與了腫瘤細胞的惡性生物學行為調控。

圖3 PGAM1對Hela細胞葡萄糖消耗和乳酸產量的影響與NC組比較:*P<0.05

圖4 qRT-PCR法和Western blot法檢測PGAM1對Hela細胞PTEN、p-Akt、p-mTOR基因和蛋白表達的影響與NC組比較:*P<0.05
PGAM1是最初在腦組織中發現的PGAM家族成員之一,定位于人染色體10q25.3區域,包括PGAM1和PGAM2兩個同源二聚體,既往有研究已經證實PGAM1是參與細胞有氧糖酵解途徑的重要酶之一,可以將3-磷酸甘油酸3位上的磷酸基移位生成2-磷酸甘油酸,從而生成磷酸烯醇式丙酮酸[10]。糖酵解方式是腫瘤細胞在有氧條件下獲取能量的主要途徑,因此腫瘤細胞葡萄糖消耗量、糖酵解速率以及乳酸生成量均較正常細胞明顯增加,這一現象被稱為“Warburg效應”。但是在后來很長一段時間,大多數學者認為Warburg效應與腫瘤細胞的惡性生物學行為關系不明顯[11]。近幾年,隨著對腫瘤發生機制的深入發展,Warburg效應重新進入人們的視線,逐漸成為腫瘤領域的研究熱點,干擾高糖代謝可能成為抗腫瘤治療的新策略。本研究首先通過免疫組化法探討宮頸癌組織和癌旁組織中PGAM1表達的差異以及與患者臨床病理特征的關系,結果顯示,在癌組織中,PGAM1高表達率明顯高于癌旁正常黏膜者,并且與患者的臨床分期、分化程度、浸潤深度相關,提示PGAM1可能參與腫瘤細胞的增殖、侵襲、分化、凋亡等惡性生物學過程。因此PGAM1有可能作為宮頸癌潛在的治療靶標。
目前研究證實,腫瘤細胞的糖代謝需求顯著高于正常細胞。這一特點使得腫瘤細胞葡萄糖消耗量和乳酸生成量大大增加,以滿足細胞的增殖需求[12]。因此本文探討PGAM1與宮頸癌發生發展的關系,首先從影響腫瘤細胞的增殖和凋亡著手,進一步分析PGAM1基因的生物學功能。結果顯示,PGAM1基因敲除后,Hela細胞凋亡率均明顯增加,增殖活性受到明顯抑制,從而證實PGAM1參與調控腫瘤細胞的增殖和凋亡過程。另外,前期研究通過高通量基因芯片技術分析表明Akt/mTOR信號通路可能是PGAM1下游靶通路。而Akt/mTOR信號通路已經被公認為是控制腫瘤細胞惡性生物學行為、能量代謝等過程的重要途徑,與Warburg效應密切相關。本研究通過qRT-PCR法和Western blot法初步證實了PGAM1對Akt/mTOR信號通路的調控影響,結果顯示,Hela細胞shPGAM1基因沉默后,PTEN表達量明顯上調,而p-Akt、p-mTOR mRNA和蛋白相對表達量明顯降低。Akt是一種高度保守的絲氨酸/蘇氨酸蛋白激酶,通過磷酸化被激活后移位至胞質或胞核中,參與調控下游靶蛋白mTOR的表達。而PTEN是Akt/mTOR信號通路的負性調控蛋白,具有抑癌基因活性,可抑制腫瘤細胞增殖,并促使其凋亡。

