桑腸桿菌菌株的富硒特性及其噴施對玉米籽粒的硒素強化
喬 虹,尹佳茗,姜 峰,袁紅莉,譚偉明
?
桑腸桿菌菌株的富硒特性及其噴施對玉米籽粒的硒素強化
喬 虹1,尹佳茗1,姜 峰1,袁紅莉2,譚偉明1※
(1. 中國農業大學農學院,北京 100093;2.中國農業大學生物學院,北京 100093)
硒是人體必需微量元素之一,對新陳代謝過程有十分重要的促進作用,通過生物強化措施可以增加人體對硒素的補充。該研究利用從植物內生菌中篩選出的一株具有將無機硒轉化成生物利用率更高的有機硒的菌株IX+2 2,測定其16S rRNA基因序列,鑒定該菌株為桑腸桿菌 ()。該文研究不同的硒含量、加硒時間與不同培養收集時間對菌株IX+2 2硒素轉化率的影響。結果表明,培養基中硒含量越高,菌株IX+2 2胞內有機硒含量越高,硒素轉化率越高,但達到某一個峰值后又開始下降;在對數生長期加硒有利于菌株IX+2 2的生長和對無機硒的轉化;菌株培養24 h時收集硒素轉化效果最好,繼續培養菌體生長減弱。同時針對菌株對玉米籽粒富硒的強化效應做了進一步驗證。該菌株對玉米籽粒富硒的強化作用表明:同等亞硒酸鈉用量條件下,亞硒酸鈉噴施處理后玉米籽粒中硒含量達到228.58g/kg,而富硒微生物菌劑處理后籽粒中硒含量達到378.89g/kg,是前者的1.66倍,富硒IX+2 2菌劑的富硒效果優于噴施亞硒酸鈉溶液。該研究結果可為玉米籽粒的硒素強化提供理論支撐。
菌;硒;作物;菌株鑒定;富硒特性;硒素強化效應
0 引 言
硒是人類,動物和微生物的重要微量元素。在人體內主要以有機硒的形式存在,包括硒代氨基酸、硒蛋白、甲基硒、硒多糖、核酸硒等多種形式[1-2]。體內的有機硒能夠清除自由基、抗氧化、增強人體免疫力及抗癌等作用[3-7]。人體自身無法合成硒,必須通過飲食從外部攝入,然而我國超過72%的地區缺硒嚴重,主要作物中的含硒量無法滿足人類對硒的參考攝入量[8]。因此,富硒食品受到了廣泛的關注[9]。
硒在動植物體內的抗氧化反應中有重要的作用[10]。在適當濃度下,硒可以改善抗氧化酶的活性,如過氧化氫酶,超氧化物歧化酶和過氧化物酶等,從而減輕植物葉綠體中的氧化應激反應[11-14]。另外,作物可以利用硒肥促進其生長。外源施硒能促進多種植物的光合色素含量,如:高粱、大麥、酢漿草和萵苣等[15-18]。同時,增施硒肥能有效促進小麥、馬鈴薯等作物產量的增加[19-20]。
在農業生產中,通過土壤施硒、硒拌種、葉面噴施硒肥等方法是改善作物中硒含量的解決方案之一[21]。土壤施硒肥不易操作,易過量而導致環境污染;硒拌種與葉面噴施硒肥更簡單實用。然而,無機硒具有高毒性,吸收后容易在人體內積累[22]。另一方面微生物與硒的生化循環有著重要的聯系,微生物能夠改變硒的存在形式、增加硒的揮發作用、維持硒的循環。因此,利用微生物將毒性大的無機硒轉化為生物利用率更高的有機硒,是安全且高效的生物富硒途徑,也受到了國內外學者的普遍重視。徐巧林等[23]對微生物富硒現狀研究表明細菌對硒元素有較強的富集作用,可將無機硒轉化為有機硒。徐春蘭[24]對產硒多糖菌種篩選和鑒定發現,Z0206菌株隨著培養基中無機硒濃度的增加,菌體逐漸變紅,經鑒定為腸桿菌屬。Pieniz等[25]對腸球菌轉化無機硒的功能進行了分析,隨著培養基中無機硒濃度的增加,硒的生物富集增加并且在24 h后達到了240 mg/L。劉波[26]對富硒納豆芽孢桿菌的選育試驗得出,利用納豆芽孢桿菌將無機硒轉化為有機硒后,進行富硒納豆的發酵,有助于人體對硒的攝取。宋照軍[27]對乳酸菌富硒技術進行了初步研究,通過探討多種乳酸菌富硒能力,以尋求獲得富硒能力優良的乳酸菌菌株和富硒條件,以進一步研究開發富硒活性乳酸菌功能食品,維持人類健康。本研究利用從植物內生菌中分離篩選得到的一株具有將無機硒轉化成有機硒的菌株IX+2 2,探究培養基中硒含量、亞硒酸鈉添加時間、培養時間等因素對其硒素轉化效率的影響,并就菌株對玉米籽粒富硒強化效應做了進一步的驗證,為建立安全、高效的富硒谷物生產技術提供依據,具備廣泛的實用性。
1 材料與方法
1.1 供試菌株與材料
供試菌株:桑腸桿菌IX+2 2,菌株培養于牛肉膏蛋白胨固體培養基中。
供試玉米品種:鄭單958,于中國農業大學吳橋實驗站(37°41′N,116°37′E)進行田間試驗。實驗站土壤硒含量為54.14g/kg,屬于貧硒土壤。
菌株種子液的制備:將活化的菌株IX+2 2挑取單菌落接種于已滅菌100 mL牛肉膏蛋白胨液體培養基中,于28 ℃、160 r/min振蕩培養24 h備用。
亞硒酸鈉母液的制備:將亞硒酸鈉配制成100 g/L的溶液后過已滅菌0.22m膜,4 ℃保存備用。
1.2 富硒菌株的篩選及鑒定
1.2.1 富硒菌株的篩選
從植物材料中分離到有硒素轉化能力的內生菌株;經復篩后,IX+2 2菌株對無機硒有明顯的轉化作用,確定該菌株為下一步試驗菌株。
1.2.2 富硒菌株的16S rRNA基因序列分析及系統發育樹構建
細菌總DNA制備采用水煮法[28]:用無菌槍頭挑取少量單菌落菌體重懸于20L無菌ddH2O中,100 ℃水浴10 min,立即于冰上靜置,之后于4 ℃、12 000 r/min條件下離心5 min,置于冰上,取1L上清液作為DNA模板。陰性對照以同體積無菌ddH2O為模板,在相同條件下進行PCR擴增。PCR擴增采用的引物為通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-TACCTTGTTACGACTT-3′。
16S rRNA基因的PCR擴增程序為:94 ℃預變性5 min;94 ℃變性45 s、58 ℃復性45 s、72 ℃延伸2 min,30個循環;72 ℃末端延伸10 min,擴增結束后,對PCR產物進行瓊脂糖凝膠電泳。由北京華大怡和生物科技有限公司進行序列測定,將獲得的測序結果在GenBank上進行BLAST比對分析,并利用PHYLIP鄰位相連法構建系統發育樹。
1.2.3 IX+2 2菌株的富硒能力
將1 mL菌株種子液加入亞硒酸鈉濃度分別為0、40、90、120、200、300、400g/L的牛肉膏蛋白胨液體培養基中,28 ℃振蕩培養24 h,收集菌體,檢測胞內有機硒含量。以不含硒的培養基為對照。
1.3 樣品硒含量的測定
IX+2 2菌體細胞內總硒含量測定:將收集的IX+2 2菌體破碎后加入10 mL高氯酸與硝酸的混合酸(體積分數1:4),冷消化一定時間后再于電熱板上加熱,直至液體體積剩余2 mL,冷卻,加入5 mL鹽酸,繼續加熱至溶液變清亮,冷卻,將其定容至50 mL容量瓶中,充分震蕩混勻。利用AFS-920雙道原子熒光光度計以及100 mg/L亞硒酸鈉標準溶液逐級稀釋的標準曲線,計算總硒含量。
無機硒含量測定參照GB1903.21-2016:將收集的IX+2 2菌體破碎后,置于50 mL容量瓶中,加水定容后搖勻。將定容后的溶液5 000 r/min離心10 min,吸取10 mL試樣消化液,加入鹽酸2 mL、鐵氰化鉀溶液1 mL,混勻。利用AFS-920雙道原子熒光光度計,測定菌體胞內無機硒含量。
有機硒含量利用差減法,計算出菌株胞內有機硒的含量。
有機硒含量=總硒含量-無機硒含量 (1)
1.4 菌株IX+2 2硒素轉化率影響因素分析
1.4.1 培養基中硒含量對硒素轉化率的影響
將1 mL IX+2 2菌株種子液接入到硒含量分別為0、20、30、45、60、75、100、150、200、250g/L的牛肉膏蛋白胨液體培養基中,在28 ℃,160 r/min振蕩培養24 h,測定培養液OD600,離心收集菌體,檢測胞內有機硒含量每個處理設3個重復,計算平均值,研究硒含量對硒素轉化率的影響。
1.4.2 亞硒酸鈉添加時間對硒素轉化率的影響
將1 mL IX+2 2種子液接入牛肉膏蛋白胨液體培養基中,分別在菌體培養0、3、6、9、12 h加入一定量的亞硒酸鈉母液,使培養基中硒含量為75g/L,于28 ℃、160 r/min振蕩培養24 h后,測定培養液OD600,離心收集菌體,檢測胞內有機硒含量。
1.4.3 培養時間對硒素轉化率的影響
將1 mL IX+2 2菌株種子液接入硒含量為75g/L的牛肉膏蛋白胨液體培養基中,分別在培養12、24、36、48 h時收集菌體,測定培養液OD600,離心收集菌體,檢測胞內有機硒含量。
1.5 IX+2 2對玉米富硒的強化效應研究
于中國農業大學吳橋實驗站進行。播種時間為2014年5月1日,收獲時間為2014年9月29日。具體試驗步驟如下:
施用方法:將IX+2 2菌株種子液接入亞硒酸鈉濃度為400g/L的牛肉膏蛋白胨液體培養基中,于28 ℃,160 r/min震蕩培養24 h后,制備成IX+2 2菌株菌劑,于玉米拔節期葉面噴施。硒礦粉于播種前施入土壤中。亞硒酸鈉配制成溶液后,于玉米拔節期葉面噴施。
試驗設計:在總結前人研究的基礎上,田間試驗設5個處理,分別為CK;A1:硒礦粉75 g/m2;B1:亞硒酸鈉10 mg/m2;C1:富硒IX+2 2菌劑3.3 mg/m2(培養基中亞硒酸鈉用量5 mg);C2:富硒IX+2 2菌劑10 mg/m2(培養基中亞硒酸鈉用量10 mg)。采用完全隨機區組設計,每個處理小區15 m2,重復4次,每小區噴施500 mL。玉米成熟后,取風干籽粒磨碎成粉末,按照1.3節測定籽粒硒含量。
2 結果與分析
2.1 IX+2 2菌株鑒定
對IX+2 2菌株16S rRNA基因PCR擴增產物進行瓊脂糖凝膠電泳檢測,結果顯示陰性對照未出現任何條帶,表明整個PCR操作過程中未有外源DNA污染(圖1)。

圖1 菌株IX+2 2 16S rRNA基因PCR擴增瓊脂糖凝膠電泳圖
16S rRNA基因PCR擴增的片段長度為1 500 bp,在GenBank數據庫的BLAST比對結果顯示,其與菌株桑腸桿菌(GL890774)的16S rRNA基因序列同源性達99.45%。對測得的基因型序列進行系統發育分析(圖2)。發現,菌株IX+2 2與腸桿菌屬()聚到了一個簇,親緣關系相近。確定菌株為腸桿菌屬()。表1為IX+2 2菌株16S rRNA基因片段BLAST比對結果。

圖2 菌株IX+2 2 16S rRNA基因的系統發育樹

表1 IX+2 2菌株16S rRNA基因片段BLAST比對結果
2.2 菌株IX+2 2富硒能力研究
將菌株種子液加到不同亞硒酸鈉濃度的牛肉膏蛋白胨液體培養基中培養24 h后,對菌株的生長量和胞內硒含量進行測定后發現(圖3),菌株IX+2 2富硒能力隨亞硒酸鈉濃度的增加呈上升趨勢,在硒濃度低于120g/L時,菌體胞內有機硒含量緩慢上升到17.8g/L,隨后亞硒酸鈉濃度增加,菌體胞內有機硒含量迅速增加;在亞硒酸鈉濃度為400g/L時,胞內有機硒含量達到最大值141.68g/L。菌株在亞硒酸鈉濃度0~400g/L的條件下均可生長,表明該菌株耐硒能力較強。
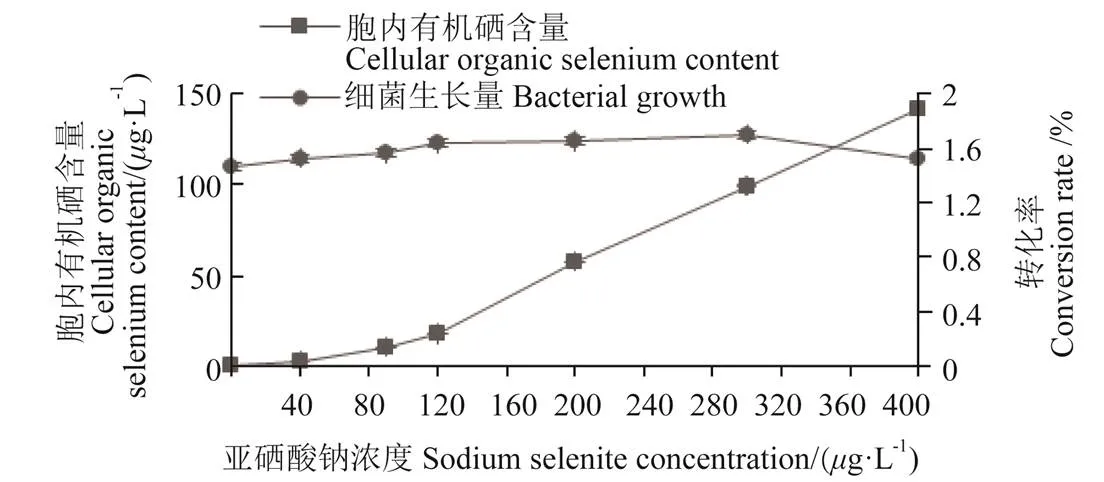
注:轉化率為有機硒轉化率,下同。
2.3 菌株IX+2 2硒素轉化率影響因素探究
2.3.1 培養基中硒含量對硒素轉化率的影響
將1 mL IX+2 2種子液接入到不同硒含量的牛肉膏蛋白胨液體培養基中培養24 h后,對菌株IX+2 2的生長量、胞內硒含量進行測定并計算有機硒轉化率(表2)發現,菌株IX+2 2在硒含量為250/L時仍可生長;隨著培養基中硒含量的增加,胞內有機硒含量逐漸增加,但是有機硒轉化率呈現先升高后降低的趨勢。在硒含量為200/L時,轉化率最高,達到70.84%(<0.05)。當硒含量為250g/L時,菌株細胞內有機硒含量達到最大值,為163.45g/L(<0.05),但菌株生長明顯受到抑制,轉化率也隨之降低,說明培養基中硒含量在適宜范圍才會表現較高硒素轉化能力[29]。
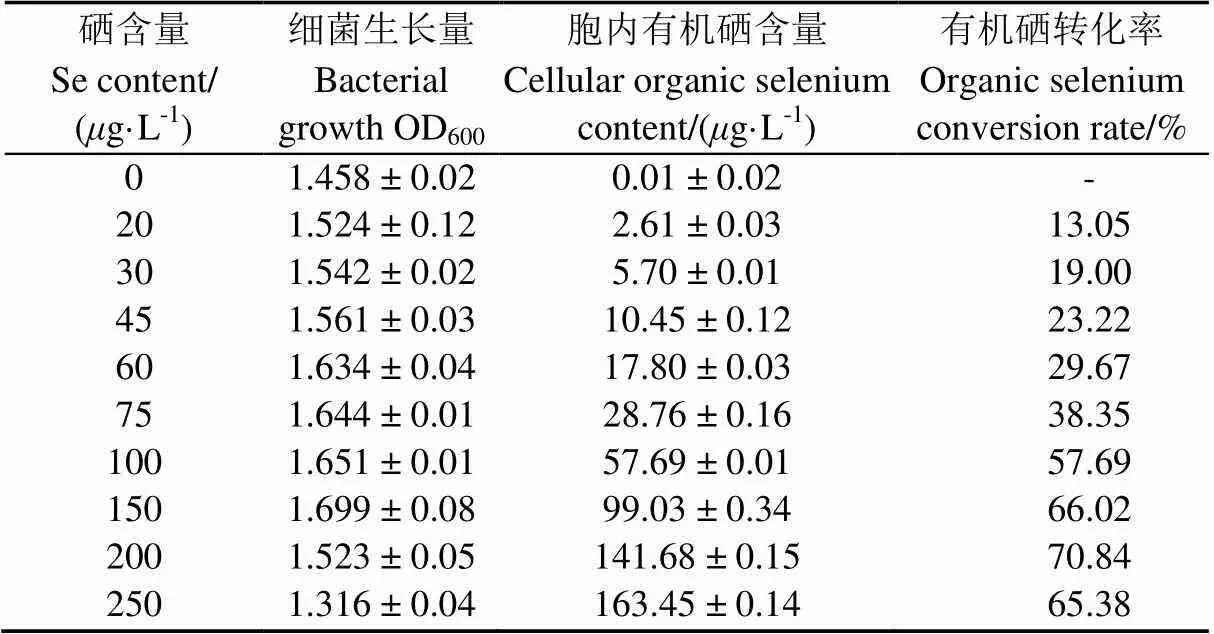
表2 硒含量對菌體富硒效果的影響
注:硒素轉化率=胞內有機硒含量/培養基中硒含量×100%
Notes: Organic selenium conversion=cellular organic selenium content/selenium content in the medium ×100%
2.3.2 亞硒酸鈉添加時間對硒素轉化率的影響
在本研究中,亞硒酸鈉添加時間可以影響菌株的硒素轉化率,分別在菌體培養0、3、6、9、12 h添加亞硒酸鈉,使培養基的硒含量為75g/L,培養24 h后,菌株IX+2 2的生長量和胞內有機硒含量見圖4,在0~12 h時間范圍內亞硒酸鈉添加時間對菌株IX+2 2的生長情況影響較小,但是菌株的富硒效率隨添加時間呈先上升后下降趨勢,在菌株培養3 h時添加亞硒酸鈉,菌株胞內有機硒含量迅速上升到49.93g/L,硒素轉化率達到最高值66.57%。此后隨著培養時間增加,菌體胞內有機硒含量逐漸減少,硒素轉化率也逐漸降低至40.20%。
菌株硒素轉化率以培養3 h時添加亞硒酸鈉最高,可能是由于此時菌株生長處于對數期,菌體生長旺盛[30]。
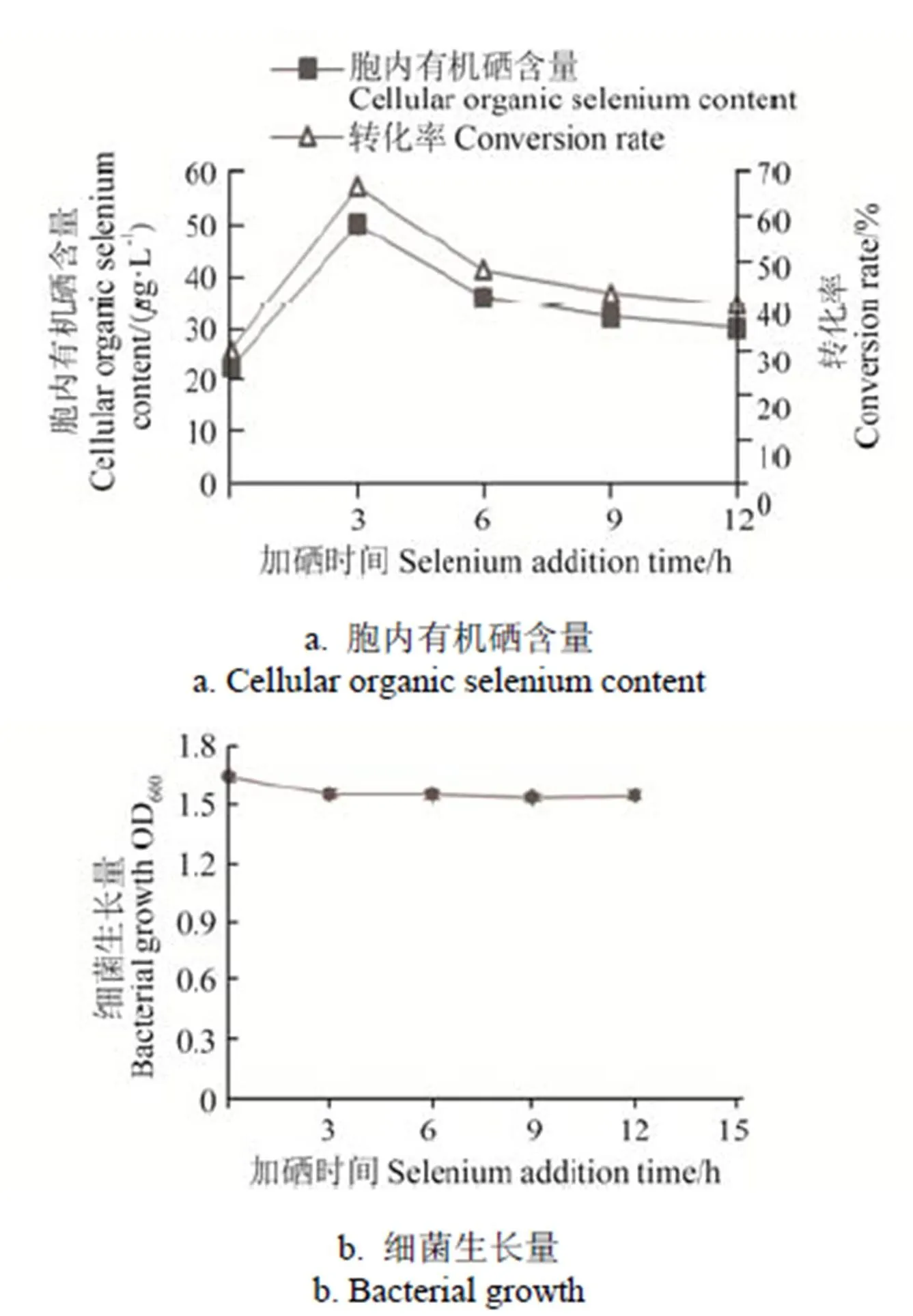
圖4 亞硒酸鈉添加時間對IX+2 2菌株富硒效率的影響
2.3.3 培養時間對硒素轉化率的影響
在培養12、24、36、48 h時收集菌體,菌株IX+2 2的生長量和胞內有機硒含量見圖5。由圖5可知,菌株IX+2 2隨著培養時間的增加,硒轉化率先升高后降低,在培養24 h時轉化效率最高,為72.10%,隨著培養時間增加,菌體生長減弱及部分菌體自溶,轉化效率也隨之下降。
2.4 IX+2 2對玉米籽粒富硒的強化效應研究
對比硒礦粉、亞硒酸鈉和富硒IX+2 2菌劑不同硒源處理對玉米籽粒富硒效果的影響見圖6。由圖6可知,以富硒IX+2 2菌劑作為硒源時,玉米籽粒中硒含量最高,為378.89g/kg,達到富硒谷物的標準。從富硒效率看,硒礦粉富硒效率最低,富硒IX+2 2菌劑富硒效率最高。同等施加量下,噴施亞硒酸鈉玉米籽粒中硒含量為228.58g/kg,與噴施低濃度IX+2 2菌劑富硒效果差異不顯著,富硒IX+2 2菌劑為硒源比普通噴施硒含量高1.66倍。
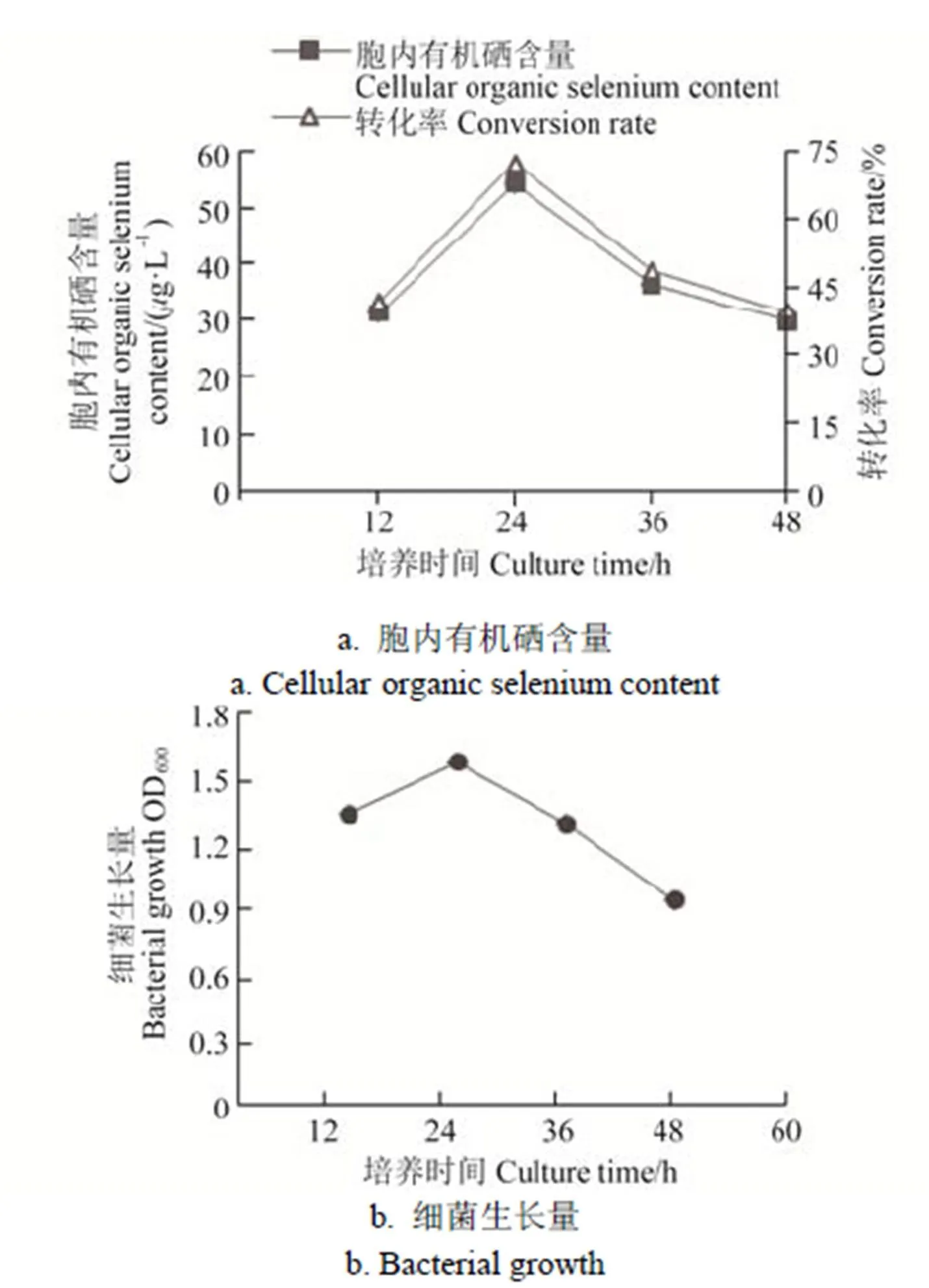
圖5 培養時間對IX+2 2菌株富硒效率的影響

注:A1:硒礦粉75 g·m-2;B1:亞硒酸鈉10 mg·m-2;C1:富硒IX+2 2菌劑3.3 mg·m-2;C2:富硒IX+2 2菌劑10 mg·m-2。
3 討 論
本研究表明該菌株有較好的耐硒能力。培養基中亞硒酸鈉濃度0~400g/L的條件下均可生長。當培養基中亞硒酸鈉濃度為400g/L時,胞內有機硒含量達到最大值141.68g/L。王浩陽[31]研究了967株耐硒菌表明,不同亞硒酸鹽濃度處理下,腸桿菌屬為耐硒優勢種群。
對菌株IX+2 2硒素轉化率的影響因素進行探究,硒含量、加硒時間、培養時間等因素會對其硒素轉化率產生影響。培養基中硒含量對菌株的硒素轉化率呈單峰曲線,在適宜范圍內表現較高硒素轉化能力。IX+2 2菌株在培養基硒含量為200g/L時,其硒素轉化效果最好,轉化率達到70.84%。培養基中硒含量繼續增加,菌株硒素轉化率下降。這與楊麗華等[29]和Zhang等[32]報道的結果一致。相同硒含量采用不同的添加時間會產生不同的結果。在培養3 h,菌株生長處于對數期時加入亞硒酸鈉,硒素轉化效果最好,轉化率可以達到66.57%。此后隨著培養時間增加,硒素轉化率也逐漸降低。吳競對比啤酒酵母不同添加時間得出,在對數期8 h添加亞硒酸鈉的有機硒轉化率高于其他一次性添加方式的轉化率[30]。
對比不同硒源對玉米籽粒的富硒強化效應,有機硒處理較亞硒酸鈉有較好的富硒效果。同等亞硒酸鈉用量條件下,噴施亞硒酸鈉籽粒中硒含量達到228.58g/kg,而施加富硒IX+2 2菌劑籽粒中的硒含量達到378.89g/kg。李玉梅[33]以酵母硒作為有機硒硒源,葉面噴施后對水稻籽粒的硒含量進行檢測,結果表明噴施有機硒120 g/hm2時,大米中硒含量達0.74 mg/kg。植物對有機硒的吸收和利用機理的研究較少。硒代蛋氨酸是谷物籽粒中的主要存在形態,不同種類的植物對有機硒的吸收利用率普遍高于硒酸鹽和亞硒酸鹽[34]。鄧坤[35]研究水稻根系對硒代蛋氨酸的吸收轉運機制表明當對植物外源同時供應硒代蛋氨酸和蛋氨酸時,蛋氨酸能顯著影響植物對硒代蛋氨酸的吸收,因此,推測植物根系可能是通過蛋氨酸轉運蛋白來吸收利用硒代蛋氨酸。研究發現,噴施較高濃度IX+2 2菌劑玉米籽粒中的硒含量達到378.89g/kg,達到富硒谷物的標準[36]。相比于硒礦粉及噴施亞硒酸鈉,富硒IX+2 2菌劑不僅可以提高富硒效率,而且將大部分具有毒性的無機形態的硒被轉化成有機硒,為建立安全、高效的富硒谷物生產技術提供了依據。
4 結 論
1)本研究從植物內生菌中分離篩選到一株能夠將無機硒轉化為有機硒的細菌,經分子生物學鑒定為桑腸桿菌()。按1%接種量,培養在亞硒酸鈉濃度0~400g/L的牛肉膏蛋白胨液體培養基中,菌株均可生長,表明該菌株耐硒能力較強。
2)桑腸桿菌IX+2 2菌株硒素轉化率影響因素探究
研究表明硒含量、加硒時間、培養時間等因素會對菌株IX+2 2的硒素轉化率產生影響。培養基中硒含量在適宜范圍內表現較高硒素轉化能力。相同硒含量采用不同的添加時間會產生不同的結果,在菌株生長處于對數期時加入亞硒酸鈉,硒素轉化效果最好。培養時間增加,菌株生長逐漸變弱,硒素轉化率也逐漸降低。
3)桑腸桿菌IX+2 2對玉米籽粒富硒強化效應研究同等亞硒酸鈉用量條件下,富硒微生物菌劑處理后籽粒中硒含量是亞硒酸鈉噴施處理后玉米籽粒中硒含量的1.66倍。富硒微生物菌劑處理較亞硒酸鈉有更好的富硒效果。
[1] Brigelius-Flohé R. Tissue-specific functions of individual glutathione peroxidases[J]. Free Radical Biology & Medicine, 1999, 27(9/10): 951.
[2] Huang Z, Xiang J J, Guo B J. Progress in molecular biology research of selenoproteins[J]. Progress in Biochemistry and Biophysics, 2001, 28(5): 642-645.
[3] 仝宗喜,康世良,武瑞. 硒及硒蛋白生物學作用的研究進展[J]. 動物醫學進展,2002,23(6):17-19. Tong Zongxi, Kang Shiliang, Wu Rui. Advances of researches on biological effects of selenium and selenoproteins[J]. Progress in Veterinary Medicine, 2002, 23(6): 17-19. (in Chinese with English abstract)
[4] Reid M E, Duffield-Lillico A J, Slate E, et al. The nutritional prevention of cancer: 400 mg per day selenium treatment[J]. Nutrition & Cancer, 2008, 60(2): 155-163.
[5] Cheng Y Y, Qian P C. The effect of selenium-fortified table salt in the prevention of Keshan disease on a population of 1.05 million[J]. Biomedical & Environmental Sciences Bes, 1990, 3(4): 422.
[6] Wallace K, Kelsey K T, Schned A, et al. Selenium and risk of bladder cancer: A population-based case-control study.[J]. Cancer Prevention Research, 2009, 2(1): 70-73.
[7] Clark L C. Effects of selenium supplementation for cancer prevention in patients with carcinoma of the skin: A randomized controlled trial[J]. Jama the Journal of the American Medical Association, 1997, 277(19): 1520.
[8] 石愛華,彭祚全,張妍艷,等. 我國富硒大米的研究與開發[J]. 微量元素與健康研究,2015,32(1):31-32.
[9] 楊旭,董文賓. 富硒食品的研究進展[J]. 食品安全質量檢測學報,2017,8(6):2091-2097. Yang Xu, Dong Wenbin. Research progress of Se-enriched food[J]. Journal of Food Safety & Quality, 2017, 8(6): 2091-2097. (in Chinese with English abstract)
[10] Jing Dawei, Du Zhenyu, Ma Hailin, et al. Selenium enrichment, fruit quality and yield of winter jujube as affected by addition of sodium selenite[J]. Scientia Horticulturae, 2017, 225: 1-5.
[11] Vitova M, Bisova K, Hlavova M, et al. Glutathione peroxidase activity in the selenium-treated alga Scenedesmus quadricauda[J]. Aquatic Toxicology, 2011, 102(1/2): 87-94.
[12] Feng R W, Wei C Y. Antioxidative mechanisms on selenium accumulation inL., a potential selenium phytoremediation plant[J]. Plant Soil and Environment, 2012, 58(3): 105-110.
[13] Feng T, Chen S S, Gao D Q, et al. Selenium improves photosynthesis and protects photosystem II in pear (Pyrus bretschneideri), grape (Vitis vinifera), and peach (Prunus persica)[J]. Photosynthetica, 2015, 53(4): 609-612.
[14] Hartikainen H, Xue T L, Piironen V. Selenium as an anti-oxidant and pro-oxidant in ryegrass[J]. Plant and Soil, 2000, 225(1/2): 193-200.
[15] Akbulut M, Cakir S. The effects of Se phytotoxicity on the antioxidant systems of leaf tissues in barley (L.) seedlings[J]. Plant Physiology and Biochemistry, 2010, 48(2/3): 160-166.
[16] Djanaguiraman M, Prasad P V V, Seppanen M. Selenium protects sorghum leaves from oxidative damage under high temperature stress by enhancing antioxidant defense system[J]. Plant Physiology and Biochemistry, 2010, 48(12): 999-1007.
[17] Kong L A, Wang M, Bi D L. Selenium modulates the activities of antioxidant enzymes, osmotic homeostasis and promotes the growth of sorrel seedlings under salt stress[J]. Plant Growth Regulation, 2005, 45(2): 155-163.
[18] Xue T L, Hartikainen H, Piironen V. Antioxidative and growth-promoting effect of selenium on senescing lettuce[J]. Plant and Soil, 2001, 237(1): 55-61.
[19] Yasin M, El-Mehdawi A F, Anwar A, et al. Microbial-enhanced selenium and iron biofortification of wheat (L.) applications in phytoremediation and biofortification[J]. International Journal of Phytoremediation, 2015, 17(4): 341-347.
[20] Turakainen M, Hartikainen H, Sepp?nen M M. Effects of selenium treatments on potato (L.) growth and concentrations of soluble sugars and starch[J]. Journal of Agricultural and Food Chemistry, 2004, 52(17): 5378-5382.
[21] 李圣男,岳士忠,喬玉輝,等. 中國富硒玉米的生產與富硒效應[J]. 中國農學通報,2014,30(30):6-10. Li Shengnan, Yue Shizhong, Qiao Yuhui, et al. Studies on Se-enriched maize production[J]. Chinese Agricultural Science Bulletin, 2014, 30(30): 6-10. (in Chinese with English abstract)
[22] Wang Qi, Yu Yao, Li Jixiang, et al. Effects of different forms of selenium fertilizers on Se accumulation, distribution, and residual effect in winter wheat-summer maize rotation system[J]. Journal of Agricultural and Food Chemistry, 2017, 65(6): 1116-1123.
[23] 徐巧林,吳文良,趙桂慎,等. 微生物硒代謝機制研究進展[J]. 微生物學通報,2017(1):207-216. Xu Qiaolin, Wu Wenliang, Zhao Guishen, et al. Selenium metabolism in microorganisms[J]. Microbiology China, 2017(1): 207-216. (in Chinese with English abstract)
[24] 徐春蘭. Enterobacter cloacae z0206富硒多糖的制備、結構分析及其主要生物學功能研究[D]. 杭州:浙江大學,2008. Xu Chunlan, Preparation, Structural Analysis and Biological Function Research of Selenium-enriched Exopolysaccharide Produced by Bacterium Enterobacter cloacae Z0206[D]. Hangzhou: Zhejiang University. 2008. (in Chinese with English abstract)
[25] Pieniz S, Andreazza R, Pereira J Q, et al. Production of selenium-enriched biomass by enterococcus durans[J]. Biological Trace Element Research, 2013, 155(3): 447-454.
[26] 劉波. 富硒納豆芽孢桿菌的選育試驗[J]. 北方園藝,2009(1): 215-216. Liu Bo. The screening experiment of baccillus subtilis natto enriching selenium[J]. Northern Horticulture, 2009(1): 215-216. (in Chinese with English abstract)
[27] 宋照軍. 乳酸菌富硒技術初步研究[J]. 食品科學,2004,25(9):137-140. Song Zhaojun. Technology study on enriching selenium(Se) in lactobacillus strains[J]. Food Science, 2004, 25(9): 137-140. (in Chinese with English abstract)
[28] 李海峰,李志建,屈建航. 高效聚磷鞘氨醇桿菌XF-5的分離與鑒定[J]. 河南農業科學,2012(9):68-72. Li Haifeng, Li Zhijian, Qu Jianhang. Isolation and identification of a high-efficient phosphate accumulatingstrain XF-5[J]. Journal of Henan Agricultural Sciences, 2012(9): 68-72. (in Chinese with English abstract)
[29] 楊麗華,代國慶,馬興. 酵母對無機硒的富集及其影響因素[J]. 食品工程,2006(4):37-39. Yang Lihua, Dai Guoqing, Ma Xing. Inorganic selenium concentrated in yeast and influencing factors[J]. Food Engineering, 2006(4): 37-39. (in Chinese with English abstract)
[30] 吳競,王陽光,劉永杰,等. 不同酵母菌種富硒能力比較與發酵條件優化[J]. 畜牧與獸醫,2012,44(1):15-18. Wu Jing, Wang Yangguang, Liu Yongjie, et al. Comparison on selenium-enriched ability of different strains of yeast and optimization of fermentation conditions[J]. Animal Husbandry& Veterinary Medicine, 2012, 44(1): 15-18. (in Chinese with English abstract)
[31] 王浩陽. 耐硒細菌的篩選與鑒定[D]. 北京:中國農業大學,2015. Wang Haoyang. Isolation and Identification of Selenium-tolerance Bacteria[D]. Beijing: China Agricultural University. 2015. (in Chinese with English abstract)
[32] Zhang B, Zhou K, Zhang J, et al. Accumulation and species distribution of selenium in Se-enriched bacterial cells of the Bifid bacterium animals[J]. Food Chemistry, 2009, 115(2): 727-734.
[33] 李玉梅,王根林,李艷,等. 水稻對有機態硒的吸收與積累[J]. 中國農學通報,2017(10):7-11. Li Yumei, Wang Genlin, Li Yan, et al. Organic selenium absorption and accumulation of rice[J]. Chinese Agricultural Science Bulletin, 2017(10): 7-11. (in Chinese with English abstract)
[34] Kikkert J, Berkelaar E. Plant uptake and translocation of inorganic and organic forms of selenium[J]. Archives of Environmental Contamination and Toxicology, 2013, 65(3): 458-465.
[35] 鄧坤. 水稻根系吸收和轉運硒代蛋氨酸的機制研究[D]. 洛陽:河南科技大學,2015. Deng Kun. Study on mechanism of uptake and translocation of selenomethionine by rice roots[D]. Luoyang: Henan University of Science and Technology. 2015.(in Chinese with English abstract)
[36] 彭祚全,張欣,牟敏,等. 富硒食品含硒量范圍標準的研究[J]. 微量元素與健康研究,2013(1):41-43.
Se-enrichment characteristics ofand its Se strengthening effect on corn grain
Qiao Hong1, Yin Jiaming1, Jiang Feng1, Yuan Hongli2, Tan Weiming1※
(1.100193,; 2.100193,)
Selenium is an important trace element in humans, animals and microorganisms. In the human body, it is mainly in the form of organic selenium, which plays an important role in promoting the metabolic process. Organic selenium in the body can scavenge free radicals, resist oxidation, enhance human immunity and fight cancer. The body itself cannot synthesize selenium, and it must be consumed from the outside through diet. However, there are serious shortages of selenium in over 72% of regions in China, and the selenium content in the main crops cannot meet the human reference intake of selenium. Therefore, selenium-enriched foods have received extensive attention. Selenium plays an important role in antioxidant reactions in plants and animals. At appropriate concentrations, selenium can improve the activity of antioxidant enzymes, such as catalase, superoxide dismutase, and peroxidase, etc. in order to reduce oxidative stress in the plant chloroplast, and enhance plant growth. In addition, exogenous application of selenium can promote the photosynthetic pigment content of various plants. In this study, a strain IX+2 2 was previously selected from plant endophytes for transforming inorganic selenium into organic selenium with higher bioavailability. By determining its 16S rRNA gene sequence, the strain was identified as Enterobacter mori. This paper studied the effect of different selenium content, selenium addition time and different culture collection time on intracellular selenium content and selenium conversion rate of strain IX+2 2. The results showed that the selenium content in the medium had a great influence on the growth and selenium conversion ability of strain IX+2 2. With the increase of selenium content in the medium, the intracellular selenium content and selenium conversion rate gradually increased, but after reaching a certain peak, they begins to decline again. When the selenium content was 200g/L, the conversion rate was the highest, reaching 70.84%. When the selenium content was 250g/L, the selenium content in the cells reached the maximum, which was 163.45g/L, but the growth of the strain was significantly inhibited, and the conversion rate also decreased, It shows that the selenium content in the medium will show a high selenium conversion ability in a suitable range. The addition of selenium in the logarithmic phase favors the growth of strain IX+2 2 and the conversion of inorganic selenium. Sodium selenite addition time had little effect on the growth of strain IX+2 2 in the time range of 0-12 h, however, the selenium-enrichment efficiency of strains first increased and then decreased with the addition time. Sodium selenite was added to the strains at 3 h, and the intracellular selenium content of the strains rapidly increased to 49.93g/L, selenium conversion was the best, and the conversion rate could reach 66.57%. After that, with the increase of culture time, the intracellular selenium content of the cells gradually decreased, and the conversion rate of selenium also gradually decreased to 40.20%. The selenium conversion rate of the strain was highest when sodium selenite was added at 3 h, which may be due to the growth of the strain in logarithmic phase and the vigorous growth of the bacteria. When the strain was cultured for 24 h, the selenium conversion rate was best, and the growth of the cultured cells continued to decrease, with the increase of culture time, the selenium conversion rate of strain IX+2 2 increased first and then decreased. The highest transformation efficiency was 72.10% at 24 hours of culture. As the culture time increased, the growth of the bacteria decreased and some of the bacteria autolyzed, and the transformation efficiency also decreased. Simultaneously, the ability of the strain to strengthen selenium in corn kernel shows that the selenium transformation efficiency of the selenium enriched inoculate solution is better than application of sodium selenite with foliage spray. The corn kernel selenium content were noted 228.58g/kg when equal quantity of sodium selenite was applied with foliage spray while the microorganisms agent get to378.89g/kg, the latter was 1.66 times higher than the former.
bacteria;selenium; crops; bacteria identification;selenium rich characteristics;strengthening effect of selenium
2018-04-07
2018-05-27
公益性行業(農業)科研專項(201303106)
喬 虹,主要從事作物栽培與研究。Email:qiaohng@cau.edu.cn
譚偉明,副教授,博士生導師,主要從事作物生理與栽培研究。Email:tanwm@cau.edu.cn
10.11975/j.issn.1002-6819.2018.17.037
Q93
A
1002-6819(2018)-17-0284-07
喬 虹,尹佳茗,姜 峰,袁紅莉,譚偉明. 桑腸桿菌菌株的富硒特性及其噴施對玉米籽粒的硒素強化[J]. 農業工程學報,2018,34(17):284-290. doi:10.11975/j.issn.1002-6819.2018.17.037 http://www.tcsae.org
Qiao Hong, Yin Jiaming, Jiang Feng, Yuan Hongli, Tan Weiming. Se-enrichment characteristics ofand its Se strengthening effect on corn grain[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(17): 284-290. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2018.17.037 http://www.tcsae.org

