基于內質網應激的丹參酮IIA磺酸鈉調節主動脈瓣膜間質細胞鈣化機制研究?
陳 芳,馬 飛,劉亞美,王 丹,沈曉君,魏 群
(河南中醫藥大學,鄭州 450016)
老年性鈣化性瓣膜病嚴重危害人類健康,已成為心血管疾病的第三號殺手。老年性瓣膜病發病機制復雜[1],目前認為瓣膜間質細胞成骨樣改變是瓣膜鈣化的主要病因之一。尋找有效抑制瓣膜間質細胞成骨樣變的藥物,延緩瓣膜鈣化進展,是目前瓣膜病研究的熱點內容之一[2-3]。因此,本文應用丹參酮IIA磺酸鈉作用于瓣膜間質細胞(VICs),觀察其對間質細胞的作用,探討其對間質細胞成骨樣改變的深入機制。
1 材料與方法
1.1 試劑與藥品
RPMI1640培養基,Solarbio公司;FBS胎牛血清,500 mL/瓶,美國Gibico公司;豬ELISA試劑盒(IL-6, IL-8)購自南京森貝伽公司,豬MCP-1 ELISA試劑盒購自genetex公司;Trizol 100 ml/瓶,Solarbio公司;逆轉錄試劑盒及熒光定量PCR試劑盒,Transgen公司;免疫蛋白電泳及免疫熒光用一抗抗體 Runx2 (sc-10758, 兔抗人), osteocalcin(sc-30045, 兔抗人), β-actin(sc-130656兔抗豬),美國Santa Cruz公司;α-SMA(兔抗豬),武漢博士德,NCBI中檢索Runx2與osteocalcin蛋白,BLAST對比人與豬序列顯示物種同源性超過85%。二抗購買自武漢博士德,為羊抗兔IgG;茜素紅,北京索萊寶;丹參酮IIA磺酸鈉,上海遠慕;牛黃熊去氧膽酸(TUDCA)杭州寶積;MTT細胞活力檢測試劑盒,北京百奧萊博,MCP-1中和抗體,美國R&D,其他相關試劑均為國產分析純。
1.2 儀器
細胞培養箱(Kendro公司);StepOnePlus Realtime PCR系統(美國ABI公司);光學顯微鏡及熒光顯微鏡(Olympus公司);酶標儀(Thermo公司)。
1.3 豬瓣膜間質細胞(VICs)培養、分組與藥物干預
成年健康新鮮豬屬家豬(Susscrofadomesticus)心分離主動脈瓣三瓣葉,浸泡于 1 mg/mL II 型膠原酶-DMEM 溶液, 37℃培養箱放置30 min,劇烈震蕩 1 min 分離內皮后再將瓣葉置于新的 1 mg/mL II 型膠原酶-DMEM 溶液中, 37℃ 5% CO2培養4~6 h終止消化,離心后使用RPMI1640培養基培養[4]。細胞豐度在80%左右,接種至6孔板中,調整細胞濃度為1×106/ml,更換培養基為成骨培養基(含FBS濃度為10%~15%,10mmol/L β-甘油磷酸, 50 μg/ml 維生素C,100 nmol/L地塞米松的RPMI1640培養基),參見參考文獻[5],待細胞完全貼壁后進行實驗。將各孔分為空白組、模型組、丹參酮IIA磺酸鈉組、西藥對照組(牛黃熊去氧膽酸,TUDCA),每組均設3個復孔。細胞饑餓后,除空白組外每組均使用100 mg/L oxLDL刺激,其余藥物oxLDL刺激24 h后依據時間截點加入,調整MCP-1中和抗體組濃度至5ug/ml,根據不同實驗目的按時間收取檢測[4]。
1.4 丹參酮IIA磺酸鈉最佳刺激濃度的確定
取指數生長期的VICs細胞接種于96孔板,接種密度為1×104/ml培養24 h后處理,模型組加入oxLDL,不同濃度的丹參酮IIA磺酸鈉組均加入oxLDL及相對應濃度的丹參酮IIA磺酸鈉。MTT法檢測細胞活力及計算各組細胞存活率,選擇最佳的丹參酮IIA磺酸鈉干預濃度。
1.5 茜素紅染色
將傳代至第三代的VICs接種于事先放置潔凈蓋玻片的6孔板內制備細胞爬片, 細胞融合率約為80% ~ 90%時換成骨誘導培養基,并給予藥物干預,放置于37 ℃、5% CO2孵育, 14 d后茜素紅染色觀察成骨化程度[4,5]。
1.6 免疫印記實驗
成骨化培養基培養并藥物干預2周后,使用蛋白裂解液(碧云天)裂解VIC細胞并提取總蛋白后,4%~20% SDS - PAGE電泳,轉膜PVDF膜,室溫封閉液封閉1 h后,一抗孵育過夜,一抗稀釋倍數按照對應說明書進行,Runx2(1∶1000),osteocalcin(1∶500),使用β-actin作為內參。之后加入二抗洗滌,化學發光成像儀顯影并分析對應條帶灰度值。
1.7 細胞總RNA提取及實時熒光定量PCR
用細胞刮刮下細胞,EP管中每管加入Trizol 1 ml室溫裂解5 min,之后逐步加入0.2 ml氯仿及異丙醇,分次離心并靜置;棄上清后75% 乙醇洗滌,高速離心;沉淀的RNA在自然干燥后用Rnase-free water 溶解。分光光度法檢測RNA純度及濃度。之后按照逆轉錄試劑盒說明書加入試劑,42 ℃孵育15 min,85℃5 s,逆轉錄成cDNA后進行熒光定量分析。實時熒光定量仍采用Transgen公司產品,從NCBI中選取家豬(Susscrofadomesticus)對應蛋白的mRNA序列外顯子部分,PrimerPremier 6.0設計引物,primer-blast比對引物序列,最終設計豬特異性引物序列如表1[5-6],應用2-ΔΔCT法分析數據。

表1 引物序列表
1.8 酶聯免疫吸附實驗
細胞培養后取其上清液,按照說明書進行如下操作:標準品稀釋,設置樣品孔、空白孔等,封板膜封口后孵育,反復洗滌5次后棄洗滌液加入酶標試劑,再次孵育洗滌后加入A、B顯色液及終止液,酶標儀測定各孔的吸光度并最終計算濃度。
1.9 統計學方法
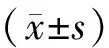
2 結果
2.1 豬主動脈瓣間質細胞培養及鑒定
圖1顯示,分離培養的豬主動脈瓣瓣膜間質細胞呈梭形,單層排列,成漩渦狀或放射狀聚集,生長較緩慢,免疫熒光染色顯示約70%的細胞呈現綠色熒光,α-SMA染色陽性,提示造模成功。
2.2 丹參酮IIA磺酸鈉最佳刺激濃度的確定
應用oxLDL造模,給予不同濃度丹參酮IIA磺酸鈉干預后,根據公式計算細胞活力(%)=(A藥物-A空白) / (A模型-A空白) × 100%。表2顯示,丹參酮IIA磺酸鈉刺激濃度在50 μg/ml時進入平臺期,故最終選擇50 μg/ml為下述實驗刺激濃度。

表2 MTT法對細胞活力的檢測及最佳藥物濃度選擇

圖1 豬主動脈瓣膜間質細胞培養與鑒定注:左圖為光鏡下主動脈間質細胞形態(×100),右圖為熒光顯微鏡α-SMA染色結果(×400),光鏡下可見豬主動脈瓣瓣膜間質細胞呈單層生長,細胞為梭形,成漩渦狀或放射狀排列,箭頭處為典型梭形生長的細胞,熒光顯微鏡顯示表達α-SMA細胞呈現綠色熒光,見箭頭所指處,約70%的細胞表達α-SMA,提示造模成功
2.3 茜素紅染色及western-blot檢測成骨化結果
圖2、3表3顯示,染色結果提示oxLDL誘導VICs細胞成骨化,顯微鏡下可見多個鈣化結節形成,丹參酮IIA磺酸鈉可減輕鈣化結節形成,減輕程度與西藥對照組類似。western-blot提示,模型組在oxLDL誘導下Runx2及osteocalcin蛋白表達明顯升高,提示VIC細胞出現成骨化,而丹參酮IIA磺酸鈉可減輕成骨化蛋白表達(P<0.05),與茜素紅染色結果相一致。
2.4 實時熒光定量定量PCR檢測內質網應激及酶聯免疫吸附實驗檢測細胞上清液中內質網相關炎癥因子
表4顯示,實時熒光定量PCR檢測培養的VIC細胞BIP,Chop蛋白表達。結果顯示,模型組在oxLDL誘導下,內質網應急蛋白標志物mRNA表達明顯升高,誘導細胞炎癥因子表達,而丹參酮IIA磺酸鈉可減輕內質網應激及IL-6,IL-8及MCP-1等內質網相關炎癥因子的表達。

圖2 茜素紅鈣化結節染色結果(×100)注:a.空白組;b.模型組;c.丹參酮IIA磺酸鈉組;d.西藥對照組;圖中橘紅色結節即為鈣化結節,如箭頭所示,可見丹參酮IIA磺酸鈉組減輕鈣化結節的生成

圖3 western blot檢測成骨化相關蛋白runx2及osteocalcin表達注:a.空白組;b.模型組;c.丹參酮IIA磺酸鈉低劑量組(10 μg/ml);d.丹參酮IIA磺酸鈉高劑量組(50 μg/ml);e.西藥對照組

表3 成骨化相關蛋白runx2及osteocalcin相對表達量
注:與空白組比較:**P<0.01;與模型組比較:#P<0.05

表4 BIP及CHOP mRNA檢測及酶聯免疫吸附實驗檢測ERS相關炎癥因子表達結果
注:與空白組比較:*P<0.05,**P<0.01;與模型組比較:#P<0.05

圖4 Wester-blot檢測MCP-1中和抗體對VICs成骨化的影響注:a.空白組;b.模型組;c.MCP-1中和抗體組
2.5 western-blot檢測應用MCP-1中和抗體后成骨化相關蛋白的表達
圖4、表5顯示,oxLDL誘導VICs后,Runx2及osteocalcin蛋白表達明顯升高,而在oxLDL誘導后24 h加入MCP-1中和抗體孵育24 h,Runx2及osteocalcin蛋白表達僅略降低,但與模型組比較差異無統計學意義。

表5 MCP-1中和抗體對runx2及osteocalcin相對表達量的影響
注:與空白組比較:*P<0.05
3 討論
老年性鈣化性瓣膜病以主動脈受累多見,簡稱鈣化性主動脈瓣疾病(CAVD),又稱主動脈退行性變,是一組以瓣膜結締組織發生纖維化和鈣化, 導致瓣葉出現局部增厚、活動受限及啟閉功能障礙的老年性退行性疾病[1-4]。傳統觀點認為,CAVD發生發展過程是被動性的鈣磷沉積過程,隨年齡增長而進行性加重。而近年來研究表明,主動脈瓣鈣化性疾病及其類似于動脈粥樣硬化,是一組多細胞、多基因、多靶點調控的主動性過程,早期出現脂質沉積、致粥樣硬化特征性的泡沫樣巨噬細胞及少量T淋巴細胞浸潤為主,病變進展期隨著瓣膜內鈣鹽沉積量增多,逐漸演變為瓣膜器質性變,瓣膜僵硬及開閉功能障礙[2-3,6]。因此,主動脈瓣鈣化在此病中發揮著舉足輕重的作用。瓣膜間質細胞(VICs)是瓣膜中主要存在的兩種細胞類型之一, 是主動脈瓣膜鈣化最主要的參與細胞。VICs細胞成骨樣變在老年性CAVD發生發展中占據主導地位,導致VICs成骨樣變的因素復雜,目前內質網應激是有證據的導致其成骨化最主要的原因之一[1]。
丹參酮IIA磺酸鈉是中藥丹參活性成分丹參酮IIA的一系列磺基化衍生物,臨床上廣泛應用于心絞痛及室性早搏的治療[6-7]。同時該藥物還被發現可改善微循環,減輕缺血再灌注損傷,抗炎及抗血小板作用[7]。實驗數據表明,丹參酮IIA磺酸鈉可改善血管平滑肌細胞異常增殖及鈣化,而血管平滑肌細胞與VICs高度類似,內質網應激亦參與血管平滑肌細胞異常鈣化途徑,丹參及其提取物可減緩上述過程[7]。
內質網是細胞內蛋白質加工及合成的生物工廠,在維持細胞內環境的穩態中發揮著不可或缺的作用。缺氧、應激或各種不良理化條件刺激下,內質網發生未折疊蛋白反應(UPR) 和 Ca2 +平衡失調,稱為內質網應激(ERS),進而導致細胞凋亡[8]。ERS 反應是真核細胞的一種自我保護機制,細胞借此恢復內質網穩態維持生存。但過強或者長時間的 ERS 反應對細胞弊大于利,可引起細胞的損害甚至死亡[9]。內質網應激參與多種心血管相關疾病研究顯示,內質網應激參與主動脈瓣間質細胞鈣化過程,應用特異性抑制劑TUDCA處理后,大鼠主動脈瓣鈣化程度減輕[10],并且oxLDL通過IRE-1α/C-Jun誘導離體主動脈瓣間質細胞內質網應激,進而使間質細胞鈣化[11-12]。課題組的研究結果亦表明,內質網應激確實參與主動脈瓣膜鈣化進程,可影響VICs細胞成骨樣變,而丹參酮IIA磺酸鈉組可逆轉主動脈瓣鈣化進程,通過調節內質網應激主要標記蛋白BIP,CHOP mRNA表達減輕瓣膜間質細胞炎癥反應,抑制成骨化相關蛋白runx2及osteocalcin表達,從而減輕主動脈瓣鈣化,但同時課題組也發現,單純抑制炎癥因子MCP-1,對成骨化相關蛋白的表達調控作用并不理想,這可能與內質網應激激活多條炎癥通路,單一通路的影響作用較小有一定關聯性。
綜上所述,丹參酮IIA磺酸鈉可減輕瓣膜間質細胞成骨化相關蛋白及炎癥因子表達,通過抑制內質網過度應激減輕細胞損害,發揮延緩瓣膜間質鈣化的作用。

