植物多酚提高柔紅霉素耐藥白血病干細胞殺傷敏感性的研究
劉小琴 舒華娥 肖 行 陳 西 馬 遙
白血病干細胞(leukemic stem cell,LSC)的存在是白血病難治復發的根源,也解釋了臨床上白血病治療的難點和疑惑[1]。LSC具有很強的生存優勢,對化療藥物耐藥[2]。近年來越來越多研究證據表明,白血病復發和耐藥的根本原因是LSC的存在,多信號系統紊亂導致其對多種化療藥物如柔紅霉素耐藥是治療失敗和復發的分子基礎[3]。在誘導增敏殺傷概念指導下,采用植物多酚調節凋亡信號通路誘導凋亡和提高其對化療藥物(柔紅霉素)敏感性的“自亡和它殺”相結合的新方法,有望達到最大限度清除天然耐藥的LSC目的[4]。本研究以人急性髓系白血病KG1a細胞株中獲得的CD34+CD38-LSC為靶細胞,通過柔紅霉素干預發生耐藥后,再采用植物多酚干預耐藥的LSC,以增殖抑制率、遷移侵襲能力、凋亡率、內/外源性凋亡通路中關鍵分子變化為指標,評價植物多酚增強柔紅霉素耐藥的LSC的敏感性的生物學效應,并探明相關的分子機制,為有效清除LSC提供理論和實驗依據。
1 材料與方法
1.1 試劑與儀器
試劑:人急性髓系白血病KG1a細胞株(南京森貝伽生物科技有限公司,中國);PCR試劑盒(上海碩盟生物,中國),MTT試劑盒(北京中杉金橋生物公司,中國),不含血清培養基、含血清的完全培養基(GIBCO公司,USA),異硫氰酸熒光素標記的膜聯蛋白(武漢博士德,中國),Transwell 24孔培養板(Corning 公司,USA),凋亡相關基因Bax(Santa Cruz公司)。96孔板、10 cm2培養皿(Corning 公司,USA),含EDTA的胰酶(GIBCO公司,USA)。儀器:80 ℃~4 ℃冰箱(日本松下),高轉速冷凍離心機(BiofugeStratos,德國),培養箱(Queue systems,USA),細胞培養超凈臺(蘇州凈化,中國),FACSort流式細胞儀(BD公司,USA),倒置相差顯微鏡(奧林巴斯,日本),PCR儀(Rotor-gene,澳大利亞)-高壓消毒箱(美國Tuttnauer,美國)。
1.2 免疫磁珠分選CD34+CD38-白血病干細胞與細胞培養
將計數后的KG1a細胞重懸于PBS中,加入抗人CD38磁珠結合的單克隆抗體,4 ℃孵育30 min,PBS洗滌2次,上機,陰性分選出CD38-的細胞,重新計數重懸于PBS中,加入抗人CD34和CD123磁珠結合的單克隆抗體,4 ℃ 孵育15 min,PBS洗滌2次,陽性分選選出CD34+CD38-的細胞,即為CD34+CD38-白血病干細胞。
將分選的CD34+CD38-LSC置于含雙抗及10%胎牛血清的DMEM培養基中培養,37 ℃條件下于5% CO2孵箱中傳代。傳代條件為當密度達到4×106時,以含0.02%EDTA的胰蛋白酶消化細胞進行再次接種。終止消化的條件為在倒置顯微鏡下觀察到細胞回縮時,此時加入含血清培養基,10 000 r/min離心5 min,棄上清,取細胞懸液,細胞計數接種至新培養基。
1.3 細胞干預
向呈對數生長的細胞加入1 μg/mL柔紅霉素干預,細胞增殖從緩慢變迅速,當細胞密度達到4×106,出現耐藥的情況下給予植物多酚刺激,對照組不接受相應刺激,并予濃度為12.5 μg/ml的凋亡相關基因Bax刺激14 h收集細胞。
1.4 半定量逆轉錄聚合酶鏈反應(RT-PCR)
取實驗組及對照組細胞定量100 mg,提總RNA。逆轉錄cDNA,反應過程按照標準的RT-PCR進行。Caspase-3、Caspase-9的引物:變性-梯度變性進行30次的循環。得到的PCR產物行瓊脂糖凝膠電泳,并行凝膠成像。內參選擇18 s RNA,對半定量結果進行比對,分析吸光度。
1.5 細胞凋亡與凋亡周期檢測
以Annexin V/PI法檢測,待細胞冷卻至4 ℃,洗滌,并使濃度調整為106/ml,加入PI與Annexin V-FITC,避光15 min后行流式檢測。
對收集的細胞加入Annexin V-FITC,采用API的方法檢測細胞的凋亡周期,靜置1 h之后進行流式檢測。
雙標流式細胞儀CyclinE/DNA分析周期特異性,處理好的細胞加入PI和RnaseA行DNA染色后行流式檢測。
1.6 MTT法檢測細胞活力
將細胞接種于96孔板,當細胞匯合度達到50%,予植物多酚10 μl,植物多酚NC。48 h后,加入MTT,繼續培養4 h DMSO,震蕩使結晶物充分溶解,于酶標儀560 nm處測OD值,細胞相對活力(%)=(實驗組OD/對照組OD值)×100%。
1.7 Transwell體外遷移體系
血清饑餓12 h,離心收集細胞,將Transwell培養池放入培養板中,加入細胞懸液(約5×104細胞),含10% FBS的DMEM培養液中培養24 h,4%多聚甲醛固定30 min,0.1%結晶紫染色30 min,顯微鏡下觀察。1%十二烷基硫酸鈉(SDS)500 μl溶解細胞30 min。100 μl細胞裂解液,放入細胞培養板中,酶標儀測定吸光值。
1.8 統計學方法
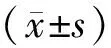
2 結果
2.1 鑒定加入植物多酚干預的白血病干細胞的細胞周期
以植物多酚刺激柔紅霉素耐藥的白血病干細胞,觀察細胞增殖的情況:處于靜止期的白血病干細胞加入植物多酚后進入G2~M期。
2.2 應用API的方法檢測細胞凋亡細胞周期特異性分析
植物多酚誘導柔紅霉素耐藥的白血病干細胞,在G1期發生細胞凋亡,而對照組幾乎未發生細胞凋亡。
2.3 雙標流式細胞術CyclinE/DNA對細胞周期分析
植物多酚刺激之后出現在G0、早/晚G1、S2、G2、M期,白血病干細胞處在G0期,加入植物多酚誘導柔紅霉素耐藥的細胞阻滯在G1期,CyclinE表達下降。
2.4 Caspase-3、Caspase-9 mRNA表達的影響
植物多酚組的Caspase-3、Caspase-9 mRNA表達均較對照組高,差異均具有統計學意義(P<0.05)。隨著時間的延長,植物多酚組誘導柔紅霉素耐藥的細胞凋亡指數呈上升趨勢,差異有統計學意義(P<0.05)。見表1,表2。
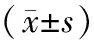
表1 Caspase-3、Caspase-9 mRNA表達比較分析

表2 不同時相血清細胞凋亡指數變化
注:①為與3 h比較,P<0.05。
2.5 植物多酚對白血病干細胞活力的影響
與對照組[(90.48±8.67)%]比較,植物多酚組中柔紅霉素耐藥的白血病干細胞活力[(52.39±5.96)%]顯著降低,差異具有統計學意義(P<0.05)。
2.6 白血病干細胞體外遷移能力
Transwell體外遷移實驗結果顯示,經植物多酚作用后的耐藥白血病干細胞體外遷移的能力明顯降低(P<0.05)。第7天,對照組體外遷移細胞數目明顯高于植物多酚組(P<0.05),見表3。
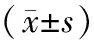
表3 白血病干細胞體外遷移細胞數目
注:①為與0天比較,P<0.05。
3 討論
白血病是一種常見的造血系統惡性腫瘤,其發病率在我國為4.17/10萬[5]。近年來,損傷性污染漸漸嚴重,由此引起的白血病發病率呈逐漸升高趨勢,由于病因尚不明確,治療難度大[6]。目前白血病的治療仍以化療為主。盡管隨著臨床新藥的發展和聯合化療的應用,白血病的緩解率顯著上升,但在復發/難治白血病仍未取得突破性進展[4]。近年來越來越多研究證據表明,耐藥的根本原因是白血病干細胞的存在[7-8]。白血病干細胞失去正常的增殖分化能力,在多基因和多個信號調節系統上發生異常,具有很強的無控性自主增殖能力。白血病干細胞具有特定的自我更新和增殖能力,通常處于G0期[9],當周圍環境改變時,能實現腫瘤的細胞遠處轉移及浸潤,出現大量、快速地增殖,并使肝、脾、淋巴結腫大。
白血病干細胞對放射、藥物和自身免疫細胞的殺傷產生強大的抵抗力,內外凋亡途徑發生異常改變[10]。這種在基因水平上的突變和調節信號的改變導致了對人體致死劑量水平藥物的耐受和抵抗,可從放療和化療過程獲得的,也可以是固有的。近30年來,白血病的治療發展進入相對遲滯的平臺期,相當數量的病例對當前臨床主流的藥物缺乏敏感性,使其遠期生存率難以得到顯著上升,探索有效、新的化療相關藥物就顯得尤為重要。當細胞被阻滯在細胞周期中某一個時相時就會出現凋亡,周期性是細胞凋亡的特性,因而多數的腫瘤化療殺傷腫瘤細胞,是采用該理論誘導細胞在特定的周期內發生凋亡[11]。
近來研究發現,來源于植物的小分子物質,能作用于內、外源性凋亡途徑的多個靶點,改變腫瘤細胞周期,還引起多種腫瘤細胞凋亡,抑制其生長[12]。植物多酚組是一大類具有不同結構的化合物,癌癥低發與富含植物多酚的食用性植物關系密切[13]。動物實驗顯示植物多酚組能有效地抑制腫瘤誘發、促進和發展多個階段,對化學誘發的腫瘤具有抗癌作用[14]。提高化療藥物劑量既不能很好消滅LSC,又帶來較大的副作用,且靶向分子藥物和傳統增敏藥物也不能很好增強LSC對化療藥物的反應,因此需要尋找一種新方法,聯合應用植物多酚啟動內外凋亡途徑,作用于LSC凋亡通路多個靶點,增強其對化療藥物敏感性,誘導LSC凋亡,以期最大限度殺滅白血病干細胞[15]。
本研究以API法檢測植物多酚對柔紅霉素耐藥的LSC細胞凋亡誘導情況,以及細胞凋亡的周期特異性。通過細胞核染色,顯示了早期細胞凋亡出現伴隨著膜外翻的現象。研究結果顯示,細胞的周期蛋白是一類在細胞周期中特異性表達的蛋白質,細胞周期的G1期是植物多酚誘導細胞凋亡與周期特異性凋亡的主要時相。刺激細胞周期的依賴性蛋白激酶可以表現細胞的特異性周期,CyclinE/DNA雙標流式細胞術通過對細胞所處的位置與細胞CyclinE的表達相結合實現對細胞周期的分析。周期蛋白最大的特點就是時相性,能夠獲得詳細的細胞周期信息。G1期是CyclinE的完全合成期,其中表達最強時是在G1晚期,且CyclinE不會出現在G0期,可見CyclinE能夠將G0與G1期進行完全分開。本研究顯示細胞在G1期被阻滯,植物多酚誘導后的白血病干細胞CyclinE的表達是下降的,且伴隨著凋亡相關蛋白Caspase-3、Caspase-9的高表達;Transwell示,第7天植物多酚組體外遷移能力明顯降低;植物多酚組細胞活力下降。
綜上所述,白血病干細胞進入細胞周期后細胞凋亡才會變得敏感,在靜止期的時候并沒有啟動周期進程,植物多酚誘導凋亡與柔紅霉素耐藥的白血病干細胞的細胞周期時相有密切關系,其可抑制細胞活性及遷移侵襲能力。

