人乳頭瘤病毒的p53蛋白表達與外陰上皮內瘤變的相關性
薛雯娟 崔 旭 楊 寧 張亞萍 王麗娟
外陰上皮內瘤變(vulvar intraepithelial neoplasia,VIN)是一組外陰病變,具有發病率高、病死率高、普查率低等特點,是外陰癌的前期病變。流行病學調查顯示全球每年約有500萬的外陰上皮內瘤變新發病例,其中外陰癌占10%左右,在我國的國內發病率呈現上升的趨勢[1]。不過外陰上皮內瘤變具有較長的、可逆轉的癌前病變期,由外陰上皮內瘤變逐漸發展到外陰癌的過程比較長,早期診治能取得比較好的效果[2]。人乳頭瘤病毒(human papilloma virus,HPV)是一種無包膜的小DNA病毒,高危型HPV(HR-HPV)感染與外陰上皮內瘤變緊密相關[3]。有報道顯示HPV的持續感染與外陰上皮內瘤變相關,故將HPV感染作為篩查外陰上皮內瘤變的一種手段[4]。近年來,隨著分子遺傳學的研究與不斷發展,現代研究已表明外陰上皮內瘤變的發生與發展癌基因的異常激活和編碼蛋白的過度表達以及抑癌基因的缺失、突變失活有明顯相關性[5]。p53基因是一種分子量為53 kDa的蛋白質,也為人體抑癌基因,p53基因的失活對宮頸癌形成起重要作用[6]。本文具體探討了人乳頭瘤病毒的p53蛋白表達與外陰上皮內瘤變的關系,報告如下。
1 資料與方法
1.1 一般資料
選擇2014年2月至2017年2月96例在我院進行宮頸分泌物HPV感染篩查的患者。納入標準:臨床表現不規則陰道流血、白帶增多;患者知情同意本研究;有性生活經驗史;年齡18~80歲;研究得到醫院倫理委員會的批準。排除標準:既往有其他腫瘤病史及具有腫瘤家族史者;病例資料不全或缺失者;精神疾病患者。96例患者年齡在19~79歲之間,平均年齡是(41.11±8.56)歲;平均體重指數是(23.11±1.48)kg/m2;平均初潮年齡為(15.92±2.52)歲;平均懷孕次數為(2.61±0.44)次;平均分娩次數為(1.62±0.33)次。
1.2 HPV檢測
所有患者都給予HPV基因分型檢測,包括15種高危型:HPV16、HPV18、HPV31、HPV33、HPV35、HPV39、HPV45、HPV51、HPV52、HPV56、HPV58、HPV59、HPV68、HPV73、HPV82;3種疑似高危型:HPV26、HPV53、HPV66;10種低危型:HPV、HPV83、HPV81、HPV61、HPV54、HPV44、HPV43、HPV42、HPV40、HPV11、HPV6。標本采集前3天停止使用任何婦科外用藥物,患者取截石位,使用窺陰器暴露宮頸,將HPV采集器放入宮頸內部,旋轉3周后停止,停留10 s左右后將采集器取出,放入盛有細胞保存液的瓶內,蓋好瓶蓋,填寫患者資料并編號,并將其送往檢驗科集中檢測。檢測使用PCR反向點雜交法,通過膜條上的特異性探針與PCR產物的雜交,洗膜,特異性探針與靶標中的特異性片段結合,最后顯色分析,從而得知HPV感染陽性基因分型。
1.3 p53蛋白表達檢測
所有患者的外陰病變處取小塊活檢組織標本,通過脫水、切片、浸蠟、透明、包埋、切片,制作成防脫膠片。再通過恒溫箱過夜后脫蠟,再進行組化染色,封片,鏡檢判讀。
1.4 統計方法
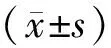
2 結果
2.1 外陰上皮內瘤變分級情況
在96例患者中,外陰上皮內瘤變Ⅰ級72例,表現為上皮過度增生和異型細胞的改變,局限于上皮的下1/3;外陰上皮內瘤變Ⅱ級16例,表現為上皮層上述變化發生于上皮的下2/3;外陰上皮瘤變Ⅲ級8例,表現為上皮層的變化超過2/3,不典型增生累及整個上皮層,但未穿透基膜。
2.2 高危型HPV陽性情況對比
外陰上皮內瘤變Ⅰ級、Ⅱ級與Ⅲ級患者的高危型HPV陽性率分別為37.5%(27/72)、75.0 %(12/16)和87.5 %(7/8),對比差異有統計學意義(F=8.194,P<0.05)。
2.3 p53蛋白表達情況對比
Ⅰ級、Ⅱ級與Ⅲ級患者的p53蛋白相對表達量分別為(12.76±1.12)、(6.22±0.84)、(1.33±1.21),兩兩對比差異明顯(F=18.472,P<0.05)。
2.4 相關性分析
直線相關分析顯示觀察組高危型HPV陽性率與p53蛋白相對表達量呈現明顯負相關性(γ=-0.544,P<0.05)。多因素非條件logistic回歸分析顯示高危型HPV陽性、p53蛋白相對表達量都為導致外陰上皮瘤變的主要獨立危險因素(P<0.05)。見表1。

表1 導致外陰上皮瘤變的主要獨立危險因素(n=296)
3 討論
外陰上皮內瘤變是臨床上比較常見的婦科腫瘤,一旦發病,對患者的身心都會造成嚴重的損害。HPV病毒只針對人類進行侵犯,對其它動物并沒有致病性,人體可通過正規系統的治療將該病毒清除掉[7]。大部分HPV感染表現為一過性,大部分感染該病毒的女性并沒有明顯的臨床癥狀,只有少數發展為HPV持續感染,進一步發展為外陰癌。一般情況下,外陰上皮內瘤變病變級別上升,HPV感染率也會隨之增加[8]。但也存在低危型HPV病毒,不會引起外陰上皮內瘤變,但可引起人體其他良性腫瘤或疣,需進行臨床確診才可判別[9]。本研究顯示在96例患者中,外陰上皮內瘤變Ⅰ級72例,外陰上皮內瘤變Ⅱ級16例,外陰上皮瘤變Ⅲ級8例。
外陰上皮內瘤變具有明確的致病因素和較長的可逆轉的癌前病變期,高危型HPV病毒的持續感染將會導致外陰上皮內瘤變的發生,95%以上的外陰上皮內瘤變由高危型HPV感染引起。HPV病毒為雙鏈DNA病毒,絕大多數的HPV感染可在2年內感染消退,不會發展為外陰癌[10]。本研究顯示外陰上皮內瘤變Ⅰ級、Ⅱ級與Ⅲ級患者的高危型HPV陽性率分別為37.5%、75.0%和87.5%,對比差異有統計學意義(P<0.05)。在一定程度上說明高危型HPV陽性可促進外陰上皮內瘤變的發生和發展,二者存在一定的關系。
癌基因激活和抑癌基因失活均可導致正常組織發生癌變,通過單個抑癌基因或癌基因的檢測分析等有助于分析腫瘤的發生與發展[11]。p53是比較常見的抑癌基因,在各種腫瘤中被廣泛檢測,通過檢測p53抑癌基因可以有效地檢測出遺傳性癌癥相關的致病突變,從而預知特定惡性腫瘤發生的風險。本研究顯示Ⅰ級、Ⅱ級與Ⅲ級患者的p53蛋白相對表達量分別為(12.76±1.12)、(6.22±0.84)、(1.33±1.21),兩兩對比差異明顯(P<0.05),表明隨著外陰上皮內瘤變的惡化,p53蛋白相對表達量越來越降低。有研究表明p53能夠促進細胞凋亡,促進染色體穩定,抑制上皮細胞永生化的惡性發展[12]。分子生物學研究表明HPV E6通過E6相關蛋白與p53結合,促進泛素介導的p53降解,引起細胞過度增殖[13]。
本研究直線相關分析顯示觀察組的高危型HPV陽性率與p53蛋白相對表達量呈現明顯負相關性(γ=-0.544,P<0.05)。多因素非條件logistic回歸分析顯示高危型HPV陽性、p53蛋白相對表達量都為導致外陰上皮瘤變的主要獨立危險因素(P<0.05)。外陰上皮內瘤變的程度與HPV DNA含量成正相關性,隨外陰上皮內瘤變病情的加重,高危型HPV感染率隨之升高。p53蛋白缺失可使黏附復合體中β-actin釋放至胞質,激活核內Wnt通路,誘導上皮細胞-間質轉化,誘發上皮性癌發生轉移復發。
總之,外陰上皮內瘤變患者伴隨有高危型HPV陽性率增加與p53蛋白表達下降,高危型HPV陽性率與p53蛋白相對表達有明顯相關性。

