食用鹽變色問題及檢測方法應用研究
◎ 馮婉瑩
(廣州檢驗檢測認證集團有限公司,廣東 廣州 510000)
食用鹽本應是白色的晶體,然而在采用碘酸鉀生產碘鹽的過程中,在白色的食用鹽晶體中添加了一定的碘劑或抗結劑,導致食用鹽的內部產生化學反應引發食用鹽變黃或變藍的現象,對于這一情況,我國的質量監督檢測中心開展了專門的研究,提出了食用鹽變色問題的解決方法和措施,并依據相關規定,進行碘鹽的檢測和測定。
1 食用鹽變色研究
當前我國的食用鹽生產制作過程中添加了碘酸鉀,它具有穩定性高、無須添加額外穩定劑的特點,替代了之前的碘化鉀。當采用碘酸鉀生產碘鹽的工藝時,因其添加碘劑或抗結劑而會產生化學反應,出現白色晶體變色的現象,這主要是由于我國既有的鹵水資源環境不相一致,鹵水之中含有碘化物及還原性物質,當地質結構發生改變的環境條件下,淺層天然鹵水滲入以原料鹵水中,導致原料鹵水中的還原性物質增加,色澤、成分均出現了轉變;加之部分生產廠家缺乏專門、有效的鹵水凈化處理工藝和技術,這就使碘酸鉀與鹵水中的還原性物質產生氧化還原反應,產生紫黑色晶體的單質碘,使食用鹽由白色的晶體變成黃色。
食用鹽變黃的現象,主要是添加了碘酸鉀及抗結劑而產生氧化還原反應所導致的,一些生產廠家采用提高鹽pH值的方式以緩解食用鹽變黃的現象,然而這并不能完全解決食用鹽變色的問題,食用鹽變色不僅與食用鹽的pH值有關,還受到還原性物質的種類、濃度的因素影響。因此,一些生產廠家不僅提高鹽的pH值,還在加碘的生產流程之中添加了大量的還原劑,在化學反應下將碘酸鉀轉變還原成碘化鉀,以改善食用鹽變色的現象,同時也付出了相對較大的成本代價。
鹽業系統加大了對食用鹽變色問題的研究,開設了專門研究鹵水凈化的課題,然而,對于鹵水中還原性物質的種類、作用機理卻并未了解和掌握,只是采用單純的鹵水凈化的方式,降低鹵水中的H2S含量以緩解食用鹽變色的問題,這是一種不夠科學的處理方法,加之要耗費大量的原料鹵水,也缺乏經濟合理性。
因此要轉變當前統一添加碘酸鉀的現狀,綜合考慮我國的具體情況,對于含有還原性物質鹵源的地區不應添加碘酸鉀,而應當選取碘化鉀,以達到緩解食用鹽變色的問題。事實上,國外大多數國家還是采用添加碘化鉀的方式生產食鹽,因其含碘量高、溶解性好易于為人體所吸收。
2 食用鹽中碘含量的檢測方法研究
對于食用鹽中的碘離子的檢測有幾種不同的測定方法,本文重點介紹直接滴定法和次氯酸鈉氧化還原滴定法兩種。在GB/T 13025.7-1999《制鹽工業通用試驗方法碘離子的測定》中明確規定了不同檢測方法的具體特點及適用范圍,以有效實現對食用鹽中碘離子的檢測。
2.1 直接滴定法
直接滴定法是食用鹽中碘檢測的第一法,它是氧化還原法的一種簡略,僅選取氧化還原法中的滴定步驟,而對氧化部分予以忽略不計,重點測定食用鹽中的碘酸根含量,即對食用鹽中的碘酸鉀的檢測。
直接滴定法是以淀粉為指示劑,淀粉添加時間和滴定終點的顏色都會影響滴定量的讀取,除重復性較差,直接滴定法還有如下缺陷:①沒有考慮食用鹽制作原料中以碘離子形式引入的碘,難以實現對其的測定。②沒有考慮食用鹽制作原料或生產過程中引入還原劑,對碘酸鉀部分或完全還原為碘離子的因素,無法實現對其的測定。然而,這種檢測方法相對快速和便捷,具有一定的應用價值和意義:由于食用鹽制作的原料含有極其微小的碘離子量值,通常為0~3 mg/kg,因而不會出現測定結果偏差過大的現象;加之食用鹽制作的原料及生產添加的還原劑,將碘酸鉀還原為碘離子的情形相對少見,因此可以在井礦鹽區適用直接滴定檢測法,實現對食用鹽中碘離子含量的測定[1]。
2.2 次氯酸鈉氧化還原滴定法
氧化還原滴定法也是檢測食用鹽中碘含量的一種測定方法,重點檢測各種價態碘離子的總量,在不同制作原料和碘劑的添加條件下,測定食用鹽中碘離子的含量。檢測原理為:食用鹽中的碘會在次氯酸鈉的作用下產生氧化反應,生成碘酸根,對其加熱,次氯酸鈉的過剩部分會被草酸破壞,而碘酸根則不會與草酸發生反應;添加碘化鉀將碘酸根還原成游離碘,再用硫代硫酸鈉標準溶液對其滴定,由此可以實現對食用鹽中碘離子含量的測定。在采用次氯酸鈉氧化還原滴定法的過程中,要注重和把握以下方面的內容。
(1)次氯酸鈉的測定方法。稱取精確度至0.001 g的3 g次氯酸鈉樣品,加入50 mL的水、2 g碘化鉀、10 mL冰乙酸,采用硫代硫酸鈉標準溶液滴定,以淀粉為指示劑,由藍色滴定為無色,進行空白試驗。
(2)次氯酸鈉的用量。次氯酸鈉具有極強的氧化性,在滴定檢測的實驗過程中,剩余的次氯酸鈉會被草酸所破壞,然而如果在測試中還殘留極其微量的次氯酸鈉,它就會與測定中加入的碘化鉀產生氧化還原反應,使滴入的碘化鉀氧化為碘酸鉀,并還原成游離碘,使測定中的碘含量超標,與食用鹽中的實際碘離子含量不相吻合和一致。為此,在采用次氯酸鈉氧化還原滴定法之中,必須嚴格保證加入1 mL5%次氯酸鈉溶液,并對檢測瓶壁清洗干凈,避免次氯酸鈉殘留。次氯酸鈉用量對測定結果的影響,如表1所示。

表1 次氯酸鈉用量對測定結果的影響表
由表1可知,草酸可以破壞低于1.5 mL的次氯化鈉,不會使測定值產生較大的偏差,而如果次氯化鈉的用量超出了1.5 mL,則無法被草酸破壞,會給測定結果帶來較大的偏差影響[2]。
(3)草酸-磷酸混合液的用量。草酸的適量添加有利于測定結果,然而過少或過量添加會影響測定結果,如果草酸添加過少,則無法破壞剩余的次氯酸鈉;如果草酸添加過多,則會與碘酸鉀產生還原反應,使碘酸鉀還原為碘化鉀,引發滴定試驗的誤差[3]。
直接滴定法和次氯酸鈉氧化還原法的對比試驗,結果見表2。
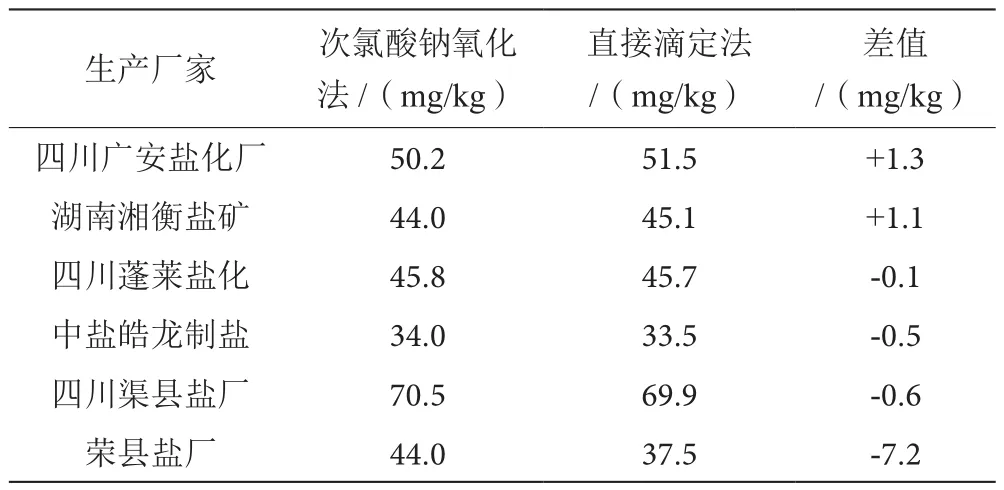
表2 直接滴定法、次氯酸鈉氧化還原法對比實驗表
3 食用鹽變藍的檢測
食用鹽變藍極易出現于潮濕、酸性的環境之中,它是鹵水中的鐵與生產中添加的抗結劑亞鐵氰化鉀產生化學反應,生成藍色的水不溶物而出現的。
(1)K4[Fe(CN)6]的檢測方法。通常選取快速便捷、精密度高的硫酸亞鐵分光光度法,以實現對3~100μg/50 mL的K4[Fe(CN)6]的檢測。
(2)抗結劑亞鐵氰鐵鉀的檢測。由于Fe4[Fe(CN)6]3不溶于水和酸,但溶于堿,可以在檢測中加入0.6 mL的氫氧化鈉溶液,藍鹽中的亞鐵氰根溶于氫氧化鈉溶液之中,過濾剔除Fe(OH)3,然后再加入硫酸亞鐵,即可以檢測出藍鹽中的亞鐵氰化鉀含量。這種檢測方法的公式為:
Fe4[Fe(CN)6]3+12NaOH=3Na4[Fe(CN)6]+4Fe(OH)3
綜上所述,食用鹽變色現象要分析其產生的機理,并采用不同的檢測方法實現對食用鹽中碘的測定,掌握不同檢測方法的反應原理和應用范圍,通過檢測方法的合理應用,準確地獲悉食用鹽中的碘含量。

