懸鈴木方翅網蝽非典型氣味受體基因CcilOrco的克隆與序列分析
董 敏, 杜立嘯, 袁洪振, 夏延穎, 司軍紅, 董文慧
(1. 山東鴻林工程技術有限公司, 濟南 250101; 2. 中國農業科學院植物保護研究所, 北京 100193)
懸鈴木方翅網蝽Corythuchaciliata屬半翅目網蝽科,原分布于北美和加拿大中東部[1],1964年經意大利在歐洲迅速蔓延[2-3]。目前在南美洲、亞洲和澳洲也已發現大面積為害現象[4-5]。我國在2006年于武漢首次發現懸鈴木方翅網蝽,隨后在上海、杭州、南京、重慶、武漢等長江流域多個城市發生危害,形成了暴發態勢[6]。國家林業局隨即將懸鈴木方翅網蝽增列入我國林業危險性有害生物名單,并要求各地監測和防治。懸鈴木方翅網蝽具有傳播速度快、為害嚴重等特點,被認為是危險入侵物種,一旦傳入到新的地區,短時間內可形成穩定的高密度種群[7-10],成為入侵地懸鈴木的常發性主要害蟲[11-13],暴發時難以控制[14]。懸鈴木是我國常見的城市綠化植物,廣泛種植于中東部地區,具有特殊的美化和人文價值,懸鈴木方翅網蝽嚴重影響著城市形象,給居民生活和城市管理帶來了巨大困擾,因此急需尋找一種安全有效的防治方法。
嗅覺對昆蟲的生存繁衍至關重要,它在昆蟲尋找食物、配偶、產卵和發育場所、躲避敵害等方面發揮重要作用[15-16]。氣味受體(odorant receptor)是嗅覺系統的關鍵成分之一,是了解昆蟲化學信號分子識別機制的重要基礎[17-19],對氣味受體的研究可為懸鈴木方翅網蝽的防治提供新的思路和途徑。本研究采用RT-PCR技術,克隆獲得懸鈴木方翅網蝽CcilOrco基因,利用生物信息學技術對其序列進行分析,并與其他昆蟲Orco基因同源性進行了比較,以期為進一步研究懸鈴木方翅網蝽嗅覺通訊分子機制和尋求新的懸鈴木方翅網蝽防治技術提供理論依據。
1 材料與方法
1.1 供試樣本與試劑
懸鈴木方翅網蝽成蟲采自山東省濟南市歷城區郭店鎮相公莊區域山東鴻林工程技術有限公司的苗圃園內。將采集到的成蟲存放于白色透明塑料盒中,用新鮮懸鈴木葉片飼喂,放置于人工培養箱中,溫度(27±1)℃、濕度60%。取300頭成蟲的觸角,用鑷子將其頭和觸角一同夾下,立刻置于液氮中研磨至粉狀,轉入裝有1 mL TRIzol的EP管中,-70℃保存至RNA提取。
總RNA提取試劑TRIzol購自Invitrogen公司;First Strand cDNA Synthesis Kit購自Fermentas公司;PCR試劑購自TaKaRa公司;普通瓊脂糖膠回收試劑盒、感受態細胞、pEASY-Blunt Vector、抗生素類、X-gal、IPTG均購自全式金生物技術有限公司;GoTaq qPCR Master Mix購自Promega公司;其他均為國產或進口分析純試劑;引物合成、測序由華大基因生物技術公司完成。
1.2 引物設計
根據GenBank 中已發表的半翅目昆蟲中黑盲蝽Adelphocorissuturalis(GenBank: KC881257)、綠盲蝽Apolyguslucorum(GenBank: KC881255)、豆莢草盲蝽Lygushesperus(GenBank: JQ639213)、美國牧草盲蝽Lyguslineolaris(GenBank: JQ639214)等非典型氣味受體家族基因的氨基酸保守序列,設計擴增懸鈴木方翅網蝽CcilOrco基因的簡并引物,上游引物:5′-ATGATGACCAARGTGAARGC-3′;下游引物:5′-TTAYTTGAGYTGTAYCAAYACCATG-3′。
1.3 總RNA提取和cDNA的合成
使用TRIzol試劑提取1.1節中收集的懸鈴木方翅網蝽成蟲頭部和觸角的總RNA,提取步驟參照說明書。提取的總RNA濃度和質量通過NanoDrop-2000(NanoDrop Products)和瓊脂糖凝膠電泳檢測。取1 μg總RNA,以Oligo dT為引物合成cDNA,試驗操作依照First Strand cDNA Synthesis Kit使用手冊。
1.4 基因克隆
以懸鈴木方翅網蝽頭部及觸角cDNA為模板,利用簡并引物擴增CcilOrco的完整開放閱讀框序列。反應體系為:2×PrimeStar Premix 25 μL,cDNA 2 μL,上下游引物(10 μmol/L)各2 μL,ddH2O補充至50 μL。混勻,短暫離心,放入PCR儀中進行擴增。反應條件:94℃預變性5 min;接著進行35個循環,循環條件為94℃ 15 s,55℃ 20 s,72℃ 45 s;最后72℃延伸5 min。將產物于1%的瓊脂糖凝膠上進行電泳檢測。將回收的PCR產物連接到pEASY-Blunt克隆載體并測序。
1.5 序列分析
通過DNAMAN、Gendoc等軟件對測序獲得的懸鈴木方翅網蝽CcilOrco基因核苷酸序列及其編碼的氨基酸序列進行分析;利用NCBI上BLAST工具進行同源性比對;使用EXPASY(Expert Protein Analysis System,http:∥www.expasy.org)的Translate tool(http:∥web.expasy.org/translate)將核酸序列翻譯成氨基酸序列,通過Compute pI/Mw工具(http:∥web.expasy.org/compute_pi/)預測蛋白分子量和等電點。使用TMHMM(http:∥www.cbs.dtu.dk /services /TMHMM)進行跨膜結構域預測。使用Mega 6.0采用鄰接法(neighbor-joining method)構建進化樹,分支的支持率通過bootstrap驗證,重復次數1 000。
1.6 CcilOrco 基因表達分析
為了明確CcilOrco基因在雌雄成蟲不同部位表達量的差異,我們利用qPCR對該基因在雌雄成蟲觸角、頭(去除觸角)、胸、腹、足中的表達情況進行了分析。根據獲得的CcilOrco基因的核酸序列,利用Primer 5設計特異引物,上游引物:5′-CTTCTGTTTCATTCGTCATATTTGCC-3′;下游引物:5′-ATCGTTTCCATCCCCATTGGTA-3′。內參基因選用β-actin(GenBank: KX108734) 基因,上游引物:5′-CCAAGGCCAACAGAGAAAAGAT-3′;下游引物:5′-GATGGGCACAGTGTGGGAAA-3′。
收集200頭雌、雄成蟲的觸角, 200頭雌、雄成蟲的頭(去除觸角), 100頭雌、雄成蟲的胸,50頭雌、雄成蟲的腹,50頭雌、雄成蟲的足,液氮中研磨至粉狀,轉入裝有1 mL TRIzol的EP管中,-70℃保存至RNA提取,RNA提取的方法步驟同1.1。所有部位均取 1 μg 的RNA進行cDNA 的合成,具體步驟同1.3。qPCR反應體系為:GoTaq qPCR Master Mix 10 μL,上下游引物(10 μmol/L)各0.8 μL,cDNA 1 μL,無RNA酶的H2O 7.4 μL。反應程序為:95 °C,2 min; 95 °C,15 s,60 °C,50 s,循環數為40。整個反應在ABI 7500 Fast平臺上完成。將雌性成蟲觸角cDNA以10倍濃度進行梯度稀釋,共8個濃度,并以此為模板進行qPCR擴增,以確定引物的特異性及擴增效率。每個部位獨立重復3次。數據采用2-ΔΔCT法進行處理,采用SPSS 16.0進行ANOVA比較不同組織間CcilOrco基因表達量的差異(LSD,P<0.05)。
2 結果與分析
2.1 懸鈴木方翅網蝽氣味受體基因CcilOrco序列分析
通過基因克隆獲得懸鈴木方翅網蝽氣味受體基因的序列,命名為CcilOrco(GenBank:MF564288)。如圖1所示。
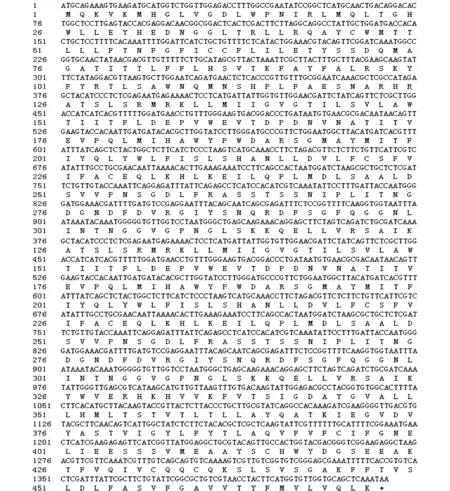
圖1 懸鈴木方翅網蝽CcilOrco核苷酸序列及推導的氨基酸序列Fig.1 Nucleotide and amino acid sequences of the gene CcilOrco in Corythucha ciliate
CcilOrco開放閱讀框長1 419 bp,編碼472個氨基酸。預測其分子量為53.25 kD,等電點為6.22。利用TMHMM 2.0蛋白跨膜結構預測軟件分析,獲得的序列具有7個α螺旋跨膜區(圖2),跨膜區氨基酸的位置是47-69,74-96,135-157,204-226,344-366,376-398 和446-468,是一個典型的G蛋白偶聯受體,序列N-端在細胞膜內,C-端在細胞膜外。
2.2 懸鈴木方翅網蝽CcilOrco基因氨基酸同源性比較
選取半翅目昆蟲綠盲蝽(AlucOrco:KC881255)、美國牧草盲蝽(LlinOrco:JQ639214);雙翅目昆蟲黑腹果蠅Drosophilamelanogaster(DmelOrco: AY567998)、岡比亞按蚊Anophelesgambiae(AgamOrco: AY843205);鱗翅目昆蟲黃地老虎Agrotissegetum(AsegOrco:
KC526964)、桃蛀螟Conogethespunctiferalis(CpunOrco: JX101681)與懸鈴木方翅網蝽CcilOrco基因進行序列比對分析,結果顯示,這8種昆蟲的Orco受體的C端序列具有高度的保守性(圖3)。
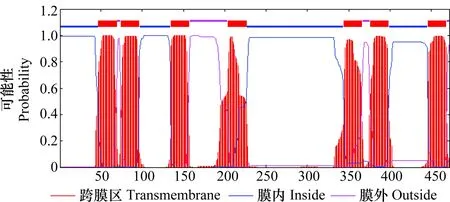
圖2 懸鈴木方翅網蝽CcilOrco的跨膜結構預測Fig.2 The predicted transmembrane domains of the olfactory co-receptor CcilOrco from Corythucha ciliate
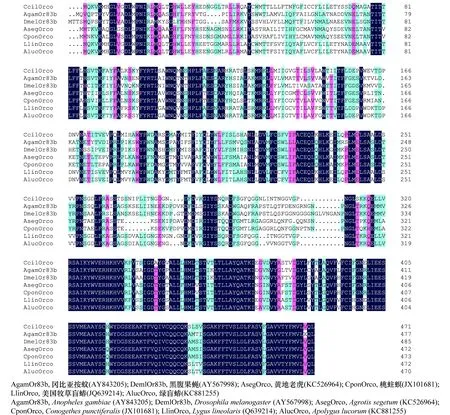
圖3 懸鈴木方翅網蝽CcilOrco與其他昆蟲氣味受體蛋白的序列比對Fig.3 Sequence alignment of Corythucha ciliate CcilOrco with olfactory receptors in other insects
為研究懸鈴木方翅網蝽CcilOrco與其他物種之間的進化關系,利用Mega 6.0軟件鄰接法構建半翅目、鱗翅目、膜翅目、鞘翅目、直翅目、雙翅目部分昆蟲非典型氣味受體的系統進化樹(圖4)。結果顯示,24個非典型嗅覺受體基因分成2個大的分支,不同目之間氨基酸序列差異較大,同一目昆蟲之間差異較小;懸鈴木方翅網蝽CcilOrco與麥長管蚜SaveOrco、綠盲蝽AlucOrco、豆莢草盲蝽LhesOrco、美國牧草盲蝽LlinOrco聚為一類,它們都屬于半翅目昆蟲非典型氣味受體,相似性較高。而與其他目昆蟲遺傳距離較遠,相似性很低。

圖4 懸鈴木方翅網蝽與其他昆蟲Orco氨基酸的系統發育樹Fig.4 Phylogenetic tree of Corythucha ciliate Orcos and those from other insects based on amino acid sequence
2.3 懸鈴木方翅網蝽CcilOrco基因在不同部位表達分析
采用qPCR對懸鈴木方翅網蝽CcilOrco基因在雌雄成蟲不同部位的表達情況進行了比較分析。以雌成蟲觸角不同濃度的cDNA為模板,進行qPCR,根據CT值得到懸鈴木方翅網蝽CcilOrco基因和β-actin基因的標準曲線,其相關系數r分別為0.999 6和0.999 7,擴增效率分別為102%和103%,符合試驗的要求。
以雌蟲和雄蟲足中CcilOrco基因的表達量為1,分別對雌蟲和雄蟲其他部位中獲得的數據進行處理。結果顯示,CcilOrco基因在雌性和雄性成蟲之間表達模式一致,均在觸角中表達量最高,顯著高于其他部位;其次為頭部,在胸、腹和足中的表達量最低,且三者之間不存在顯著性差異(圖5)。
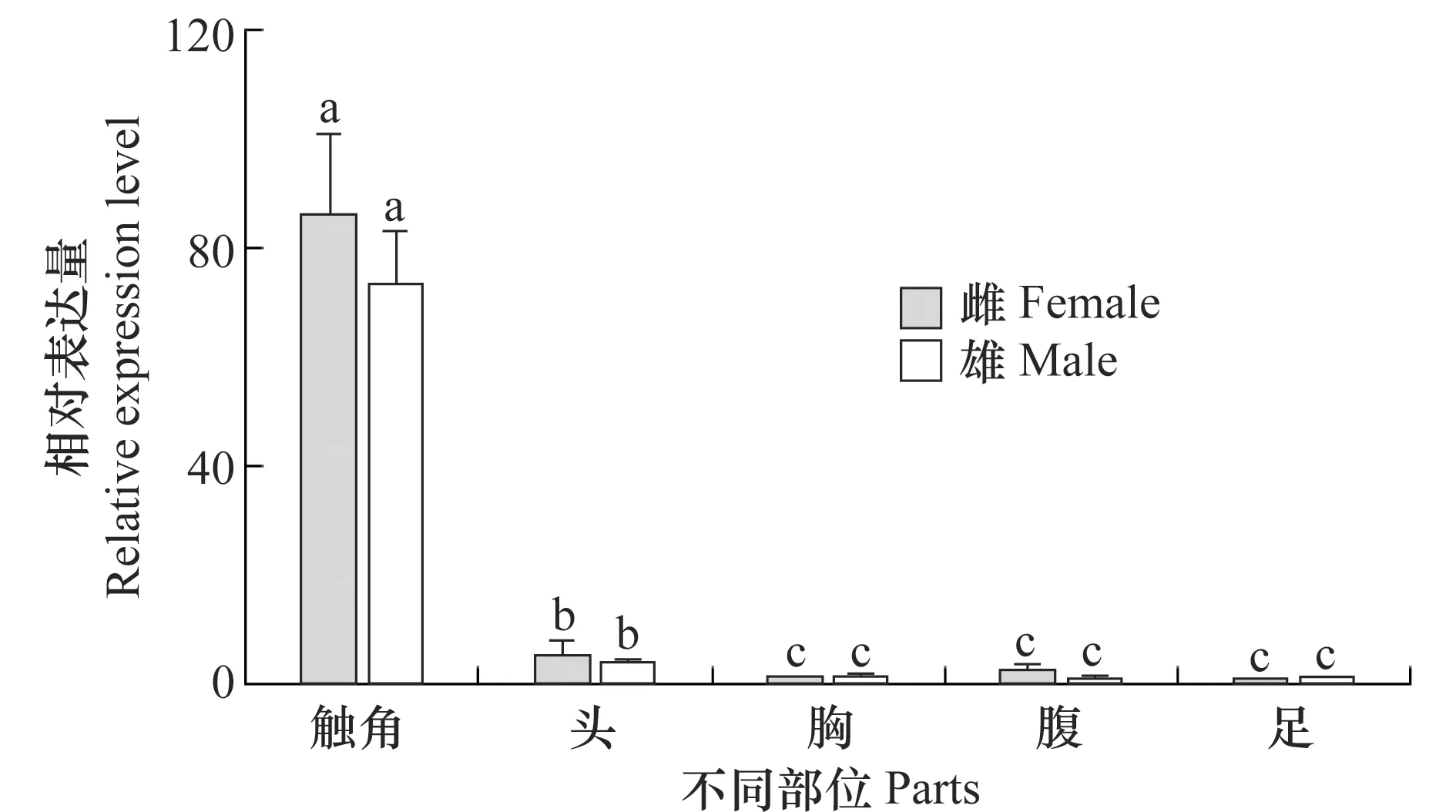
圖5 懸鈴木方翅網蝽CcilOrco的表達分析Fig.5 Expression profile of CcilOrco in different parts of Corythucha ciliate
3 結論與討論
目前,隨著測序技術的發展,多種昆蟲的觸角轉錄組被測定出來,利用昆蟲各物種之間的保守區域進行同源克隆的方法,已從鱗翅目、雙翅目、膜翅目、鞘翅目、直翅目等8個目的多種昆蟲發現了非典型氣味受體基因,并且在不同昆蟲之間其序列相似性很高。本研究通過RT-PCR技術獲得懸鈴木方翅網蝽CcilOrco基因的cDNA序列,其編碼的氨基酸序列與半翅目昆蟲麥長管蚜SaveOrco、綠盲蝽AlucOrco、豆莢草盲蝽LhesOrco、美國牧草盲蝽LlinOrco等同源性水平很高,與雙翅目等昆蟲的非典型氣味受體也有高的同源性,這些都與Orco基因在不同昆蟲體內的保守性相吻合。通過qPCR發現CcilOrco基因主要在雌雄成蟲觸角中高表達,在去除觸角的頭部表達量同樣顯著高于胸、腹和足等非嗅覺組織。這可能和其與ORx的共表達有關,目前的研究發現,絕大部分ORx主要在觸角、喙、下唇須等嗅覺組織中表達。
Orco與普通氣味受體ORx共表達,形成一個異源二聚體結構,這樣可以極大地提高ORx對氣味的結合反應能力,但它對ORx的配體結合范圍并無任何影響[20-22]。Larsson等[23]敲除果蠅Orco后發現,果蠅對大部分氣味的電生理反應喪失,同時這些氣味也無法引起果蠅相應的行為反應;但進行基因營救試驗后,果蠅對這些氣味的電生理反應和行為反應又得到了恢復。類似的研究在赤擬谷盜、黃曲條跳甲等昆蟲的Orco中也得到了相似的結果[24]。Orco在昆蟲嗅覺識別過程中發揮著重要的作用,但其本身并不與任何配體結合。在對果蠅Or22a/b基因突變體中,只表達Orco的嗅覺神經神經元對測試的氣味化合物無任何生理學反應[25]。
目前已被證實,VUAAI是Orco的興奮劑,它可以通過激活Orco從而激發幾乎所有嗅覺神經元的活性,進而喪失對不同氣味物質的區分,抑制昆蟲嗅覺誘發的行為反應[26]。隨后的研究也發現了多種Orco的抑制劑[27-28],這些研究為以Orco為靶標的害蟲防治提供了基礎。本研究對懸鈴木方翅網蝽氣味受體CcilOrco基因的成功克隆,為懸鈴木方翅網蝽的防控提供新的理論基礎,具有重要的實踐意義。

