小型豬腹腔鏡肝缺血再灌注合并肝部分切除對肝細胞凋亡及相關(guān)基因影響的研究
張千振, 葛延松, 焦智慧, 李 輝, 白 鴿, 張建濤, 王洪斌
(東北農(nóng)業(yè)大學(xué)動物醫(yī)學(xué)學(xué)院, 黑龍江 哈爾濱 150030)
缺血再灌注損傷(IRI)是一種多因素參與的病理生理過程。肝臟是血供豐富和存在大量內(nèi)皮細胞的器官,因此肝臟對缺血再灌注損傷非常敏感。肝臟缺血再灌注損傷(HIRI)是肝臟術(shù)后肝功能衰竭的重要因素之一,它多見于肝臟外科手術(shù)過程中,如肝部分切除術(shù)及肝移植術(shù)等[1]。研究表明,肝臟缺血再灌注損傷導(dǎo)致的細胞死亡,包括細胞壞死和細胞凋亡[2]。細胞凋亡是由特定的凋亡基因調(diào)控的程序性死亡,在維持機體內(nèi)環(huán)境穩(wěn)態(tài)和機體發(fā)育中至關(guān)重要[3]。腹腔鏡技術(shù)具有切口小、損傷輕、恢復(fù)快的特點,并且成功應(yīng)用于肝臟外科手術(shù)中。目前腹腔鏡肝切除手術(shù)過程中缺血再灌注損傷對細胞凋亡的影響迄今未見報道,本研究應(yīng)用腹腔鏡技術(shù)建立小型豬肝臟缺血再灌注合并肝部分切除損傷模型,并檢測凋亡相關(guān)基因Bax、Bcl-2 mRNA的表達及Caspase-3、Caspase-9酶活性,分析小型豬腹腔鏡肝損傷與細胞凋亡的關(guān)系,為探討缺血再灌注損傷的發(fā)病機制和保護性研究提供理論依據(jù)。
1 材料與方法
1.1 實驗動物 廣西巴馬小型豬12頭,4~6月齡,體重25~35 kg,經(jīng)實驗室和臨床檢查健康,整個試驗過程中飼養(yǎng)管理環(huán)境一致。
1.2 主要設(shè)備與試劑 腹腔鏡手術(shù)基本設(shè)備,Olympus 公司生產(chǎn);左彎分離鉗、直角分離鉛、無損傷腸鉗、彎頭剪刀、單極電凝球、單極電凝鉤、沖洗/吸引管,杭州光典公司生產(chǎn);IntelliiVue MP30型重癥監(jiān)護儀,德國Philips公司生產(chǎn);小型豬復(fù)合麻醉劑(XFM),東北農(nóng)業(yè)大學(xué)獸醫(yī)外科教研室配制;丙泊酚注射液,西安力邦制藥有限公司,批號1404271;硫酸阿托品注射液,新鄉(xiāng)市常樂制藥有限責(zé)任公司,批號1605047 2;酚磺乙胺注射液,新鄉(xiāng)市常樂制藥有限責(zé)任公司,批號1605297 3;TRIZol試劑購自美國Invitrogen公司;反轉(zhuǎn)錄試劑盒,購自東洋紡;引物購自上海生工生物工程技術(shù)服務(wù)有限公司;Caspase-3和Caspase-9活性檢測試劑盒,均為碧云天生物技術(shù)研究所生產(chǎn);TUNEL凋亡檢測試劑盒,購自美國羅氏公司。
1.3 手術(shù)方法 將12頭巴馬小型豬隨機分為假手術(shù)組(Sham組)和模型組(IRI組)。假手術(shù)組僅建立氣腹60 min,模型組進行腹腔鏡右半肝缺血60 min+左半肝切除。術(shù)前禁食24 h,禁水12 h。麻醉前肌肉注射硫酸阿托品注射液(0.04 mg/kg·bw),15 min后耳緣靜脈注射小型豬復(fù)合麻醉劑(0.02 mL/kg·bw)、丙泊酚注射液(0.5 mL/kg·bw)進行誘導(dǎo)麻醉。完成氣管插管后,連接呼吸麻醉機,呼吸頻率為15~20次/min,吸呼比為1∶2,潮氣量為10~15 mL/kg·bw,異氟烷維持麻醉,濃度維持在2.5%~4%。小型豬仰臥保定,術(shù)部剃毛、消毒、鋪蓋創(chuàng)巾。
腹腔鏡右半肝缺血60 min+左半肝切除組(I/R組):采用四套管法建立氣腹和手術(shù)通路,通入CO2維持氣腹壓在10 mmHg。在腹腔鏡視野下切斷肝圓韌帶、鐮狀韌帶、左右三角韌帶及冠狀韌帶,充分游離肝葉。首先助手用腸鉗將右肝內(nèi)葉提起,術(shù)者利用左彎分離鉗和直分離鉗將膽囊管和膽囊動脈與肝實質(zhì)充分分離,同時將自制止血帶從膽囊管和膽囊動脈底部穿過,穿過右內(nèi)葉基部;另一根止血帶同樣穿過右外葉基部,同時收緊兩條止血帶,持續(xù)阻斷右半肝入肝血流60 min。缺血結(jié)束后,松開卡扣,撤出兩條止血帶,恢復(fù)右半肝血供,同時進行左半肝切除。在左內(nèi)葉與右內(nèi)葉分界線(肝中裂)用帶線雙針三排貫穿結(jié)扎肝實質(zhì),每排3~4針。用電凝球在結(jié)扎線左側(cè)1~2 cm處做一預(yù)切線,并用電凝鉤在預(yù)切線處離斷肝實質(zhì),將左內(nèi)葉和左外葉全部切除。檢查斷面有無出血點,利用電凝球和紗布止血,用沖洗器沖洗腹腔。將自封袋送入腹腔,切除的肝組織及止血帶和卡扣裝入袋內(nèi),擴大套管腹壁切口至4 cm左右,將自封袋從腹腔取出,關(guān)閉氣腹。在腹底部套管放置1根引流管,并在體外固定,按常規(guī)手術(shù)操作閉合腹腔,切口周圍涂碘酊消毒。
1.4 樣本采集及指標檢測
1.4.1 樣本采集及處理 各組分別于術(shù)前、術(shù)后即刻、術(shù)后1、3、7 d采集肝組織樣本,將肝組織分成2份:一份肝組織分裝置于凍存管并放入液氮中保存;另1份肝組織置于多聚甲醛固定液中固定,然后行常規(guī)脫水、浸蠟、包埋等處理。
1.4.2 酶活性檢測 根據(jù)Caspase-3、9活性檢測試劑盒說明書,應(yīng)用酶標儀檢測各組織樣本的OD值(405nm),根據(jù)標準曲線計算各樣本Caspase-3、Caspase-9酶活性。
1.4.3 qRT-PCR檢測Bax、Bcl-2 mRNA的表達 TRIZol法提取肝組織總RNA,實時熒光定量PCR試劑盒進行反轉(zhuǎn)錄和PCR反應(yīng)。Bax、Bcl-2及β-actin 引物根據(jù)GenBank中相應(yīng)基因序列設(shè)計,Bax引物序列:上游引物:5′-TTCAGGGTTTCATCCAGGATCG-3′,下游引物:5′-ATCCTCTGCAGCTCCATGTTAC-3′;Bcl-2引物序列:上游引物:5′-GAGGATTGTGGCCTTCTTTG-3′,下游引物:5′-GCCGGTTCAGGTACTCAGTC-3′;β-actin引物序列:上游引物:5′-TCTGGCAACCACACCTTCT-3′,下游引物:5′-TGATCTGGGTCATCTTCTCAC-3′。反應(yīng)體系為10 μL,反應(yīng)條件為95 ℃預(yù)變性15 s;擴增95 ℃ 15 s,60 ℃ 60 s,60 ℃ 30 s共40個循環(huán),采用2-ΔΔCt法計算相對表達量。
1.4.4 肝細胞凋亡的檢測 各時間點采集肝組織并置于10%多聚甲醛固定液中,24 h后石蠟包埋并切片,按標準操作脫蠟和再水化組織。采用微波照射進行抗原修復(fù),PBS沖洗2次后,將TUNEL反應(yīng)混合液滴加在樣品上,置于濕盒中避光孵育60 min(37 ℃)。PBS沖洗3次,滴加辣根過氧化物酶標記的POD,濕盒中避光孵育30 min(37 ℃)。PBS沖洗3次,加入DAB顯色,蘇木素復(fù)染后封片。光學(xué)顯微鏡觀察(400倍)顯示細胞核為棕黃色為陽性細胞。每張切片選擇5個視野觀察凋亡情況,并計算出肝細胞凋亡指數(shù)(AI)。肝細胞凋亡指數(shù)計算公式:AI=凋亡細胞數(shù)/肝細胞總數(shù)×100%。

2 結(jié)果
2.1 TUNEL染色結(jié)果 組間比較,兩組AI在術(shù)后即刻差異顯著(P<0.01或P<0.05),術(shù)后1 d、3 d差異極顯著(P<0.01)。兩組術(shù)后AI均呈現(xiàn)先升高后降低的趨勢。假手術(shù)組在術(shù)后即刻與術(shù)前相比差異顯著(P<0.01或P<0.05),術(shù)后1 d與術(shù)前相比差異極顯著(P<0.01)。模型組在術(shù)后即刻、術(shù)后1 d、3 d與術(shù)前相比差異極顯著(P<0.01),在術(shù)后1 d達到峰值,見封二彩版圖1及表1。
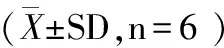
表1 不同時間點兩組肝細胞AI的變化
注:與術(shù)前相比,*表示差異顯著(P<0.01或P<0.05),**表示差異極顯著(P<0.01);模型組與假手術(shù)組相比,#表示差異顯著(P<0.01或P<0.05),##表示差異極顯著(P<0.01),下表同
2.2 肝組織Bax、Bcl-2 mRNA表達的變化
2.2.1 Bax mRNA表達水平 組間比較,兩組Bax mRNA表達在術(shù)后即刻、術(shù)后1 d、3 d差異極顯著(P<0.01)。兩組術(shù)后Bax mRNA表達均呈現(xiàn)先升高后降低的趨勢。假手術(shù)組在術(shù)后即刻與術(shù)前相比差異極顯著(P<0.01),其余時間點差異不顯著(P>0.05)。模型組在術(shù)后即刻、術(shù)后1 d、3 d與術(shù)前相比差異極顯著(P<0.01),在術(shù)后1 d達到峰值,見表2。
2.2.2 Bcl-2mRNA表達水平 組間比較,兩組Bcl-2 mRNA表達在術(shù)后即刻、術(shù)后1 d、3 d差異極顯著(P<0.01)。假手術(shù)組在術(shù)后即刻與術(shù)前相比差異極顯著(P<0.01),其余時間點差異不顯著(P>0.05)。模型組Bcl-2 mRNA 表達呈現(xiàn)先降低后升高的趨勢,在術(shù)后即刻、術(shù)后1 d與術(shù)前相比差異極顯著(P<0.01),在術(shù)后即刻達到最低值,見表2。
2.2.3 Bax/Bcl-2比值 組間比較,兩組Bax/Bcl-2比值在術(shù)后即刻、術(shù)后1 d、3 d差異極顯著(P<0.01)。假手術(shù)組在術(shù)后1 d與術(shù)前相比差異極顯著(P<0.01),其余時間點差異不顯著(P>0.05)。模型組Bax/Bcl-2比值表達水平均呈現(xiàn)先升高后降低的趨勢,在術(shù)后即刻、術(shù)后1 d、3 d與術(shù)前相比差異極顯著(P<0.01),在術(shù)后1 d達到峰值,見表2。

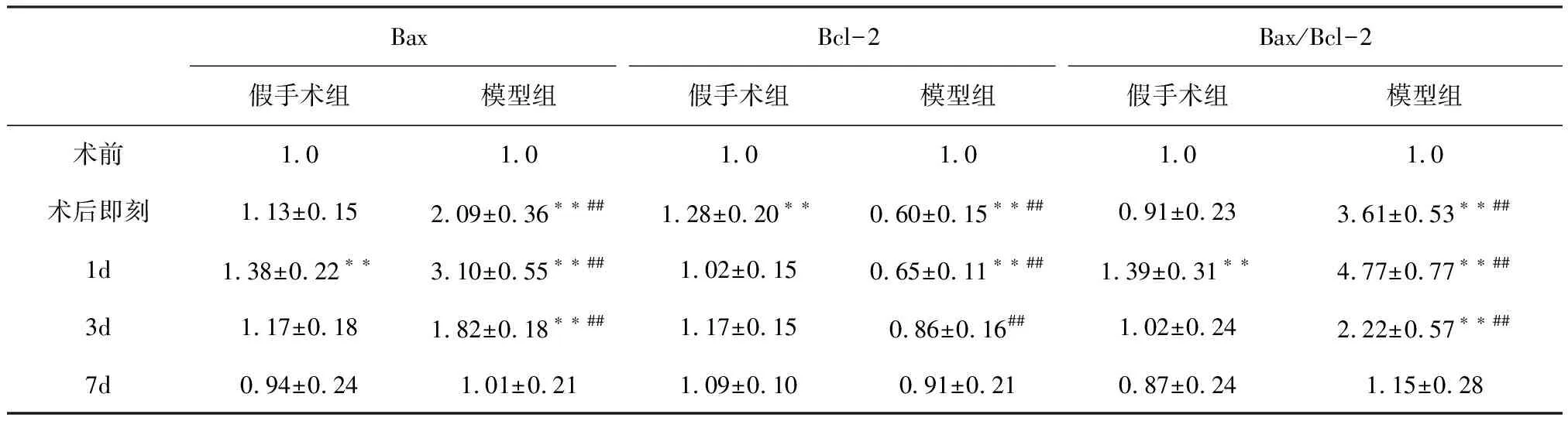
BaxBcl-2Bax/Bcl-2假手術(shù)組模型組假手術(shù)組模型組假手術(shù)組模型組術(shù)前1.01.01.01.01.01.0術(shù)后即刻1.13±0.152.09±0.36??##1.28±0.20??0.60±0.15??##0.91±0.233.61±0.53??##1d1.38±0.22??3.10±0.55??##1.02±0.150.65±0.11??##1.39±0.31??4.77±0.77??##3d1.17±0.181.82±0.18??##1.17±0.150.86±0.16##1.02±0.242.22±0.57??##7d0.94±0.241.01±0.211.09±0.100.91±0.210.87±0.241.15±0.28
2.3 肝組織Caspase-3、Caspase-9活性變化
2.3.1 Caspase-9活性 組間比較,兩組Caspase-9活性在術(shù)后即刻、1 d、3 d差異極顯著(P<0.01)。兩組術(shù)后Caspase-9活性均呈現(xiàn)先升高后降低的趨勢。假手術(shù)組在術(shù)后1 d與術(shù)前相比差異極顯著(P<0.01),其余時間點無顯著差異(P>0.05)。模型組在術(shù)后即刻、術(shù)后1 d與術(shù)前相比差異極顯著(P<0.01),在術(shù)后1 d達到峰值。見表3。
2.3.2 Caspase-3活性 組間比較,兩組Caspase-3活性在術(shù)后1 d、3 d差異極顯著(P<0.01)。兩組術(shù)后Caspase-3活性均呈現(xiàn)先升高后降低的趨勢。假手術(shù)組在術(shù)后1 d與術(shù)前相比差異極顯著(P<0.01),其余時間點無顯著差異(P>0.05)。模型組在術(shù)后即刻與術(shù)前相比差異顯著(P<0.01或P<0.05),術(shù)后1 d、3 d與術(shù)前相比差異極顯著(P<0.01),在術(shù)后1 d達到峰值,見表3。
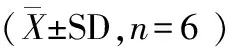
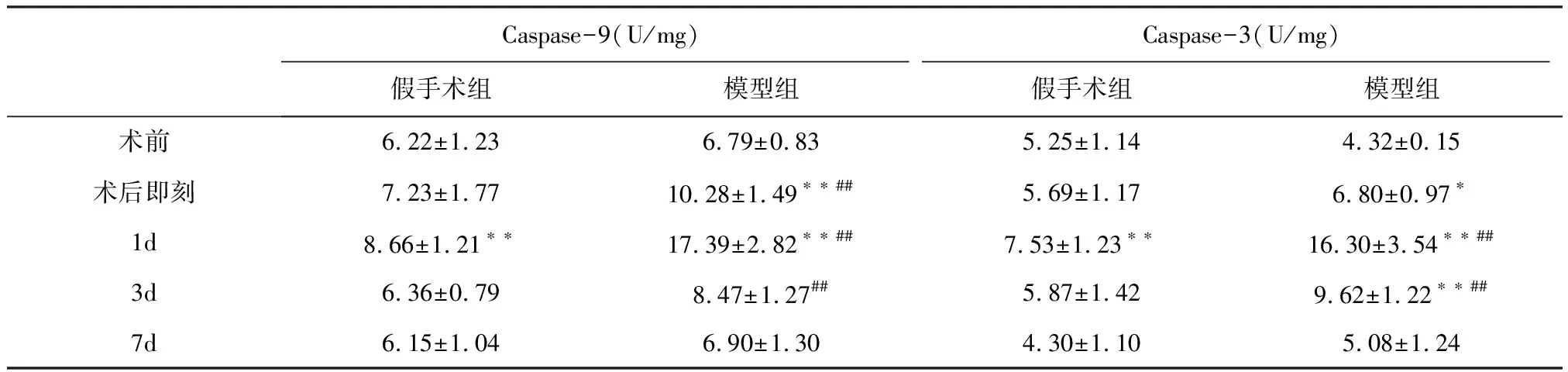
Caspase-9(U/mg)Caspase-3(U/mg)假手術(shù)組模型組假手術(shù)組模型組術(shù)前6.22±1.236.79±0.835.25±1.144.32±0.15術(shù)后即刻7.23±1.7710.28±1.49??##5.69±1.176.80±0.97?1d8.66±1.21??17.39±2.82??##7.53±1.23??16.30±3.54??##3d6.36±0.798.47±1.27##5.87±1.429.62±1.22??##7d6.15±1.046.90±1.304.30±1.105.08±1.24
3 討論
自1991年Reich等[4]報道了腹腔鏡肝良性腫瘤切除以來,腹腔鏡技術(shù)在肝臟外科領(lǐng)域的應(yīng)用迅速發(fā)展。目前應(yīng)用腹腔鏡技術(shù)可完成半肝切除術(shù)、擴大半肝切除術(shù)、巨大腫瘤切除術(shù)及活體肝移植供肝切除術(shù)等[5]。肝臟是血供比較豐富的器官,肝臟手術(shù)過程中出血的控制非常關(guān)鍵。Pringle法對于入肝血流阻斷最為常見,止血效果好、操作簡單,但是此法容易導(dǎo)致缺血再灌注損傷[6]。近年來研究表明,組織、器官缺血再灌注損傷可誘導(dǎo)細胞凋亡,認為細胞凋亡是缺血再灌注損傷的機制之一[7-9]。
本研究中通過TUNEL法檢測肝細胞凋亡,發(fā)現(xiàn)模型組凋亡細胞明顯高于假手術(shù)組,證實了小型豬腹腔鏡肝臟缺血再灌注合并肝部分切除損傷可誘導(dǎo)肝細胞凋亡的發(fā)生。研究表明,細胞凋亡主要通過受體途徑、內(nèi)質(zhì)網(wǎng)途徑和線粒體途徑發(fā)生,后者受線粒體膜通透性的調(diào)控[10]。Bcl-2基因家族包括促凋亡因子(Bax,Bak,Bid)和抗凋亡因子(Bcl-2,Bcl-xl,Bcl-w),在線粒體凋亡途徑中發(fā)揮重要的作用。Bax是Bcl-2家族中重要的促凋亡基因,具有頡頏Bcl-2的作用,Bax與Bcl-2的比值決定細胞受刺激后是否發(fā)生凋亡[11]。當Bax相對表達量高于Bcl-2時,Bax可通過改變線粒體膜通透性促進細胞色素c釋放到細胞漿中,引發(fā)Caspase級聯(lián)反應(yīng)并活化Caspase-3,導(dǎo)致細胞凋亡[12]。本研究發(fā)現(xiàn),模型組術(shù)后即刻、1 d、3 d Bax mRNA表達水平較術(shù)前顯著升高,在術(shù)后1 d達到峰值,且顯著高于假手術(shù)組;模型組術(shù)后即刻、1 d Bcl-2 mRNA表達水平較術(shù)前顯著降低,且顯著低于假手術(shù)組。宋曉靜[13]等研究發(fā)現(xiàn),大鼠肝臟缺血60 min,恢復(fù)血液供應(yīng)2 h后Bcl-2 mRNA表達水平較假手術(shù)組顯著降低,Bax mRNA水平較假手術(shù)組顯著升高。Jin[14]等將大鼠肝臟血流阻斷30 min后,檢測再灌注1 h,2 h,6 h,24 h Bax和Bcl-2 mRNA表達水平,發(fā)現(xiàn)再灌注后Bcl-2 mRNA表達隨著再灌注時間的延長逐漸降低,Bax mRNA表達隨著再灌注時間的延長逐漸升高。結(jié)合本研究結(jié)果,提示Bax和Bcl-2參與小型豬腹腔鏡肝損傷中肝細胞凋亡的調(diào)控。
Caspase家族通過一系列級聯(lián)反應(yīng)參與細胞凋亡的調(diào)控,包括凋亡啟動子(Caspase-2、8、9)和凋亡執(zhí)行因子(Caspase-3、6、7)。凋亡啟動子處于級聯(lián)反應(yīng)的上游,活化后進一步激活下游的凋亡執(zhí)行因子,通過作用于特異性底物誘導(dǎo)細胞凋亡[15]。Dirk等[16]研究發(fā)現(xiàn),大鼠肝臟缺血60 min再灌注4 h后,Caspase-3活性較假手術(shù)組相比明顯升高。有文獻報道,在大鼠肝臟缺血60 min再灌注8 h后Caspase-9、Caspase-3mRNA和蛋白水平明顯升高,提示Caspase-9和Caspase-3在細胞凋亡過程中發(fā)揮重要作用[17]。本研究發(fā)現(xiàn),小型豬肝損傷后,肝組織中Caspase-9、Caspase-3活性顯著高于假手術(shù)組,模型組Caspase-9活性極顯著升高的時間點要早于Caspase-3,提示肝損傷后Caspase-9首先被活化,然后激活Caspase-3,進一步引起細胞凋亡。因此,小型豬腹腔鏡肝損傷模型可能通過Caspases依賴途經(jīng)介導(dǎo)了肝細胞凋亡。
4 結(jié)論
小型豬腹腔鏡肝臟缺血再灌注合并肝部分切除損傷可誘導(dǎo)肝細胞凋亡,其機制可能與Bax轉(zhuǎn)錄水平升高,Bcl-2轉(zhuǎn)錄水平降低,Caspase-3和Caspase-9活性增強有關(guān)。

