高錳酸鉀溶液制備方法的優化研究
何吉煥
(云南磷化集團有限公司,云南 昆明 650600)
高錳酸鉀是一種運用廣泛的強氧化劑[1],呈深紫色,有金屬光澤,粒狀或針狀結晶,在強酸溶液、弱酸和堿性溶液中都與還原劑反應:
MnO4-+8H++5e=Mn2++4H2O (常用)
MnO4-+2H2O+3e=MnO2↓+4OH-(很少用)
在酸性溶液中的反應常用硫酸酸化,不用硝酸及鹽酸,因為它們可能與被測物和高錳酸鉀反應。
1 影響高錳酸鉀標準溶液穩定性的因素
市售高錳酸鉀純度在99%左右,常含有少量的MnO2及其它雜質,同時蒸餾水中也常含有還原性物質,如塵埃,有機物等,因此高錳酸鉀只能用間接法來配制標準溶液。
1.1 酸度的影響
在酸性溶液中高錳酸鉀不穩定,會縵慢的但很明顯的分解, 4MnO4+4H+=MnO2↓+3O2+2H2O;在中性或微堿性溶液中分解速度更慢[3]。
1.2 水的影響
高錳酸鉀會氧化水而放出氧氣,使濃度變低。中性溶液中高錳酸鉀與水反應放出氧氣比酸性溶液時更困難。
1.3 光照的影響
高錳酸鉀見光會分解。
1.4 還原性物質的影響
水中還原性物質與高錳酸鉀會反應。
1.5 有機物的影響
高錳酸鉀會氧化有機物,有些有機物會使高錳酸鉀裉色。
2 配制
按照國標GB/T601-2002中規定的方法配制高錳酸鉀標準溶液。
稱取3.3g高錳酸鉀,溶于1050 mL水中,緩緩煮沸15min,于暗處放置兩周,用已處理過的4﹟玻璃濾堝過濾。貯存于棕色瓶中[2]。
3 標定
稱取0.25 g于105~110℃電烘箱中干燥至恒重的工作基準試劑草酸鈉,溶于100mL硫酸溶液(8+92)中,用配制好的高錳酸鉀溶液滴定,近終點時加熱至約65℃,繼續滴定至溶液呈粉紅色,并保持30s。同時做空白試驗。
4 結果與討論
4.1 煮沸時間和放置時間對高錳酸鉀溶液穩定性的影響
同時配制兩份高錳酸鉀標準溶液,一份按照國標方法煮沸15min,暗處放置兩周,過濾后進行標定,另一份煮沸1h,用煮沸30min以上的蒸餾水稀釋至原體積,放置過夜,過濾后進行標定,結果如下表1和表2。
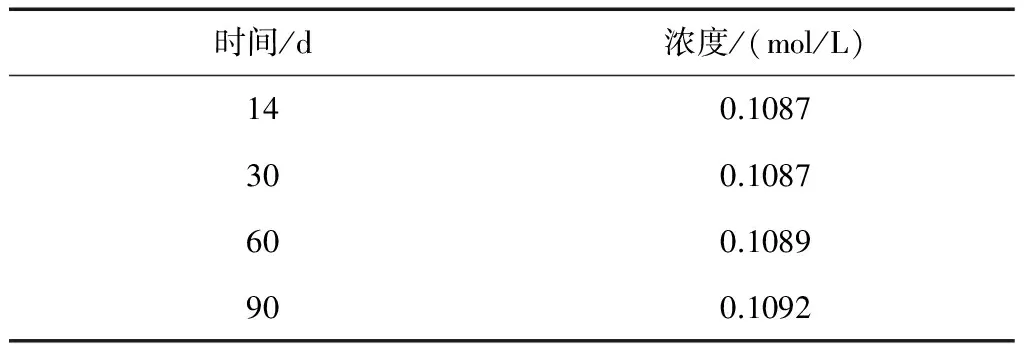
表1 煮沸15min、放置兩周對高錳酸鉀溶液穩定性的影響
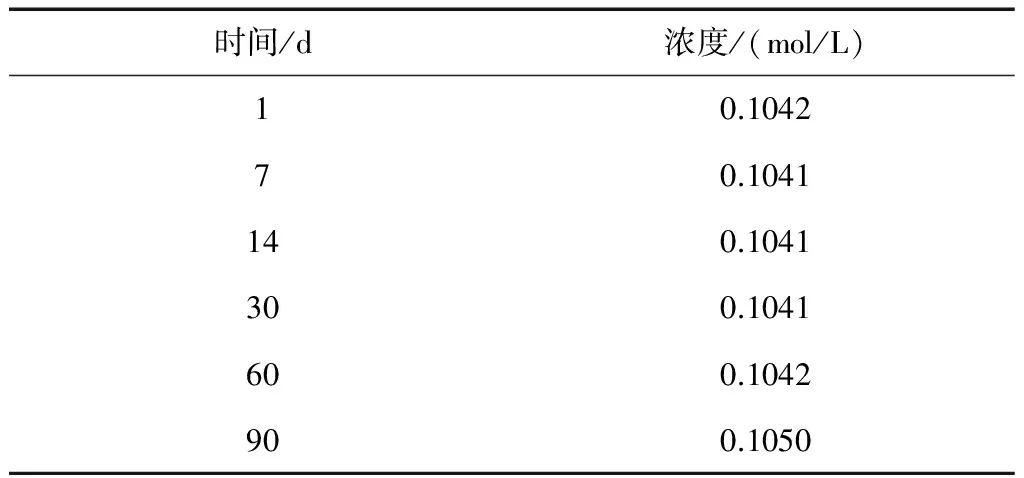
表2 煮沸1h、放置過夜對高錳酸鉀溶液穩定性的影響
由表1和表2可知,兩種配制方法得到的高錳酸鉀溶液,在三個月內分別測試其濃度,濃度變化不大,說明水中的還原性物質很少,在不同煮沸時間和放置時間下都已反應完全。
4.2 酸度對高錳酸鉀溶液穩定性的影響
兩種配制方法得到的高錳酸鉀溶液,測定pH值結果如表3。

表3 高錳酸鉀溶液pH值
由表3看出,它們的pH值接近中性,再結合表1和表2的標定結果可知,配制得到的高錳酸鉀溶液,很穩定,說明在中性環境,高錳酸鉀的分解速度很慢,氧化水的能力也很低。
4.3 有機物質對高錳酸鉀溶液穩定性的影響
按國標配制高錳酸鉀溶液,用4﹟玻璃濾堝過濾,抽濾過程出現真空泵水少量倒吸,溶液標定結果如表4。
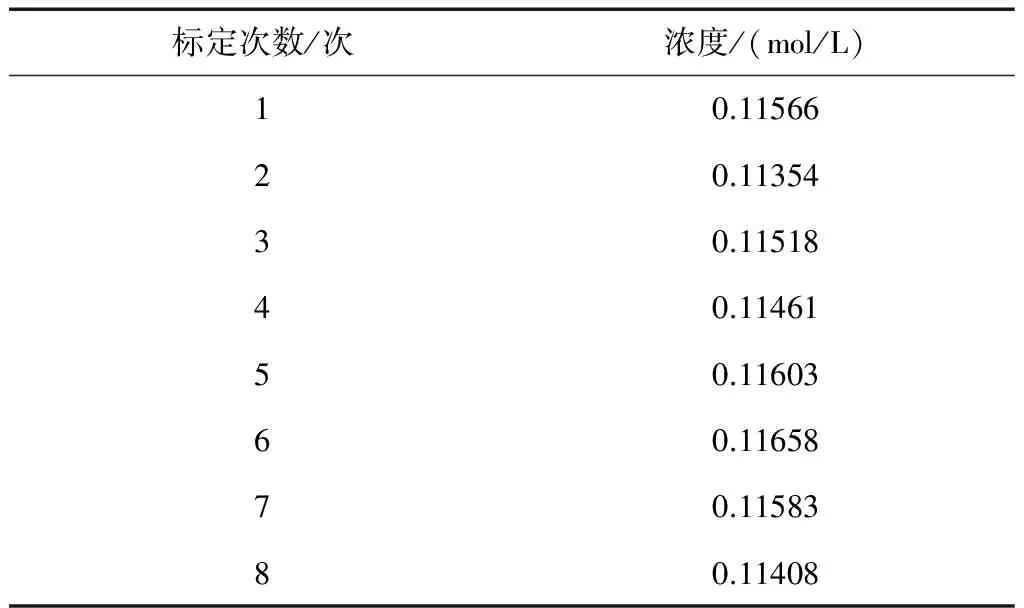
表4 有機物質對高錳酸鉀溶液穩定性的影響
表4中數據顯示各次標定結果相差很大,溶液極不穩定,濃度一直在變化,且標定過程中變色不明顯,沒有高錳酸鉀明顯的紫色,溶液已被真空泵和管子里殘留的有機物污染,不能再用,可見有機物對高錳酸鉀溶液的穩定性影響很大。
4.4 不同濃度高錳酸鉀溶液標定硫酸亞鐵銨
用兩種配制方法得到的高錳酸鉀溶液,分別標定同一硫酸亞鐵銨,標定結果如表5。

表5 不同濃度高錳酸鉀溶液標定硫酸亞鐵銨
兩個濃度的高錳酸鉀溶液標定同一硫酸亞鐵銨溶液,測得的濃度值相對極差為0.18%,說明兩種方法配制的溶液都可行,有效。高錳酸鉀本身的氧化性及試樣性質是影響測定結果的最主要因素[4]。
用標定后得到的兩個硫酸亞鐵銨標準溶液0.09664 mol/L和0.09647 mol/L分別測定黃磷中的P2O3,結果為0.0017%和0.0021%。
4.5 同濃度高錳酸鉀溶液測定水中COD(Mn)
將兩個不同濃度高錳酸鉀溶液稀釋10倍后,測定水中的耗氧量,結果如表6。
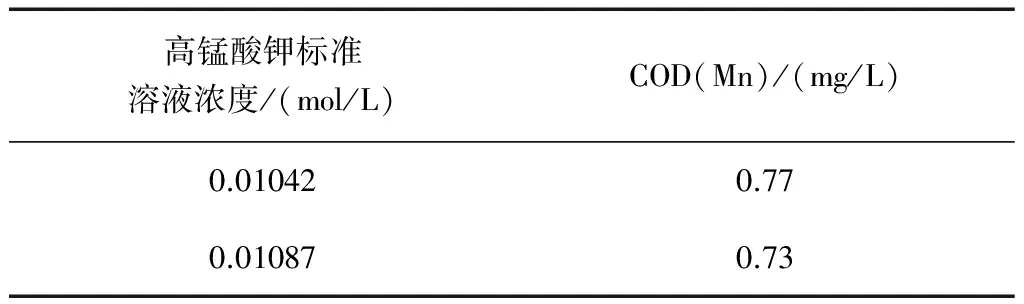
表6 同濃度高錳酸鉀溶液測定水中COD(Mn)
說明兩種方法配制的高錳酸鉀溶液都可行,有效。
5 注意事項
在高錳酸鉀溶液配制和標定過程中,應該注意:
(1)玻璃濾堝在抽濾前應在同濃度的高錳酸鉀溶液緩緩煮沸5min。抽濾切不能出現倒吸。
(2)滴定開始要先慢后快。
(3)近終點時,要加熱到65℃再進行滴定,不能超過85℃。
6 小結
配制高錳酸鉀溶液時,煮沸溶液1 h,并用煮沸30min以上的蒸餾水稀釋至原體積,放置一夜后經抽濾,標定,得到的高錳酸鉀標準溶液濃度穩定。實驗證明和GB/T601-2002的配置方法相比,大大縮短了放置時間,且濃度有較高的準確性。

