撥開云霧見明月——化學實驗題中相關計算的復習
湖北
劉利娟
一、設計思路
近年來,高考化學計算常常與化學實驗、元素化合物知識、化學平衡移動等結合進行考查,特別是與難度較大的化學工業流程題結合以后,具有數據多、關系復雜、綜合性強的特點,學生感到無從下筆,也是學生們在測試和考試中最難得分的一類題。高考化學計算題注重對知識的理解和應用的考查,注重對計算思路和計算方法的考查,削減了數學計算的容量,恢復了化學計算的本質。若能選擇合適的方法準確快速地解決化學實驗題中的計算問題,不但可以縮短解題的時間,還有助于減小計算過程的出錯率,對于提高學習成績,增強學習效率,有著重要意義。
二、考情分析
縱觀近幾年的高考試題,不難發現命題者更加重視對化學計算的考查,特別是對實驗題中計算的考查。化學實驗題中的計算題題型主要集中在以下三個方面:
1.測定樣品中某物質質量分數或濃度;
2.計算產品的產率或回收率;
3.確定物質的化學式。
題型一般為非選擇題,分值為2~4分。以下是近三年高考對化學實驗題中計算的考查。

核心考查內容考點集錦純度、質量分數的計算(2017·全國Ⅰ·26題)用凱氏定氮法測某甘氨酸(C2H5NO2)樣品中氮的質量分數及樣品純度(2017·全國Ⅱ·26題)結合滴定法計算水泥樣品中鈣的質量分數(2017·北京·27題)尿素溶液中溶質的質量分數的測定(2016·浙江·29題)結合滴定實驗所測數據計算無水MgBr2產品的純度(2015·全國Ⅰ·36題)結合滴定實驗所測數據計算樣品中CuCl的質量分數(2015·浙江·29題)通過滴定實驗計算海帶中碘的百分含量(2015·上海·36題)產品中CaO2的質量分數計算

續表
三、學情分析
在化學《必修1》中學生已經學過了化學計量在實驗中的應用等相關知識,也了解與物質的量計算相關公式,但是教材中涉及的知識較簡單,實驗流程簡單,計算題較單一。而高考題中涉及的化學計算通常結合了元素化合物知識、氧化還原反應原理、酸堿中和滴定等多方面的知識,有些學生的思緒較雜亂,不知道該如何分析,無法將已知量與未知量聯系起來。因此,在遇到此類習題時常常選擇放棄。
四、教學方法
自主學習方法 討論法 教師引導講授法 練習法 歸納法
五、實驗用品及教學設備
多媒體投影教學 導學案
六、教學過程
微點聚焦一 簡化過程 妙用守恒
所謂“守恒”就是物質在發生變化或兩種物質發生相互作用的過程中某些物理量的總量保持“不變”。一切化學反應都遵循守恒定律,在化學變化中有著各種各樣的守恒,如質量守恒、元素原子守恒、得失電子守恒、電荷守恒、能量守恒等。
(一)由“元素守恒”確定關系式
1.在O2中灼燒0.44 g S和Fe組成的化合物,使其中的S全部轉變為SO2,把這些SO2全部氧化轉變為H2SO4。這些H2SO4可以用20 mL 0.50 mol·L-1NaOH溶液完全中和。則原化合物中S的百分含量為
( )
A.18% B.46%
C.53% D.36%
【答案】D
【解析】明確S~SO2~SO3~H2SO4中硫元素守恒,根據酸堿中和求出與NaOH的關系。
全部反應過程中,各物質的量的關系可用下式表示:
S~SO2~SO3~H2SO4~ 2NaOH
32 g 2 mol
x(0.02×0.50)mol
(二)由“電子守恒”確定關系式
2.將4.9 g Mg和Fe的混合物在過量稀HNO3中完全反應,得到標準狀況下NO氣體2.24 L,向反應后的溶液中加入足量燒堿溶液充分反應,求最后生成沉淀的質量。
【答案】10 g
【解析】由題意知,整個過程中存在關系:
Fe~3e-~3OH-~Fe(OH)3
Mg~2e-~2OH-~Mg(OH)2

【解題模板】



微點聚焦二 解題捷徑 關系式法
關系式法是表示兩種或者多種物質之間“物質的量”關系的一種簡化式子。在多步反應中,它可以把始態反應物與終態生成物之間物質的量關系表示出來,把多步計算簡化為一步計算。正確書寫關系式是關系式法解化學計算題的前提。
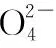
【答案】本題涉及的化學方程式或離子方程式為
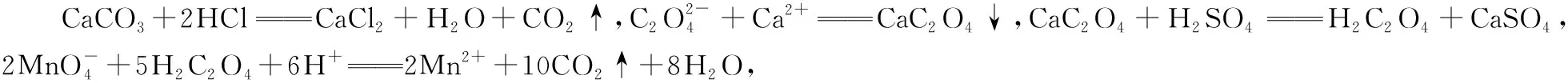
5 2
n1(CaCO3)
aV2×10-3mol
n1(CaCO3)=2.5aV2×10-3mol

【解題模板】

微點聚焦三 巧思妙解 差量分析
差量法的實質是算出反應體系中某些化學量從始態到終態的差量,以此作為解題的突破口。按照差量的性質來說,差量可以是質量差、體積差、物質的量的差值、壓強差等。從任何一個化學反應中,均可以找到一個或多個有關量的差值,因此運用此法解題時,必須仔細分析題意,理清思路,選好相關物理量的差值,根據題意確定理論差值,再根據題目提供的實際差值,列出比例式,然后求解。
(一)確定含量


(二)確定組成
5.CuSO4·5H2O樣品0.80 g受熱脫水過程的熱重曲線(樣品質量隨溫度變化的曲線)如圖所示。
試確定200 ℃時固體物質的化學式(要求寫出推斷過程)。

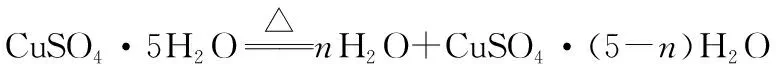
250 18n
0.80 g 0.80 g-0.57 g=0.23 g

【解題模板】


