脈沖電場協同金屬離子對卵清蛋白溶液電化學性質的影響
胡 菲 湯 婷 張 佳 劉燕燕 蔣愛民 蔣 卓
(華南農業大學食品學院,廣東 廣州 510642)
高壓脈沖電場(PEF)是近年來研究最多的非熱殺菌技術之一[1],是一種新型的食品綠色加工技術[2],相比熱加工方法殺菌,脈沖電場處理能更大限度保持食品的品質、營養和風味[3]。PEF較早用于水果的預處理以達到提高果汁提取率的目的,現在已實現商業規模[4]。近年來,高壓脈沖電場在食品殺菌、鈍酶、物質提取[5]、酒類催陳[6]、農藥殘留降解[7]等加工領域的應用十分廣泛[8],在經皮給藥[9]39-40、基因轉染[10]、腫瘤治療[11]等生物醫學效應及其治療作用上的應用也逐漸被關注。
在食品工業,PEF的研究主要集中于食品殺菌、鈍酶、提取、改性等方面[12]。在食品殺菌中,多數學者認為其殺菌是高壓脈沖電場對細胞膜的作用,“電穿孔”和“點崩潰”是目前被廣泛接受的2種學說[13]。針對PEF鈍酶作用,多數學者[12,14]認為,其鈍酶的機理為影響酶的結構。Wang等[15]通過研究PEF對辣根過氧化物的影響發現其二級、三級結構均會發生變化;張若兵等[4]對PEF處理后的過氧化酶和果膠甲基酯酶進行圓二色譜和熒光光譜分析,發現其二級結構和三級結構發生了改變。Perez等[16]借助透射電子顯微鏡觀察PEF處理后的蛋白質,發現脈沖電場會引起蛋白質顆粒聚集,導致蛋白質粒徑增大,從而提出PEF會誘導蛋白質結構變化,會對食品蛋白質組分的結構與功能產生影響;具體表現為:在PEF處理條件下,蛋白質分子結構中自由電子、離子和其他帶電荷離子發生移動和極化,分子偶極距方向的改變增加,引起蛋白質介電常數的改變,而進一步影響到蛋白質分子的二級和三級結構,但不會影響其一級結構。蛋白質分子的展開會使分子內疏水基團和巰基暴露,從而引起蛋白質活性位點的改變和其功能特性的改變。蛋白質分子的展開導致水分子進入其中,使得蛋白質分子間的氫鍵相互作用增強,形成蛋白質分子聚集[17]。蛋白質分子聚集分為蛋白質聚集(aggregation)和蛋白質自組裝(self-assembly) 2種,其中蛋白質自組裝會形成蛋白質納米纖維或生成蛋白質納米管。
天然存在的蛋白質納米管,如煙草花病毒,具有特殊的生物學功能[11]。通過蛋白質自組裝形成的蛋白質納米管,其功能和物理性質都有很大提高,是先進功能材料的基礎材料,在生物治療領域,可作為細胞的發動機、泵和模擬自然系統的人造纖維支架,具有很大的應用前景[18]。近年來,不少學者在研究蛋白質納米管的形成及其機理。劉燕燕等[19] 14 [20]探究了在金屬離子存在條件下,經PEF處理,卵清蛋白會形成蛋白質納米管。Niu[9]39用原子力顯微鏡觀察和分析蛋白質納米管,并預測蛋白質納米管可以用來作為藥物載體和組織工程。Graveland-Bikker[21]在制備水解的-乳清蛋白納米管時發現金屬離子的存在是乳清蛋白納米管形成的另一個先決條件。劉燕燕[19]14-19的研究表明,卵清蛋白納米管的形成與添加的金屬離子的價態有關,一價金屬離子(Na+)和三價金屬離子(Fe3+)對蛋白質納米管的形成作用不大,二價金屬離子中:Ca2+、Ba2+、Mn2+和Cu2+更易形成結構清晰的蛋白質納米管。為了更清晰地研究二價金屬離子對蛋白質納米管形成的影響機理,在前人研究的基礎上,探究其形成機理,以彌補此方面研究的空白;本試驗在卵清蛋白溶液里,添加金屬離子Ca2+、Ba2+、Mn2+和Cu2+以改變蛋白質溶液的電化學環境,通過測定溶液的氧化還原電位,zeta電位以及電導率的變化尋求脈沖電場和蛋白質納米管形成之間的規律,探究金屬離子和PEF協同對蛋白質電化學性質的影響機制,為脈沖電場的應用及蛋白質的利用提供理論依據。
1 材料與方法
1.1 材料與儀器
卵清蛋白:美國Sigma公司;
脈沖電場處理裝置:SY-Z-500型,華南理工大學輕工與食品學院自行研制;
旋片真空泵:2XZ-2型,浙江臺州求精真空泵有限公司;
冷卻裝置:DLSB-30000 型,鄭州長城科工貿有限公司;
電導率儀:DDS-11A型,上海雷磁·創益儀器儀表有限公司;
zeta電位分析儀:Nano-zs&MPT-2型,上海思百吉儀器系統有限公司。
1.2 試驗方法
1.2.1 試驗流程
卵清蛋白制備→透析→加金屬離子→脫氣→脈沖電場處理→測定指標
1.2.2 卵清蛋白處理流程 卵清蛋白相對分子質量為45 000,按照卵清蛋白樣品質量(一般以20 g為準)配制0.000 44 mol蛋白質溶液樣品,Mn2+、Cu2+、Ca2+、Ba2+與卵清蛋白摩爾比分別為6∶1,4∶1,4∶1,4∶1,攪勻待用。
1.2.3 脈沖電場處理 對加入不同金屬離子的卵清蛋白進行單個和多個脈沖處理。處理前,保證樣品中沒有氣泡。處理過程中采用4 ℃的恒溫冷卻水對處理后的樣品進行及時冷卻,確保樣品通過電場的溫度一致。采用電子恒流泵,控制樣品的流速為25 mL/min。脈沖波寬度設置為20 μs,電場強度分別設置為14,20 kV/cm,分多次操作。當樣品經脈沖電場處理1,2,3,4次時,其對應處理時間分別為565,1 130,1 695,2 230 μs,脈沖頻率1 000 Hz,處理前電導率為139 μS/cm。
1.2.4 zeta電位檢測 根據文獻[22]修改如下:溫度設定為25 ℃,由zeta電位分析儀直接測定。
1.2.5 電導率檢測 根據文獻[23]修改如下:溫度設定為20 ℃,啟動電導率分析儀,檢測3次,取平均值。
1.2.6 氧化還原電位檢測 根據文獻[24],采用差分脈沖伏安法和三電極的工作方式測定。
2 結果與分析
2.1 PEF和不同金屬離子協同作用對蛋白質溶液zeta電位的影響
由圖1可以看出,金屬離子的添加均增加了卵清蛋白的zeta電位,不同金屬離子和PEF協同處理對卵清蛋白溶液zeta電位的影響不同。
Ba2+協同PEF導致卵清蛋白zeta值呈遞減趨勢,其原因有可能是卵清蛋白分子與Ba2+形成網絡結構的電位絕對值隨著脈沖電場輸入能量的增大而增大,脈沖電場對蛋白質分子極化程度增加。Cu2+協同PEF處理后的卵清蛋白zeta電位呈現減小趨勢。Mn2+和PEF協同處理的卵清蛋白zeta電位呈現先增大后減小趨勢,對比未經PEF處理的蛋白樣品,脈沖處理時間為565,1 130,1 695 μs時,zeta電位都呈現不同程度的增加,當脈沖處理時間為2 260 μs時,zeta電位下降,說明蛋白質分子可能發生了聚集。Ca2+和PEF協同作用對卵清蛋白zeta電位的影響有相似的規律,呈現先增大后減小的趨勢,在脈沖處理時間為1 130 μs時,zeta電位最大,說明蛋白質分子展開程度增加,Ca2+在蛋白質分子間搭橋作用明顯,蛋白質分子和Ca2+之間最大程度網絡化;隨著脈沖處理時間繼續增大到1 650,2 260 μs時,zeta電位下降,說明蛋白質分子可能發生聚集。
2.2 PEF和不同金屬離子協同作用對蛋白質溶液電導率的影響
由圖2可以看出,PEF單獨作用對蛋白質溶液電導率的影響不大。
由圖3可以看出,隨著脈沖處理時間的延長,添加了4種金屬離子的蛋白質溶液的電導率均呈現先增大后減小的趨勢,其中Ca2+離子的添加對蛋白溶液的電導率影響最大。與未添加金屬離子的對照組對比,不同金屬離子對未經PEF處理的蛋白質溶液電導率有明顯差別,說明不同金屬離子和蛋白質分子的螯合作用不同。Ca2+的添加對卵清蛋白溶液電導率影響最大,說明Ca2+與蛋白質分子之間形成的網絡結構最明顯。當脈沖處理時間為565 μs時,添加Ba2+和Ca2+的蛋白質溶液電導率達到最大,當脈沖處理時間為1 650 μs時,添加Cu2+的蛋白質溶液電導率達到最大值。之后隨著脈沖時間的延長,電導率都有明顯的下降,說明蛋白質分子發生聚集,金屬離子分布在蛋白質分子聚集體內,導致蛋白質溶液電導率下降。
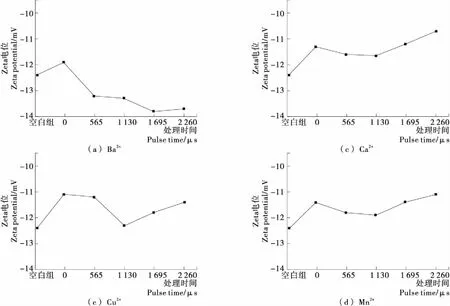
圖1 PEF協同不同金屬離子對蛋白質溶液zeta電位的影響Figure 1 The effect of PEF and different metal ions on the zeta potential of protein solution
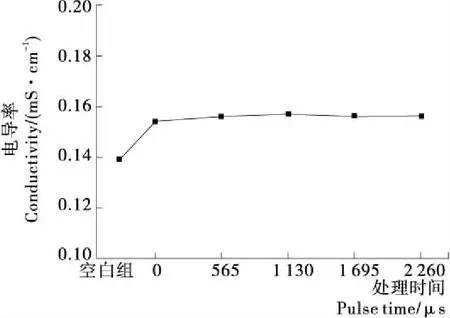
場強為20 kV/cm,脈寬20 μs圖2 PEF對蛋白質溶液電導率的影響Figure 2 Effect of PEF on conductivity of protein solution
2.3 不同場強PEF和Ca2+協同作用對蛋白質溶液電導率的影響
根據上述研究,發現Ca2+對zeta電位和電導率影響較大。為研究場強對溶液電化學性質的影響,選取Ca2+與PEF協同作用,觀察不同場強對溶液電導率的影響。試驗時,Ca2+濃度不變,改變電場場強及脈沖時間,蛋白質溶液的電導率見圖4。未添加Ca2+金屬離子未經PEF處理的蛋白質溶液電導率為0.299 mS/cm,添加Ca2+但未經PEF處理的蛋白質溶液電導率有明顯差別,呈顯著提高,說明Ca2+和蛋白質分子之間存在較強的締合作用。當脈沖場強為14 kV/cm,添加Ca2+的蛋白質溶液的電導率隨著脈沖處理時間的延長呈現減小的趨勢,其原因是蛋白質分子有可能發生聚集,Ca2+分布在蛋白質分子聚集體內,導致蛋白質溶液電導率下降。當脈沖場強為20 kV/cm時,添加Ca2+的蛋白質溶液呈現先減小后增大的趨勢。二者相比,高場強的脈沖電場處理后,蛋白質溶液的電導率比經過低場強處理的蛋白質溶液高。其原因可能是高場強誘導蛋白質分子正極化,低場強誘導蛋白質分子負極化,高場強誘導蛋白質溶液內游離離子增加。
2.4 PEF和不同金屬離子協同作用對蛋白質溶液氧化還原電位的影響
除上述指標外,還研究了PEF和不同金屬離子協同作用對蛋白質溶液氧化還原電位的影響。在卵清蛋白溶液中分別按比例加入確定質量的Ca2+、Ba2+、Cu2+和Mn2+,采用差分脈沖伏安法和三電極的工作方式,利用電化學工作站,生成伏安圖像,分析PEF和不同金屬離子協同作用對蛋白質溶液氧化還原電位的影響。PEF和不同金屬離子協同作用后,蛋白質溶液氧化還原電位見圖5~8。
如圖5所示,隨著處理次數的增加,電流曲線增幅下降,Ca2+樣品的電活性下降,且未呈現明顯的峰電流。從Ca2+伏安圖中也可以看出,控制樣品(未添加鈣離子且未經過電場處理)的電活性最強,可知經過低場強脈沖電場處理后樣品電活性下降,可導電物質能力和數量減少。
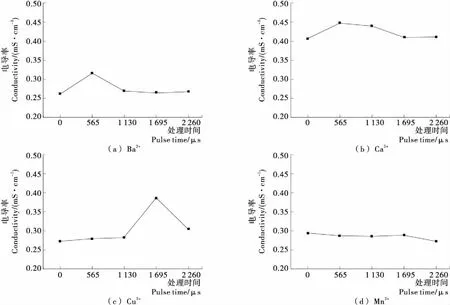
場強為20 kV/cm,脈寬20 μs圖3 PEF協同不同金屬離子對蛋白質溶液電導率的影響Figure 3 Effect of PEF cooperating with different metal ions on conductivity of protein solution
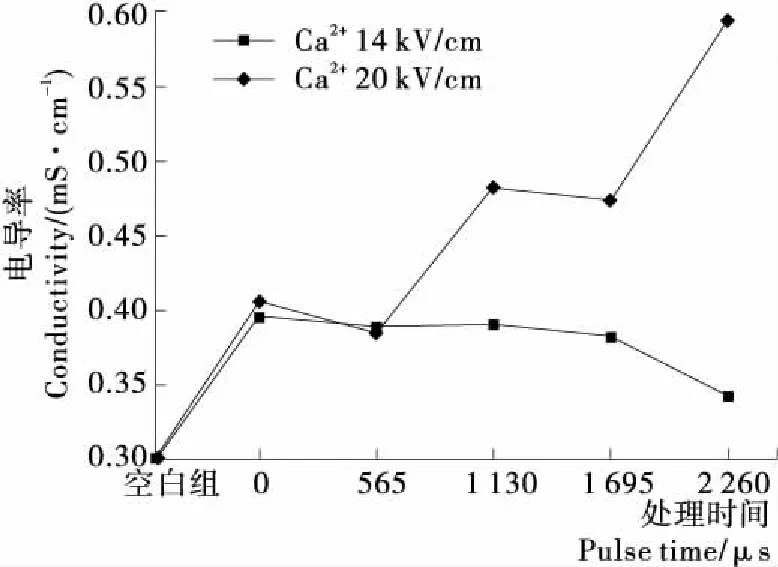
圖4 不同場強PEF協同Ca2+對蛋白質溶液電導率的影響
Figure 4 Effects of different field strengths of PEF and Ca2+on the conductivity of protein solution
如圖6所示,隨著處理次數的增加,電流曲線下降,Ba2+樣品的電活性下降,且未呈現明顯的峰電流,曲線之間呈現遞減規律。從Ba2+伏安圖中也可以看出,控制樣品(未添加離子且未經過電場處理)的電活性最強,因此也可以斷定脈沖電場處理后樣品電活性下降,可導電物質能力和數量減少。
如圖7所示,蛋白質溶液空白樣電流小,Cu2+的添加增加了卵清蛋白溶液的峰電流。隨著脈沖電場處理時間的增加,出現峰電流,未添加金屬離子的控制樣品和添加金屬離子后均沒有峰電流值。當脈沖處理時間為565,1 130,1 695,2 260 μs,峰電流值分別為1.59E-07(0.78 V),1.69E-07(0.7 V),1.82E-07(0.68 V),1.86E-07(0.66 V)A,呈現遞增規律。說明脈沖電場和金屬Cu2+協同增加了蛋白質分子的電活性,Cu2+在蛋白質分子間搭橋作用明顯,蛋白質分子間相互作用增強,形成了電活性比較穩定的自組裝結構。隨著脈沖電場輸入能量持續增加,脈沖電場對蛋白質分子極化程度增加。
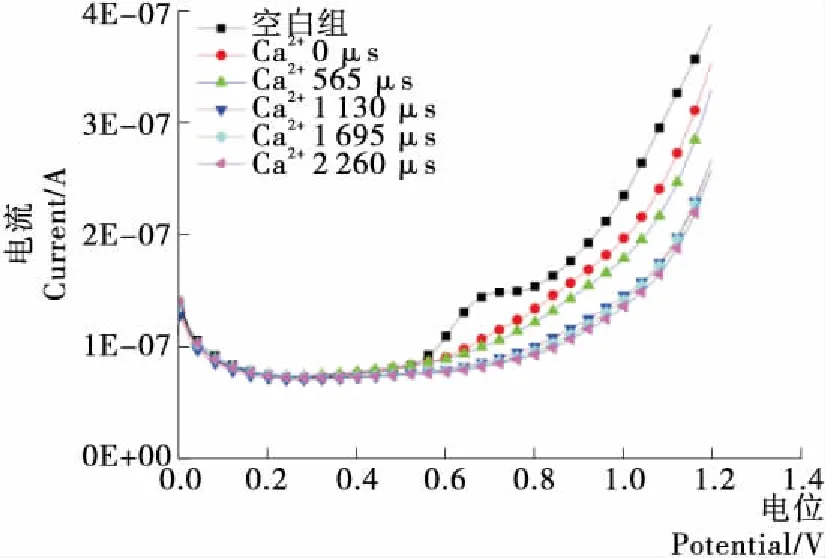
圖5 PEF協同Ca2+對氧化還原電位的影響Figure 5 Effect of PEF and Ca2+ on Redox Potential
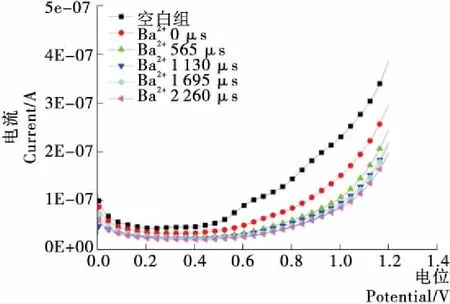
圖6 PEF協同Ba2+對氧化還原電位的影響Figure 6 Effect of PEF and Ba2+ on Redox Potential
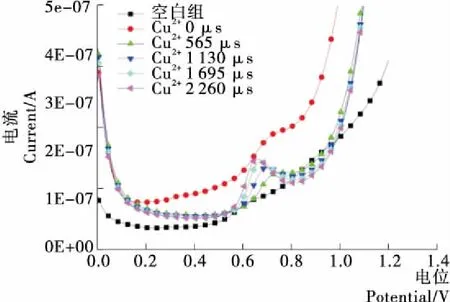
圖7 PEF協同Cu2+對氧化還原電位的影響Figure 7 Effect of PEF and Cu2+ on Redox Potential
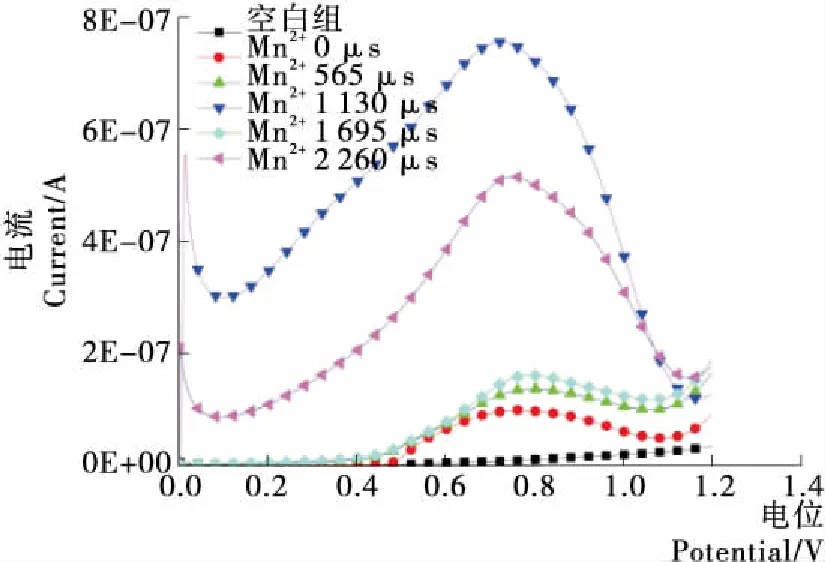
圖8 PEF協同Mn2+氧化還原電位的影響Figure 8 Effect of PEF and Mn2+ on Redox Potential
如圖8所示,蛋白質溶液空白樣電流小,Mn2+的添加增加了卵清蛋白溶液的峰電流。隨著脈沖電場處理時間的延長,出現峰電流,未添加金屬離子的控制樣品峰電流值為9.67E-08 A(0.732 V),添加金屬離子后峰電流值為1.24E-06 A(0.824 V)。當脈沖處理時間為565,1 130,1 695,2 260 μs時,峰電流值分別為5.57E-06(0.76 V),6.99E-06(0.74 V),7.53E-06(0.74 V),7.56E-06(0.74 V) A,呈現遞增規律。說明脈沖電場和金屬Mn2+協同增加了蛋白質分子的電活性,誘導蛋白質分子和金屬離子締合,形成較大顆粒網絡結構,蛋白質與蛋白質分子間通過Mn2+相互作用,形成了電活性比較穩定的自組裝結構。當脈沖處理時間為1 130 μs時,脈沖電場和金屬離子協同作用誘使蛋白質生成粒度較大的納米材料。
綜上,添加Ca2+和Ba2+的蛋白質溶液,隨著處理次數的增加電流下降,溶液內可導電物質以及導電能力下降,而添加了Cu2+和Mn2+的蛋白質溶液,均出現峰電流,形成了較穩定的自組裝結構。
3 結論
金屬離子的加入都能影響PEF下蛋白質納米管的形成,卵清蛋白與金屬離子間會發生螯合作用,Ca2+協同PEF處理時在蛋白質分子間搭橋作用最明顯,分子間呈現最大程度網絡化,PEF處理1 130 μs時作用最明顯,之后蛋白質分子發生聚集。且在高場強下誘導蛋白質溶液內游離離子增加,蛋白質分子正極化,低場強誘導蛋白質分子負極化。Cu2+協同PEF處理也會使蛋白質分子發生聚集,蛋白質分子間相互作用增強,形成了電活性比較穩定的自組裝結構。本試驗研究發現脈沖電場對蛋白質與金屬離子的螯合有加強作用,可進一步探究脈沖電場在提高高蛋白飲料中礦物質的結合率上的應用,從而提供礦物元素的吸收,為脈沖電場的應用開拓新領域。

