左乙拉西坦片對老年癲癇患者相關 血清指標及療效的影響*
帕力達·克立木 阿帕爾·卡哈爾 白婷迪娜 曼谷努爾 玉山 冒文娟
(1.新疆維吾爾自治區人民醫院神經內科,新疆 烏魯木齊 830000;2.新疆醫科大學第二附屬醫院老年病科,新疆 烏魯木齊 830063)
癲癇是一種慢性反復發作性短暫腦功能失調綜合征,其主要特征為腦神經元異常放電所引起的反復癇性發作[1]。臨床主要表現為暫時性反復的意識障礙,伴有全身性或者局限性肌肉痙攣抽搐等癥狀,過度放電是導致各種臨床癥狀發生的基礎,反復發作則為此疾病的固有特征[2]。老年癲癇則多為繼發性癲癇,其病因多為各種腦血管疾病、代謝性疾病、腦腫瘤等。癲癇的發生可使老年患者的記憶力下降,認知功能障礙,使患者生活質量顯著降低,因此給予積極有效的治療具有重要的臨床價值[3]。左乙拉西坦片是一種新型的廣譜抗癲癇藥物,具有良好的治療效果,且副作用小、耐受性好[4],但由于在國內使用的時間較短,對老年癲癇的研究較少,為進一步了解左乙拉西坦片治療老年癲癇患者臨床療效。本研究旨在探討左乙拉西坦片輔助治療老年癲癇患者的臨床療效以及對其血清NF-α、IL-2、IL-6、ICAM-1水平的影響。
1 材料與方法
1.1 一般資料 納入2016年4月~2017年7月在我院接受治療的老年癲癇患者90例,隨機分為觀察組(45例)和對照組(45例),對照組中男25例,女20例,年齡63~75歲,平均年齡(70.43±5.32)歲;病程1~16年,平均病程(5.43±3.21)年;發作頻率5~40次/月,平均(10.32±4.54);發作類型:全面性強直陣攣性發作11例,復雜部分性發作8例、繼發性全面性強直陣攣性發作16例、單純部分性發作10例。觀察組45例,其中男27例,女18例,年齡60~75歲,平均年齡(68.12±6.73)歲;病程1~15年,平均病程(6.03±3.81)年;發作頻率4~35次/月,平均(8.32±3.84);發作類型:全面性強直陣攣性發作9例,復雜部分性發作9例、繼發性全面性強直陣攣性發作15例、單純部分性發作12例。兩組患者性別、年齡、病程、發作頻率、發作類型等基線資料相比具有可比性。納入標準:①符合國際抗癲癇聯盟的發作分類以及癲癇綜合征分類的定義標準[5]。②經頭顱CT等檢查,排除腦腫瘤以及進行性神經系統疾病。③經視頻腦電圖檢測提示癲癇樣發作波。排除標準:①患有嚴重心、腦、肝等重要臟器疾病者。②患有其他嚴重免疫系統疾病者。③患有精神疾病或正在使用精神疾病藥物治療者。④具有酒精成癮、藥物依賴者。
1.2 方法 兩組患者均給予卡馬西平片(上海復旦復華藥業有限公司,20160316,0.1g)口服,初始劑量0.1g,2次/天,于次日后每天增加0.1g直至0.4g;苯巴必妥片(華潤雙鶴藥業股份有限公司,20160321,15mg)口服,2次/天,30mg/次。觀察組加用左乙拉西坦片(UCB Pharma S.A.(比利時),20160212,0.25g),初始劑量0.25g,根據患者具體情況可增加至0.5g,2次/1天。兩組均治療6個月.
1.3 觀察指標 觀察治療后臨床療效,其療效評價標準參照相關文獻進行[6],具體為:完全控制:經治療患者癲癇發作完全消失;顯效:經治療患者癲癇發作頻率減少>75%;有效經治療患者癲癇發作頻率減少50%~75%;無效:經治療患者癲癇發作頻率減少<50%。總有療效=完全控制率+顯效率+有效率。比較兩組治療前后血清TNF-α、IL-2、IL-6、ICAM-1水平。于治療前后采集患者空腹靜脈血5ml,離心處理后取血清保存于-80℃,TNF-α、IL-2、IL-6水平采用ELISA 法,試劑盒均來自上海恒遠生物技術發展有限公司;ICAM-1水平采用全自動流式細胞儀檢測。
采用格拉斯哥昏迷評分法(GCS)評估兩組治療前后癲癇發作時的昏迷程度,其分數越低表示昏迷程度越嚴重;巴塞爾(Barthel)指數評估其日常生活能力,分數越高表示日常生活能力越高;采用蒙特利爾認知評估量表(MoCA)評價其認知功能,總分30分,分數越高其認知功越好。
1.4 統計學分析 本研究數據選擇spss18.0進行統計,組間計量資料采用獨立樣本t檢驗,計數資料采用2檢驗,等級資料比較則用秩和檢驗,以P<0.05表示差異有統計學意義。
2結果
2.1 兩組臨床療效比較 治療后,觀察組總有效率明顯高于對照組,兩組比較差異有統計學意義(P<0.05),見表1。
2.2 血清TNF-α、IL-2、IL-6、ICAM-1水平分析 治療前,兩組血清TNF-α、IL-2、IL-6、ICAM-1水平比較差異無統計學意義(P>0.05),治療后兩組上述指標水平均顯著降低,且觀察組明顯低于對照組,差異均有統計學意義(P均<0.05),見表2。
2.3 兩組患者 GCS、Barthel指數及MoCA評分分析 治療前兩組GCS、Barthel指數及MoCA評分比較差異均無統計學意義(P>0.05),治療后,其GCS與MoCA評分及Barthel指數均較治療前顯著升高(P<0.05),且觀察組明顯高于對照組,兩組比較差異均有統計學意義(P均<0.05),見表3。

表1 兩組臨床療效比較[n(×10-2 )] Table 1 Comparison of efficacy of the two groups
注:U=2.271,2=4.486;與觀察組比較,①P<0.05
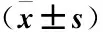
表2 兩組治療前后血清TNF-α、IL-2、IL-6、ICAM-1水平比較 Table 2 Comparison of serum TNF-α, IL-2, IL-6 and ICAM-1 levels between the two groups before and after treatment
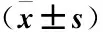
表3 兩組治療前后GCS、Barthel指數及MoCA評分比較 Table 3 Comparison of GCS, Barthel index and MoCA score between the two groups before and after treatment
2.4 兩組患者不良反應 兩組治療期間均未發生明顯的不良反應(P>0.05)。
3 討論
癲癇是神經系統常見疾病,具有自限性的異常放電而引起以發作性、短暫性、重復性以及刻板性的中樞神經系統功能失常為其特征的綜合征。目前對其發病機制尚未明確,但眾多研究已證實癲癇患者在使用抗癲癇藥物治療前后均存在一定的免疫異常現象[7-9]。且近幾年有學者通過研究發現,在癲癇免疫學機制中細胞因子發揮了重要的作用,主要集中在TNF-α、IL-2及IL-6等[10]。
TNF-α主要通過單核-巨噬細胞分泌產生,具有眾多的生物學效應,其水平的異常與自身免疫學疾病的發生具有密切的關系。據相關文獻報道[11],癲癇患者血清TNF-α水平異常升高,其水平的增加可促進IL-8的分泌,從而使免疫細胞在受累組織內浸潤、積聚等,導致局部組織出現炎癥反應。本研究結果顯示,在治療前患者血清IL-2與IL-6水平均呈高表達,提示在癲癇的發生發展中IL-2及IL-6均發揮了重要作用。相關研究顯示[12~13],多種腦組織均可合成以及分泌IL-2,當IL-2與其受體結合后可發揮獨特的生物學活性功能,參與機體的免疫應答;同時通過提高神經元細胞內游離鈣離子水平表達,發揮了調節及控制神經興奮性的功能作用,從而誘導癲癇的發生。IL-6是機體內多種有核細胞產生的一種單鏈糖蛋白,具有多種生物學功能,主要參與機體的細胞免疫、炎癥反應等,可促進中樞神經系統分泌免疫球蛋白的漿細胞,參與腦組織的免疫性炎癥[14]。研究認為NF-α、IL-2及IL-6等細胞因子參與癲癇病理生理機制的過程可能與下列機制有關:①通過抑制膠質細胞內谷氨酰合成酶的活性,增強了谷氨酸的活性。②促進了膠質細胞的增生并誘導其產生其他細胞因子。③對海馬CA3椎體細胞所產生的興奮性具有一定影響,同時可減弱抑制性突觸后電位導致異常癇樣放電[15-16]。
左乙拉西坦為新一代抗癲癇藥物,屬于吡咯烷酮類衍生物,傳統的抗癲癇藥物主要是通過增強γ-氨基丁酸活性、抑制低電壓激活的鈣流量等機制達到治療目的,左乙拉西坦則是通過與中樞神經的突觸囊泡蛋白2A相互結果,調節其神經遞質的釋放,從而阻止神經元異常放電的傳導而發揮治療的作用[17]。且現代藥理學研究,左乙拉西坦口服吸收迅速,與蛋白結合率低,具有理想的藥動力學特征,其代謝不經過肝臟,對細胞色素P450酶系統無誘導效果,具有良好的耐受性與安全性。國內外均有報道,左乙拉西坦用于癲癇的輔助治療具有顯著的療效及良好的安全性[18-20]。本研究結果顯示,患者使用左乙拉西坦輔助治療后,其臨床總有效率顯著提高,患者血清TNF-α、IL-2、IL-6以及ICAM-1水平均顯著降低,且患者GCS 評分、Barthel指數評分、MoCA評分均明顯改善。提示患者的炎性因子及ICAM-1均得到顯著改善,其原因可能與左乙拉西坦控制了患者了癲癇發作,通過集體的免疫-神經-內分泌網絡系統有效調節了其炎性因子水平與ICAM-1水平。
4 結論
本研究結果顯示,左乙拉西坦輔助治療老年癲癇可有效改善患者昏迷程度、日常生活能力以及認知功能,降低患者血清TNF-α、IL-2、IL-6、ICAM-1水平,具有顯著的臨床療效,安全性好,可在臨床推廣應用。
【參考文獻】
[1]陳倩. 兒童癲癇外科神經心理和神經發育評估[J]. 中國實用兒科雜志, 2016, 31(1):22-26.
[2]He X, Bai Y, Zeng M,etal. Anticonvulsant activities of α-asaronol ((E)-3'-hydroxyasarone), an active constituent derived from α-asarone[J]. Pharmacol Rep, 2017,70(1):69-74.
[3]宋雪祥, 張瑾, 張滿意,等. 老年癲癇76例臨床分析[J]. 江蘇醫藥, 2016, 42(13):1490-1492.
[4]錢燕群, 袁慶芳. 左乙拉西坦治療中老年癲癇患者的臨床療效及其對骨密度的影響[J]. 臨床和實驗醫學雜志, 2017, 16(3):266-268.
[5]Commission on classification and terminology of the international league against epilepsy proposal for revised classification of epilepsies and epileptic Syndromes[J]. Epilepsia,1989, 30(4):389- 399.
[6]Macdonald RL. Antiepileptic drug actions[J]. Epilepsia, 1989, 30(1): 19- 28.
[7]袁婕, 宋江莉, 張虹,等. 奧卡西平治療對癲癇患者血清炎性因子、細胞間粘附分子1及免疫功能的影響[J]. 海南醫學院學報, 2017, 23(11):1571-1574.
[8]車千紅, 周佳任, 張瑩. 154例初診癲癇患兒免疫功能及營養指標的變化[J]. 實用預防醫學, 2015, 22(7):869-872.
[9]Sundar U, Honrao ST, Shah N. Psychiatric Co-morbidities in Women with Epilepsy[J]. J Assoc Physicians India, 2017,65(12):30-32.
[10] 韓志斌. 炎性因子在癲癇發生發展中的作用[J]. 國際神經病學神經外科學雜志, 2016, 43(6):572-574.
[11] 傅勇, 李希芝, 郭玉潔,等. 癲癇發作患者近期IL-1β、TNF-α水平與腦電圖異常的關系[J]. 山東醫藥, 2017, 57(33):90-92.
[12] 李蘭. 癲癇患者腦脊液和血清中miRNAs含量檢測及其對相關細胞因子的調控作用[J]. 海南醫學院學報, 2016, 22(6):611-613.
[13] 韓潔, 平莉莉, 胡麗敏,等. 原發性癲癇患兒腦電圖與血清炎性因子水平的相關性分析[J]. 河北醫科大學學報, 2017, 38(1):51-55.
[14] 張桐. 復方丹參片聯合抗癲癇藥物治療學齡期兒童癲癇的療效及對血清NSE、IL-6和hs-CRP及認知功能的影響[J]. 現代中西醫結合雜志, 2017, 26(23):2538-2540.
[15] 蔡倫, 韋理萍. 炎癥在慢性癲癇發作中的作用[J]. 腦與神經疾病雜志, 2017, 25(4):259-261.
[16] 黃靈, 黃建敏, 李雪斌,等. 天麻素對癲癇患者炎癥因子、腦源性神經營養因子水平的影響[J]. 廣西醫學, 2017, 39(3):289-290.
[17] 顧翠, 楊美麗, 王繼華,等. 左乙拉西坦在癲癇治療中的應用進展[J]. 中國臨床醫生雜志, 2017, 45(3):24-27.
[18] 李志斌, 江慧敏, 肖華. 奧卡西平聯合左乙拉西坦治療小兒癲癇的療效及安全性[J]. 實用醫學雜志, 2016, 32(16):2734-2736.
[19] Kikuyama H, Hanaoka T, Kanazawa T,etal. The Mechanism of Anti-Epileptogenesis by Levetiracetam Treatment is Similar to the Spontaneous Recovery of Idiopathic Generalized Epilepsy during Adolescence[J]. Psychiatry Investig, 2017,4(6):844-850.
[20] 文睿婷, 黃琳, 于芝穎,等. 左乙拉西坦添加治療成人難治性癲癇部分性發作的回顧性分析[J]. 中國臨床藥理學雜志, 2017, 33(2):160-162.

