慢性阻塞性肺疾病急性加重期患者T細胞免疫機制變化初探*
曾 文,秦 雯,胡大春,李梅華,唐樹榮
(云南省昆明市第一人民醫院:1.檢驗科;2.輸血科;3.呼吸科 650011)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一種吸入有害氣體或顆粒產生異常慢性炎性反應導致氣道受阻繼而發展為慢性氣管炎或伴隨肺氣腫的慢性疾病[1]。我國40歲以上人群的患病率高達8.2%[2]。預計到2020年,該病將成為世界第3位致死原因[3],將位居世界疾病經濟負擔第5位,是嚴重影響公共健康水平的重要疾病之一。COPD的發病機制復雜,至今尚未明了。已有的研究提示多種免疫機制失衡參與其中,尤其是Th1細胞、Th17細胞、調節性T細胞(regulatory T lymphocytes,Treg)等細胞免疫調節改變突出[4-7]。COPD動物模型研究顯示Th17細胞及Treg細胞水平變化顯著[8]。T淋巴細胞是一群異質性細胞的總稱,均表達CD3分子,包括CD4+、CD8+、CD3+CD4-CD8-雙陰性T細胞(double negative T cell,DNT)等。依據其功能分為輔助性T細胞(Th1細胞、Th2細胞、Th17細胞),具有抑制性功能的Treg、細胞毒T細胞等。它們通過細胞因子及其信號通路相互協助與相互制約,維持機體免疫動態平衡。先前的臨床研究文獻報道中對COPD疾病狀態下,有關這些免疫細胞間及其與細胞因子間相互作用機制變化的闡述并不多見。為更深入理解COPD患者免疫機制的變化,以便臨床更好地實施COPD免疫輔助治療,預防急性加重期COPD(AECOPD)的發生、延緩病程進展,本研究選擇COPD急性加重期患者48例和健康對照者30例,對外周血各類T淋巴細胞和相關的細胞因子的變化進行檢測與多因素分析,初步探討了COPD細胞免疫機制的變化,現報道如下。
1 資料與方法
1.1一般資料 選取2015年1月至2016年12月本院收治的48例AECOPD患者作為研究組。入選標準:(1)均符合美國呼吸病學會2009年修訂的COPD診斷標準[1],并符合AECOPD的定義,即穩定期COPD患者急性起病、呼吸系統癥狀惡化,表現為呼吸困難、咳嗽、痰量最多或/和痰液呈膿性,臨床或/和實驗室檢查沒有發現其他可以解釋的特異病因,導致需要改變藥物治療。(2)近3個月未患其他部位的感染性疾病。排除自身免疫病、糖尿病、腫瘤、各種慢性消耗性疾病及肝腎功能嚴重受損者、免疫抑制劑治療者。其中男27例,女21例,年齡51~82歲,平均66.5歲。同時抽取30例健康體檢者作為對照組。入選標準:(1)既往健康,無慢性呼吸系統疾病史;(2)近3個月未患感染性疾病;(3)血、尿、便常規及X線片檢查正常。其中男13例,女17例,年齡20~50歲,平均35.0歲。本研究獲得了本院倫理委員會批準;研究病例和對照者選取中,已告知研究對象本研究目的、內容,可能造成的明顯和潛在不利影響,經知情同意后入選。
1.2儀器與試劑 儀器:細胞免疫項目采用貝克曼庫爾特FC-500流式細胞儀檢測。細胞因子項目采用Thermo酶標儀檢測。試劑:細胞免疫項目試劑(熒光抗體CD4-FITC,CD127-PE,CD25-PC5,CD3-PC5,CD45-FITC/CD4-RD1/CD8-ECD/CD3-PC5)、標準熒光微球(flowcheck)及室內質控品由貝克曼庫爾特公司生產。熒光抗體anti-IL-17-PE由eBiosciences公司生產。流式細胞熒光分選技術(FACS)溶血劑由BD公司生產。細胞因子項目試劑由Dldevelop公司生產。
1.3方法
1.3.1樣本采集與處理 用BD公司生產真空采集管,空腹采集靜脈血1管(肝素鋰抗凝管),采集量2 mL、無抗凝血3 mL,前者24 h內進行處理和上機檢測,后者2 h內離心分離血清,-80 ℃保存。樣本處理過程中,排除嚴重溶血,黃疸和脂血樣本。
1.3.2CD3+T細胞、CD4+T細胞、CD8+T細胞、DNT細胞檢測 先將10 μL熒光抗體CD45-FITC/CD4-RD1/CD8-ECD/CD3-PC5加入到標準流式管底,再將100 μL抗凝血加入流式管中,輕輕混勻,室溫避光孵育30 min,然后加入FACS溶血劑工作液1 mL,避光溶血15 min后,2 000 r/min離心5 min,棄上清液,加入1 mL磷酸鹽緩沖液(PBS)重懸細胞,混勻后上流式細胞儀進行檢測,采用4色分析,CD45-SS設門。
1.3.3Treg檢測 先將10 μL熒光抗體CD4-FITC,CD127-PE,CD25-PC5加入到標準流式管底,再將100 μL抗凝血加入流式管中,輕輕混勻,室溫避光孵育30 min,然后加入FACS溶血劑工作液1 mL,避光溶血15 min后,2 000 r/min離心5 min,棄上清液,加入1 mL PBS重懸細胞,混勻后上流式細胞儀進行檢測,采用3色分析,CD4-SS設門。CD4+CD25+CD127low細胞群為Treg。
1.3.4Th17細胞檢測 分離收集外周血單個核細胞,置入標準流式管中并調整細胞濃度至1×106個/mL,加入細胞刺激液,5%濃度CO2,37 ℃培養箱中放置8 h后,用PBS清洗細胞,PBS重懸。加入10 μL熒光抗體CD4-FITC、CD3-PC5、anti-IL-17-PE后避光4 ℃孵育30 min,上流式細胞儀檢測。采用3色分析,CD3-SS設門。
1.3.5細胞因子的檢測 IL-12、IL-22、IL-23R、IL-23、TNF-α均采用酶聯免疫吸附試驗(ELISA)雙抗體夾心法進行檢測。按照試劑說明書配制好酶標抗體、標準品、清洗液;將標準品逐倍稀釋成7個濃度(1∶2~1∶64)后和樣本一起逐個加入相應酶標孔。封板37 ℃孵育1 h后,加入酶標抗體,37 ℃孵育1 h后顯色15 min,終止反應后使用酶標儀讀取各酶標孔吸光度(OD)值,并用軟件進行標準曲線擬合計算。
1.3.6肺功能檢查 由本院呼吸科肺功能檢查室完成,設備為德國耶格APS-PRO肺功能檢查儀。選用用力肺活量(FVC)、第1秒用力呼出量(FEV1.0)、FEV1.0/ FVC比值為肺功能分析指標。
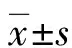
2 結 果
2.1各類T細胞水平的變化 研究組與對照組人群外周血CD3+T細胞、CD4+T細胞、CD8+T細胞、CD4+/CD8+T細胞、DNT、Treg、Th17細胞百分比檢測結果見表1。研究組外周血CD8+T細胞水平較對照組低,差異有統計學意義(P<0.05);Treg、Th17細胞水平較對照組高,差異有統計學意義(P<0.01);CD3+T細胞、CD4+T細胞、CD4+T細胞/CD8+T細胞比值和DNT水平與對照組比較差異無統計學意義(P>0.05)。
2.2外周血細胞因子水平的變化 研究組與對照組人群外周血細胞因子IL-12、IL-22、IL-23、IL-23R、和TNF-α水平檢測結果見表2。所檢測的5種細胞因子在研究組患者外周血中水平較對照組高,差異有統計學意義(P<0.05)。
2.3T細胞及細胞因子間的相關性變化 研究組與對照組人群外周血T細胞及細胞因子間的相關性分析中,兩組間存在相關性改變的結果見表3、4、5。其中:(1)研究組CD4+T細胞與CD8+T細胞、Th17與CD3+T細胞、Th17與CD8+T細胞無明顯相關性(P>0.05),但對照組為負相關關系,差異有統計學意義(P<0.05);(2)研究組Th17與Treg為負相關關系,差異有統計學意義(P<0.01),但對照組為正相關關系,差異有統計學意義(P<0.05);(3)研究組IL-23與CD4+T細胞、TNF-α與DNT無明顯相關性,差異無統計學意義(P>0.05),但對照組為正相關關系,差異有統計學意義(P<0.05);(4)研究組IL-22與IL-23為正相關關系,差異有統計學意義(P<0.05),但對照組無明顯相關關系,差異無統計學意義(P>0.05);其余相關性在同向存在相關程度的差異。

表2 2組人群細胞因子水平分布[M(Q25,Q75)]

表3 兩組患者T細胞間相關性變化

表4 兩組患者Th17與其他T細胞相關性的變化

表5 兩組患者細胞因子間及與T細胞相關性的變化
2.4AECOPD患者T細胞及細胞因子潛在聯系分析 用因子分析方法對研究組和對照組13項觀察指標進行潛在聯系的分析,研究組和對照組分別存在5個公因子(即主成分),其總方差解釋度分別為75.74%和77.89%。研究組和對照組5個主成分的特征值見表6。進入5個主成分的觀察指標(負荷變量)及其系數與得分見表7、8。研究組與對照組比較,進入5個主成分的負荷變量發生了變化。

表6 2組主成分特征值

表7 研究組慢性阻塞性肺病急性加重期患者T細胞及細胞因子主成分變化
CD4:CD4+T細胞;CD8:CD8+T細胞;CD4/CD8:CD4+T細胞/CD8+T細胞

表8 慢性阻塞性肺病急性加重期患者T細胞及細胞因子主成分變化
CD4:CD4+T細胞;CD8:CD8+T細胞;CD4/CD8:CD4+T細胞/CD8+T細胞
2.5AECOPD患者T細胞及細胞因子與FVC、FEV1.0、FEV1.0/FVC的相關性 AECOPD患者的FVC、FEV1.0平均水平分別為(2.82±0.62)L、(2.11±0.43)L。Spearman相關性分析結果中,FEV1.0與第一主成分主要變量Th17/Treg、Th17、Treg存在相關性,相關系數r分別為-0.446(P=0.043)、-0.496(P=0.032)、0.467(P=0.033);FEV1.0/ FVC與TNF-α和IL-22存在相關性,相關系數r分別為-0.507(P=0.019)、-0.439(P=0.046);其余相關性差異無統計學意義(P>0.05)。
3 討 論
COPD的主要病理改變為有害氣體或顆粒導致氣道黏膜的慢性炎癥并持續發展,患者持續出現以咳嗽、咳痰、喘憋等為主要臨床表現的慢性氣管炎或合并伴隨肺氣腫。AECOPD即在穩定期COPD患者短期內出現上述等癥狀加重、咔膿痰或黏液痰,并伴發熱等癥狀出現,其發病原因常可分為感染和非感染因素。COPD或AECOPD其病理生理分子機制仍不清楚。在遺傳易感的基礎上,氣道受到吸煙等釋放的有害物質刺激,引發局部固有免疫防御,進而適應性免疫應答參與其中,在修復有害物質對氣道黏膜傷害的同時,產生炎癥反應并反復持續發生,甚至停止吸煙后仍持續發展。大量的研究顯示許多免疫細胞參與其中,主要有中性粒細胞、單核巨噬細胞、T淋巴細胞及多種細胞因子。免疫失衡是導致該病持續發展的重要病理生理機制,有學者提出其中還有自身免疫機制[9-10]。廣泛的臨床和動物模型研究均顯示COPD病程中存在T淋巴細胞各亞群功能平衡紊亂,普遍觀察到Th17、Treg細胞平衡紊亂,但存在不一致結果。有研究顯示COPD病程中Th17細胞和IL-17表達增強,Treg降低;也有研究顯示Treg細胞是升高而非降低,只是升高的幅度不及Th17細胞;也有學者認為在COPD不同階段,Th17、Treg細胞平衡變化存在差異[11]。這些結果提示,COPD與AECOPD發生發展中,免疫失衡機制復雜,觀察單方面或少數免疫細胞的增加或降低,難以找到其內在的免疫失衡機制。為此,本研究從多角度觀察了AECOPD外周血不同功能分類的T淋巴細胞百分比變化,相關的細胞因子變化及它們相互關系的變化,并通過因子分析的統計學處理,尋找COPD疾病狀態下主要免疫失衡機制。結果顯示:(1)AECOPD患者外周血中各類T淋巴細胞水平的變化中,CD8+T細胞水平較健康對照人群降低;Treg、Th17細胞水平較健康對照人群升高,但Treg升高的幅度不及Th17。(2)細胞因子層面觀察到AECOPD患者外周血IL-12、IL-22、IL-23、IL-23R和TNF-α水平較健康對照人群均升高。(3)通過對各類T細胞及細胞因子間的相關性分析發現,AECOPD疾病狀態下,CD4+T細胞與CD8+T細胞、CD3+T細胞與Th17、Th17與CD8+T細胞由負相關變為無相關;Th17與Treg由正相關(r=0.403)變為高度負相關(r=-0.883);IL-23與CD4+T細胞、TNF-α與DNT由正相關變為無明顯相關性;IL-22與IL-23由無相關性變為正相關;其余指標之間的相關性存在相同方向相關程度的變化。(4)因子分析的結果顯示,在AECOPD狀態下,主成分中負荷變量發生了諸多變化:健康狀態時處于第2主成分的Th17、Treg平衡機制上升為第1主成分,成為主要的免疫平衡機制;而健康狀態時以CD4+T細胞、CD8+T細胞平衡為首的機制退居第2,以IL-12、IL-23R為主要變量的第3主成分退居第4,出現CD4+T細胞、CD3+T細胞為主要變量的第3主成分。以TNF和DNT為主要變量的第5主成分退出主成分,但出現了以IL-23和IL-22為主要變量的第5主成分。(5)T細胞及細胞因子與FVC、FEV1.0、FEV1.0/FVC的相關性顯示,AECOPD患者FEV1.0與Th17呈負相關,與Treg呈正相關;FEV1.0/ FVC與TNF和IL-22呈負相關。
以上這些結果提示:(1)通過患者外周血中免疫細胞和細胞因子的監測,可以觀察到AECOPD狀態下機體免疫功能的變化,有助于指導其免疫輔助治療,因此,可以作為COPD的實驗室監測指標。(2)AECOPD狀態下,原有的機體免疫平衡機制受到破壞,產生了以Th17、Treg變化為主的平衡紊亂:更多的CD4細胞向Th17極化,促進Th17細胞增多,而具有免疫抑制功能的Treg細胞增多不到位,并出現負相關性改變;IL-12、IL-22、IL-23、IL-23R和TNF-α等細胞因子均參與其中,但以IL-22與IL-23為主,且IL-23主要促進T淋巴細胞向Th17分化與增殖,并分泌IL-22,后者進一步誘導中性粒細胞集落刺激因子的分泌并促進中性粒細胞的趨化到氣道,加重炎性反應和氣道受阻的程度;CD8的細胞毒作用、DNT的調節作用受到弱化。由此可以推測,COPD病理生理機制中的主要矛盾可能是:外因引發的Th17細胞功能增強超過抵御外因所致的損傷,進而導致過度免疫甚至自身免疫。
由于到本院住院救治的COPD患者均為AECOPD患者,本研究中研究對象主要從住院患者中募集,因此,未能募集到穩定期COPD患者,未對穩定期患者進行分組對比分析,上述觀察到的免疫平衡紊亂是否也存在于COPD穩定期患者,有待進一步觀察。
[1]RABE K F,HURD S,ANZUETO A,et al.Global strategy for the diagnosis,management,and prevention of chronic obstructive pulmonary disease:Gold executive summary[J].Am J Respir Crit Care Med,2007,176(6):532-555.
[2]中華醫學會呼吸病學分會慢性阻塞性肺疾病學組.慢性阻塞性肺疾病診治指南(2013年修訂版)[J/CD].中國醫學前沿雜志(電子版),2014,36(2):67-79,80.
[3]Raherison C.Epidemiology of chronic obstructive pulmonary disease[J].Nihon Rinsho,2009,38(3):400.
[4]ZHANG J,CHU S,ZHONG X,et al.Increased expression of CD4+IL-17+cells in the lung tissue of patients with stable chronic obstructive pulmonary disease (COPD) and smokers[J].Int Immunopharmacol,2013,15(1):58-66.
[5]SMYTH L J,STARKEY C,VESTBO J,et al.CD4-regulatory cells in COPD patients[J].Chest,2007,132(1):156-163.
[6]ISAJEVS S,TAIVANS I,STRAZDA G,et al.Decreased FOXP3 expression in small airways of smokers with COPD[J].Eur Respir J,2009,33(1):61-67.
[7]PLUMB J,SMYTH L J,ADAMS H R,et al.Increased T-regulatory cells within lymphocyte follicles in moderate COPD[J].Eur Respir J,2009,34(1):89-94.
[8]WANG H,PENG W,WENG Y,et al.Imbalance of Th17/Treg cells in mice with chronic cigarette smoke exposure[J].Int Immunopharmacol,2012,14(4):504-512.
[9]HONG S C,LEE S H.Role of th17 cell and autoimmunity in chronic obstructive pulmonary disease[J].Immune Netw,2010,10(4):109-114.
[10]ROVINA N,KOUTSOUKOU A,KOULOURIS N G.Inflammation and immune response in COPD:where do we stand[J].Mediators Inflamm,2013,2013(5):1-9.
[11]張蘭英,陳杰,歐陽瑤.DCs、Th17及Treg在COPD發病機制中作用的研究進展[J].醫學研究雜志,2016,45(7):18-20.

