ica操縱子對表皮葡萄球菌在不同骨科植入物表面黏附和生物膜形成的影響*
陳 鵬,李 波,彭 智,高 淦,陳 盛
(1.貴州省人民醫院骨科,貴陽 550002;2.陸軍軍醫大學西南醫院兒科,重慶 400038)
骨科植入物感染的發生率雖然較低,但是感染易依附植入材料形成生物膜,使感染遷延難愈導致感染治療的失敗[1-2]。表皮葡萄球菌是骨科植入物感染的最常見病原菌[3],其黏附和生物膜形成能力是致病能力的重要因素,將直接影響到治療結果。而ica操縱子合成的胞間多糖黏附素(polysaccharide intercellular adhesion,PIA)是其黏附和生物膜形成的關鍵因素。有研究表明ica操縱子對細菌的黏附和生物膜形成能力均具有重要影響[4-5],但目前尚未見有對骨科植入物及其黏附能力及生物膜形成能力的報道,據此本研究擬以臨床分離株為研究對象,探討ica操縱子基因表達對細菌在不同骨科植入物表面黏附和生物膜形成的影響。
1 材料與方法
1.1菌株來源和材料 17株表皮葡萄球菌中7株來源于貴州省人民醫院的植入物感染分離株,10株來源于陸軍軍醫大學西南醫院骨科植入物感染分離株。骨組織、鈦合金和不銹鋼生物材料被切割成直徑為10 mm,厚度為2 mm的圓盤形狀。骨組織材料采用新西蘭白兔的脊椎骨,用蒸餾水沖洗去除骨髓內容物,然后在室溫用含0.1%乙二胺四乙酸(EDTA) 的1× 磷酸鹽緩沖液(PBS)洗滌,70%乙醇和紫外線滅菌處理后在DMEM培養基上進行無菌檢查,孵育2周以排除培養基中的任何其他細菌生長。
1.2試劑和儀器 血瓊脂平板購自重慶龐通公司,胰蛋白胨大豆肉湯(TSB)培養基購自英國Oxoid公司,結晶紫購自美國Sigma公司,DNA、RNA提取試劑盒和瓊脂糖購自北京天根生物科技有限公司,2×Es Taq MasterMix購自北京康為世紀生物科技有限公司,反轉錄試劑盒和SYBR Green MasterMix購自上海東洋紡生物科技有限公司,三通道Flowcell購于美國IBI Scientific公司,酶標儀購自美國MD公司,PCR擴增儀、電泳儀及凝膠成像系統購自美國Bio-Rad公司,ica A、D、B、C基因引物[6]由美國Invitrogen公司合成。
1.3方法
1.3.1表皮葡萄球菌ica操縱子的基因檢測 表皮葡萄球菌劃線接種于血瓊脂平板,37 ℃恒溫培養過夜。從平板上挑取一個單菌落于10 mL TSB培養基中,37 ℃、180 r/min振蕩培養24 h。細菌DNA提取按照DNA提取純化試劑盒說明書進行。20 μL PCR反應體系:2×Es Taq MasterMix 10.0 μL,DNA 0.4 μL,上、下游引物各0.3 μL,ddH2O 9.0 μL。擴增反應條件:94 ℃預變性5 min;94 ℃變性30 s,57 ℃退火30 s,72 ℃延伸30 s,30個循環;最后72 ℃延伸10 min。擴增完畢,取10 μL PCR反應產物電泳,然后用凝膠成像系統觀察結果。
1.3.2表皮葡萄球菌icaADBC操縱子基因表達分析 采用熒光定量PCR檢測表皮葡萄球菌icaADBC基因表達情況。采用Trizol試劑提取細菌總RNA,并用紫外分光光度計測定RNA濃度。cDNA合成按照反轉錄試劑盒說明書進行。PCR反應體系(20 μL):2×SYBR Green 10.0 μL,cDNA 2.0 μL,上、下游引物各0.3 μL,ddH2O 7.4 μL。擴增條件:首先94 ℃預變性5 min;94 ℃變性30 s,57 ℃退火30 s,72 ℃延伸30 s,共40個循環。擴增反應完畢后以16S rRNA作為內參、標準菌株ATCC35984作為對照進行分析。所有實驗均重復3次。
1.3.3表皮葡萄球菌PIA水平測定 PIA水平檢測采用苯酚-硫酸法[7]。按1%接種量將表皮葡萄球菌過夜培養物轉種于100 mL TSB培養基中,37 ℃、150 r/min條件下振蕩培養 8 h。4 ℃、4 000 r/min條件下將菌液離心15 min并棄掉上清液。用蒸餾水重懸菌體,加入37%甲醛300 μL,4 ℃保存3 h。然后加入1 mol/L NaOH 20 mL,4 ℃再次保存3 h。4 ℃、12 000 r/min離心20 min,吸除上清液,留取沉淀待查。首先用標準葡萄糖溶液作為底物制作標準曲線,然后將待測沉淀稀釋后按同樣的方法進行顯色,酶標儀490 nm處測定光密度(OD)值并根據標準曲線計算出相應的PIA水平。
1.3.4表皮葡萄球菌對不同生物材料的黏附能力分析 采用菌落平板計數法檢測表皮葡萄球菌的黏附能力[8]。取表皮葡萄球菌過夜培養物100 μL轉種于10 mL TSB肉湯中,37 ℃、180 r/min恒溫振蕩培養24 h。然后將菌液用TSB培養基調整至1×107CFU/mL。將3種無菌的生物材料圓盤放入Flowcell孔道,每個孔道中加入200 μL菌液,共3個通道,靜置培養1 h。上游儲液瓶中加入TSB培養基,使培養基充滿整個流動管,待靜置完畢后,啟動Flowcell蠕動泵,4.2 mL/h流速,37 ℃培養4 h。培養完畢,取出生物材料放入無菌的24孔板中,加入1 mL PBS輕柔沖洗2次。然后再加入PBS超聲處理5 min,使黏附的細胞脫落。最后按10倍稀釋法將細胞懸浮液稀釋至合適的倍數后,取100 μL菌液涂布于TSB固體培養基,37 ℃培養24 h 后計數。每個樣本設置3個平行組,實驗重復3次。
1.3.5表皮葡萄球菌對不同生物材料的生物膜形成能力分析 取表皮葡萄球菌過夜培養物100 μL轉種于10 mL TSB肉湯中,37 ℃、180 r/min恒溫振蕩培養24 h。然后將菌液用TSB培養基調整至1×107CFU/mL。Flowcell每個孔道中加入200 μL菌液,共3個通道,靜置培養1 h。上游儲液瓶中加入TSB培養基,使培養基充滿整個流動管,待靜置完畢后,啟動Flowcell蠕動泵,4.2 mL/h流速,37 ℃培養24 h。培養完畢,取出生物材料放入無菌的24孔板中,每孔加入1 mL PBS輕柔沖洗2次后,在通風陰涼處風干。然后每孔加入1 mL 1%結晶紫溶液進行染色,自來水沖洗干凈后,于通風陰涼處再次風干。最后每孔加入30%冰乙酸500 μL進行溶解,取100 μL在酶標儀590 nm處測定OD值。
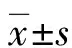
2 結 果
2.1表皮葡萄球菌ica操縱子的基因檢測 17株表皮葡萄球菌臨床菌株中,SE157、SE159、SE160、SE162、SE164、SE165、SE166、SE167、SE169、SE171、SE172 共11株菌株攜帶icaADBC 4種基因,其他6株擴增結果為陰性。
2.2表皮葡萄球菌ica操縱子基因表達分析 11株ica操縱子基因陽性菌株的基因表達情況如圖1所示。所有臨床菌株icaADBC 4種基因均有不同程度的表達,且其基因表達均高于標準菌株ATCC35984。

圖1 表皮葡萄球菌icaADBC操縱子基因表達
2.3表皮葡萄球菌PIA水平測定 ica操縱子基因陽性菌株PIA水平測定結果如圖2所示。所有臨床菌株PIA表達水平均大于標準菌株ATCC35984,且ica操縱子基因表達水平高的菌株其PIA表達水平也高,即PIA表達水平與ica操縱子基因表達水平一致。

圖2 表皮葡萄球菌PIA水平測定
2.4表皮葡萄球菌對不同生物材料的黏附能力分析 表皮葡萄球菌在不同生物材料上的黏附能力見表1。結果顯示,表皮葡萄球菌菌株對骨組織的黏附能力最強,對鈦合金的黏附能力大于不銹鋼金屬材料。此外,17株臨床菌株對3種生物材料的黏附能力均大于標準菌株ATCC35984。

表1 表皮葡萄球菌在不同生物材料上的黏附能力

續表1 表皮葡萄球菌在不同生物材料上的黏附能力
2.5表皮葡萄球菌對不同生物材料的生物膜形成能力分析 所有表皮葡萄球菌菌株在骨組織上的生物膜形成能力最強,且在鈦合金上的生物膜形成能力高于不銹鋼。此外,所有臨床菌株的生物膜形成能力均高于標準菌株ATCC35984,見圖3。

圖3 表皮葡萄球菌在不同生物材料的生物膜形成能力
2.6表皮葡萄球菌icaA基因表達與生物膜形成能力的相關性分析 通過Spearman相關系數分析icaA基因表達與細菌生物膜的相關性,結果顯示,11株icaA陽性菌株基因表達與其在不銹鋼、鈦合金及骨組織上的生物膜形成之間存在正相關關系(r=0.891、0.700、0.627,P=0.000、0.016、0.039)。
3 討 論
表皮葡萄球菌是細菌生物膜感染的最常見菌株之一,是骨科移植物和導管感染中首要病原菌[9-10]。生物膜主要由細菌和自身分泌的胞外基質構成,而胞外基質包括胞外多糖、各種蛋白等[11]。PIA是表皮葡萄球菌生物膜形成聚集階段最重要的物質基礎[12]。表皮葡萄球菌ica操縱子基因座包括調節基因icaR及串聯存在的icaA、icaD、icaB和icaC 4個基因。icaA、icaD、icaB、icaC基因構成一個操縱子,共同完成PIA的合成,因此可以通過檢測icaA、icaD、icaB、icaC基因來反映ica操縱子的存在[13]。本研究分別擴增icaA、icaD、icaB、icaC操縱子中的4個基因發現該操縱子無單個基因缺失的情況存在,與國外報道一致[14]。有研究表明血液、導管、人工關節分離的表皮葡萄球菌中ica操縱子檢出率明顯高于正常皮膚黏膜來源的菌株[15-16]。本研究中有11株(73%)ica操縱子表達陽性,高于文獻報道的16.5%~53.4%[17-18],筆者認為這種差異可能是病原菌來源不同導致的,由于本研究的菌株均來源于骨科生物材料相關感染且藥物治療失敗的患者,該類菌可能具有較強的生物膜形成能力,因此具有較高的ica操縱子攜帶比例。此外,本研究中并未發現攜帶ica操縱子基因但是并不表達PIA的菌株,且ica操縱子基因表達高的菌株其PIA表達水平也較高,表明ica操縱子基因的轉錄表達水平與PIA的表達水平密切相關,ica操縱子基因通過調節PIA表達水平來影響細菌生物膜的形成。表皮葡萄球菌生物膜形成的調節機制包括icaADBC依賴和非icaADBC依賴兩種途徑。本研究中ica操縱子基因的表達與細菌在3種材料上生物膜形成能力相關,但是并非icaA高表達的菌株就有較強的生物膜形成能力,提示ica操縱子在細菌生物膜形成過程中具有重要作用,但不是惟一因素,可能還有其他基因及其產物對生物膜形成和PIA合成有重要作用。
本研究對臨床分離表皮葡萄球菌黏附和生物膜的觀察采用了“流室法”(Flowcell),該方法具有可連續觀察細菌生物膜形成過程的優點,且在流動的液體培養基的沖刷作用下,因沉積附于生物膜的細菌會被培養基帶走,而避免了浮游菌大量沉積對生物膜形成的影響,同時避免了細菌沉積生物膜表面導致對生物膜形成檢測結果的影響[19]。本研究中同組別細菌生物膜形成差異較小,表明Flowcell研究生物膜形成的方法具有結果穩定可靠的特點,因此在國外應用極其廣泛,但國內配套儀器不足和配套耗材較貴,在國內研究報道較少。
研究發現與標準菌株ATCC35984比較,骨科植入物相關感染表皮葡萄球菌具有較強的黏附和生物膜形成能力,尤其對骨組織具有較強的黏附和生物膜形成能力,對鈦的黏附和生物膜形成能力均強于不銹鋼,與文獻[20-21]報道一致。骨組織在處理后由于粗糙并存在小孔,可能是導致表皮葡萄球菌易于黏附的主要原因。但是在體內由于免疫細胞和免疫分子可在骨組織中分布,因此體內外的結果可能會有不同,本研究為臨床骨科材料的使用提供了理論依據。
[1]JORDAN R P,MARSH L,AYRE W N,et al.An assessment of early colonisation of implant-abutment metal surfaces by single species and co-cultured bacterial periodontal pathogens[J].J Dent,2016,53:64-72.
[2]PHILLIPS C B,BARRETT J A,LOSINA E,et al.Incidence rates of dislocation,pulmonary embolism,and deep infection during the first six months after elective total hip replacement[J].J Bone Joint Surg Am,2003,85-A(1):20-26.
[3]HAMAD T,HELLMARK B,NILSDOTTER-AUGUSTINSSON A,et al.Antibiotic susceptibility among Staphylococcus epidermidis isolated from prosthetic joint infections,with focus on doxycycline[J].APMIS,2015,123(12):1055-1060.
[4]FLUCKIGER U,ULRICH M,STEINHUBER A,et al.Biofilm formation,icaADBC transcription,and polysaccharide intercellular adhesin synthesis by staphylococci in a device-related infection model[J].Infect Immun,2005,73(3):1811-1819.
[5]WU Y,WANG J X,XU T,et al.The two-component signal transduction system ArlRS regulates Staphylococcus epidermidis biofilm formation in an ica-dependent manner[J].PLoS One,2012,7(7):e40041.
[6]ARCIOLA C R,GAMBERINI S,CAMPOCCIA D,et al.A multiplex PCR method for the detection of all five individual genes of ica locus in Staphylococcus epidermidis.A survey on 400 clinical isolates from prosthesis-associated infections[J].J Biomed Mater Res A,2005,75(2):408-413.
[7]孫鳳軍,馮偉,劉耀,等.亞抑菌濃度頭孢他啶對大腸埃希菌胞外多糖和pga基因的影響[J].解放軍藥學學報,2016,32(6):494-496.
[8]孫鳳軍,洪海,馮偉,等.尿路感染分離金黃色葡萄球菌生物膜形成能力及相關基因的分析[J].重慶醫學,2016,45(19):2617-2619.
[9]CAMPOCCIA D,MONTANARO L,ARCIOLA C R.A review of the clinical implications of anti-infective biomaterials and infection-resistant surfaces[J].Biomaterials,2013,34(33):8018-8029.
[10]WILKINS M,HALL-STOODLEY L,ALLAN R N,et al.New approaches to the treatment of biofilm-related infections[J].J Infect,2014,69(Suppl 1):S47-52.
[11]LIMOLI D H,JONES C J,WOZNIAK D J.Bacterial extracellular polysaccharides in biofilm formation and function[J].Microbiol Spectr,2015,3(3):1-30.
[12]STEWART E J,GANESAN M,YOUNGER J G,et al.Artificial biofilms establish the role of matrix interactions in staphylococcal biofilm assembly and disassembly[J].Sci Rep,2015,5:13081.
[13]WU Y,LIU J,JIANG J,et al.Role of the two-component regulatory system arlRS in ica operon and aap positive but non-biofilm-forming Staphylococcus epidermidis isolates from hospitalized patients[J].Microb Pathog,2014,76:89-98.
[14]ARGUDIN M A,VANDERHAEGHEN W,VANDENDRIESSCHE S,et al.Biofilm formation of ica operon-positive Staphylococcus epidermidis from different sources[J].APMIS,2015,123(12):1081-1089.
[15]MERTENS A,GHEBREMEDHIN B.Genetic determinants and biofilm formation of clinical Staphylococcus epidermidis isolates from blood cultures and indwelling devises[J].Eur J Microbiol Immunol(Bp),2013,3(2):111-119.
[16]CHO S H,NABER K,HACKER J,et al.Detection of the icaADBC gene cluster and biofilm formation in Staphylococcus epidermidis isolates from catheter-related urinary tract infections[J].Int J Antimicrob Agents,2002,19(6):570-575.
[17]TANG Q,YUAN B,HUANG Y,et al.[Biofilm and role of icaA,icaD,and accumulation-associated protein in Staphylococcus epidermidis isolated in breast surgery][J].Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi,2014,28(2):244-249.
[18]JUAREZ-VERDAYES M A,RAMON-PEREZ M L,FLORES-PAEZ L A,et al.Staphylococcus epidermidis with the icaA-/icaD-/IS256-genotype and protein or protein/extracellular-DNA biofilm is frequent in ocular infections[J].J Med Microbiol,2013,62(Pt 10):1579-1587.
[19]PAPADIMITRIOU-OLIVGERI I,GIORMEZIS N,PAPADIMITRIOU-OLIVGERIS M,et al.Number of positive blood cultures,biofilm formation,and adhesin genes in differentiating true coagulase-negative staphylococci bacteremia from contamination[J].Eur J Clin Microbiol Infect Dis,2016,35(1):57-66.
[20]RIOOL M,DE BOER L,JASPERS V,et al.Staphylococcus epidermidis originating from Titanium implants infects surroundingtissue and immune cells[J].Acta Biomater,2014,10(12):5202-5212.
[21]PEREZ-TANOIRA R M,HYYRYNEN T.Effect of S53P4 bone substitute on staphylococcal adhesion and biofilm formation onother implant materials in normal and hypoxic conditions[J].J Mater Sci Mater Med,2015,26(9):239.

