內鏡黏膜下剝離術聯合前哨淋巴結活檢術與根治性切除治療早期胃癌的效果對比分析
姬 樂,李小寶,高永濤,劉 濤,白 浪
早期胃癌是指癌灶僅位于胃黏膜下層或胃黏膜層,不論癌灶大小及淋巴結轉移情況[1-2]。手術是治療早期胃癌的“金標準”,根治性手術治療是傳統的手術方式,療效公認。隨著微創技術的發展,內鏡黏膜下剝離術(ESD)已廣泛應用于早期胃癌患者的手術治療,且具有創傷小、恢復快等優點[3]。但是早期胃癌患者易發生淋巴結轉移,會對手術切除范圍及患者預后造成影響[4]。前哨淋巴結(SLN)是指原發腫瘤引流最初的淋巴結,是最可能發生轉移的淋巴結[5]。對SLN進行檢測可評估淋巴結轉移情況進而為手術范圍的選擇提供參考[6]。故ESD聯合SLN活檢術可提高早期胃癌的手術治療效果及減少創傷。本研究通過對比分析ESD聯合SLN活檢術與根治性切除治療早期胃癌的效果,旨在為臨床上早期胃癌治療方法的選擇提供理論依據,具體內容報告如下。
1 資料與方法
1.1一般資料 選取2010年3月—2014年10月延安大學附屬醫院收治的92例早期胃癌患者的臨床資料進行回顧性分析。①納入標準:所有患者均在術前經胃鏡等輔助檢查顯示有早期病灶及明確病變起源層次,并排除腹腔臟器及淋巴結轉移,術后病理結果均為癌前病變或早期胃癌;所有患者均為初次診治,符合相關手術治療指征。②排除標準:術前伴遠處轉移者;伴急性血液系統感染者;患有神經、精神疾病者;合并嚴重肝腎功能障礙者。根據手術方式的不同將患者分為A組和B組,每組46例。其中A組男26例,女20例;年齡45~75(61.62±4.83)歲;腫瘤位置:胃上1/3者4例,胃中1/3者12例,胃下1/3者30例;腫瘤分化程度:高分化34例,中分化11例,低分化1例;腫瘤直徑(1.79±0.53)cm。B組男27例,女19例;年齡46~74(62.02±4.86)歲;腫瘤位置:胃上1/3者5例,胃中1/3者13例,胃下1/3者28例;腫瘤分化程度:高分化32例,中分化12例,低分化2例;腫瘤直徑(1.81±0.56)cm。兩組性別、年齡、腫瘤位置、腫瘤分化程度和腫瘤直徑比較差異均無統計學意義(P>0.05),具有可比性。
1.2手術方法 A組給予ESD聯合SLN活檢術治療。①SLN活檢術:囑患者取平臥位,全身麻醉建立氣腹,主操作孔選擇左腋前線肋緣下2 cm,做1.2 cm切口,副操作孔選擇在臍左5 cm偏上1 cm處,做0.5 cm切口。借助胃鏡在癌灶四周黏膜下層分4點注射0.5%專利藍3 ml。SLN即為注射后15 min內出現藍染的淋巴結。將藍染的周圍組織及淋巴結用超聲刀分離,送快速病理切片。病理結果顯示為陰性26例行ESD術治療,陽性20例行腹腔鏡D2根治術。②ESD術:在癌灶周圍0.5 cm處進行電凝標記,標記處黏膜下多點注射甘油果糖和沒藍的混合液將癌灶抬起,將黏膜沿著標記緣進行切開,再剝離病灶部位黏膜,剝離的過程中注意出血、止血。最后進行常規創面止血,手術完成。測量切除病灶大小,固定好送病理檢測。③腹腔鏡胃癌D2根治性切除:大網膜采用超聲刀進行離斷及將橫結腸系膜前葉剝離,清掃第4組淋巴結,再將胃網膜右血管裸化清掃第6組淋巴結。向上分離十二指腸動脈,清掃第12a組及5組淋巴結,自右向左沿肝固有動脈清掃第7組、8a組、9組、11p組淋巴結,自上而下沿胃小彎清掃第3組、1組淋巴結,最后在上腹做一切口將標本取出,行Ⅰ式吻合,留置腹腔引流管,常規送病理檢測。B組給予根治性切除治療,給予全身麻醉后行常規胃大部切除術。
1.3觀察指標 隨訪3年,術后每間隔2個月復查腫瘤指標及胃鏡,每間隔6個月復查CT。記錄兩組的住院時間、術中出血量、并發癥的發生情況以及術后1、3年復發率和術后3年生存率等。
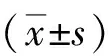
2 結果
2.1復發率和生存率比較 兩組術后1、3年復發率及術后3年生存率比較差異均無統計學意義(P>0.05)。見表1。

表1 兩組早期胃癌患者的復發率和生存率比較[例(%)]
注:A組給予內鏡黏膜下剝離術聯合前哨淋巴結活檢術治療,B組給予根治性切除治療
2.2住院時間及術中出血量比較 A組住院時間和術中輸血量均少于B組(P<0.01)。見表2。

表2 兩組早期胃癌患者的住院時間及術中出血量比較
注:A組給予內鏡黏膜下剝離術聯合前哨淋巴結活檢術治療,B組給予根治性切除治療
2.3并發癥情況 A組發生胃穿孔1例、胃出血2例,并發癥總發生率為6.52%。B組發生切口感染2例、腸粘連1例、腹腔膿腫1例、吻合口狹窄1例,并發癥總發生率為10.87%。兩組并發癥總發生率比較差異無統計學意義(χ2=0.548,P=0.459)。且兩組發生的并發癥經對癥處理后均能緩解。
3 討論
胃癌是我國常見的惡性腫瘤,發病率僅次于肺癌,死亡率也位居癌癥死亡的第四位[7-8]。早期胃癌的治療原則為根除癌灶、預防復發及最大程度的延長患者生存時間[9-10]。手術治療仍是臨床上公認的有可能治愈的唯一手段,根治性切除手術是傳統的治療方式,可有效的切除癌灶,但是存在手術創傷大、術后恢復慢等不足[11-13]。隨著內鏡技術的發展,ESD已廣泛應用于早期胃癌的治療,可減少手術應激、創傷,有利于促進患者生理及心理的康復。日本胃癌學會將微創手術作為早期胃癌的標準術式之一[14-15]。由于ESD只對原發病灶進行切除,很少系統性的進行淋巴結清掃,故易引起淋巴結轉移及復發問題出現[16-17]。有研究報道,癌灶侵犯黏膜下層時的淋巴結轉移率可高達11.0%,且胃癌的淋巴回流吻合支路、回流路徑多,故可引起多向性淋巴結轉移[18-21]。因此,ESD對于有淋巴結轉移的早期胃癌患者存在一定局限性。
SLN活檢術可對早期胃癌患者淋巴結轉移情況進行評估[22-23]。SLN活檢術最早在惡性黑色素瘤和乳腺癌治療中應用,然后逐漸在胃癌、肝癌等實體瘤中應用[24]。在早期胃癌患者術中切取SLN并進行快速病理送檢,對于SLN陽性患者則表示存在淋巴結轉移,此時可行胃癌D2根治性手術治療,可有效地改善患者預后[25-27]。對于SLN陰性患者,則行ESD術治療,可不清掃或減小淋巴結清掃的范圍以及避免沒必要的胃切除術,能夠促進患者康復,提高術后生命質量[6]。相關研究報道,根治性切除治療早期胃癌患者的5年生存率可高達85%~96%[28]。本研究結果顯示,兩組術后1、3年復發率、術后3年生存率以及并發癥總發生率比較均無差異。這表明ESD聯合SLN活檢術與根治性切除治療早期胃癌的效果相當,通過ESD可有效地清除病灶且不會增加復發危險性,安全可靠。根治性切除治療可在直視情況下進一步將引流區域淋巴結清掃,故復發率較低[29]。ESD術在SLN活檢術基礎上,淋巴結轉移陽性檢出率也較低,故復發率也低,所以療效相當。另外,ESD術水平或垂直切緣陰性率更高,故腫瘤殘端所引起的復發率也較低[30]。本研究結果還顯示,ESD聯合SLN活檢術相比傳統根治性切除可縮短患者住院時間、減少術中輸血量,從而促進患者康復。
綜上所述,ESD聯合SLN活檢術與根治性切除治療早期胃癌的效果相當,但ESD聯合SLN活檢術可縮短住院時間、減小手術創傷,故對于符合ESD聯合SLN活檢術治療指征的患者,如絕對適應證:腫瘤直徑<2 cm的分化型黏膜內癌,無潰瘍,不論內鏡形態。擴大適應證:①腫瘤直徑≥2 cm的分化型黏膜內癌,不伴潰瘍;②腫瘤直徑<2 cm的未分化型黏膜內癌,無潰瘍;③腫瘤直徑<3 cm的分化型黏膜內癌,有潰瘍者。可首選ESD聯合SLN活檢術進行治療。
[參考文獻]
[1] 史俊峰,許示心,費伯健,等.微創外科聯合前哨淋巴結活檢術治療早期胃癌[J].中華普通外科雜志,2015,30(10):766-769.
[2] 牛應林,蔡軍,李鵬,等.內鏡黏膜下剝離術聯合腹腔鏡淋巴結切除術治療有淋巴結轉移風險的早期胃癌的臨床探討[J].中華消化內鏡雜志,2017,34(7):508-509.
[3] 米亞賽爾·力提甫,郭沁,高峰.內鏡黏膜下剝離術治療早期胃癌的療效及安全性分析[J].山西醫藥雜志,2017,46(14):1734-1736.
[4] 朱俊宇,時強,周平紅,等.內鏡黏膜下剝離術后追加胃切除術對早期胃癌患者預后的影響[J].中華胃腸外科雜志,2016,19(8):912-916.
[5] 時強,朱俊宇,戴春紅,等.內鏡黏膜下剝離術治療殘胃早期癌或癌前病變的療效分析[J].中華胃腸外科雜志,2015,18(2):155-158.
[6] 姚鎮東,徐剛,萬榮,等.內鏡下黏膜剝離術及外科手術治療137例早期胃癌的臨床分析[J].中國中西醫結合消化雜志,2016,24(10):754-757,761.
[7] 凌亭生,陳光俠,王雷,等.內鏡黏膜下剝離術治療殘胃腺上皮高級別上皮內瘤變及早期癌臨床意義探討[J].中華消化內鏡雜志,2015,32(7):427-431.
[8] 鐘曉剛,王曉通,殷舞,等.進展期胃癌根治術(畢Ⅱ式)后幽門螺旋桿菌感染情況及藥物干預的臨床效果觀察[J].中國臨床新醫學,2016,9(10):851-853.
[9] 高波,王麗.系統護理結合個體化干預在內鏡黏膜下剝離術治療早期胃癌中的應用[J].實用臨床醫藥雜志,2015,19(20):125-127.
[10] 杜玉秀.胃鏡下黏膜染色聯合黏膜切除術在早期胃癌和癌前病變中的應用[J].中國煤炭工業醫學雜志,2013,16(8):1322-1323
[11] 佘青,李有懷,程永剛,等.全腔鏡乳房皮下腺體切除術聯合腔鏡前哨淋巴結活檢術治療早中期乳腺癌的技巧探討[J].川北醫學院學報,2016,31(5):756-758.
[12] 于芷晗,常鐵君,趙雪峰.內鏡黏膜下剝離術及手術治療胃黏膜下癌的手術指征分析[J].醫學與哲學,2015,36(12B):38-40.
[13] 嚴建宇,陳倫牮,楊欽清,等.腹腔鏡胃癌根治術對T細胞亞群及CRP、IL-6表達水平的影響[J].武警后勤學院學報:醫學版,2013,22(7):595-597.
[14] 李全營,秦長江,郭國校,等.二級前哨淋巴結活檢技術在進展期胃癌手術中的應用[J].中國普通外科雜志,2015,24(6):892-894.
[15] 任瑋,張松,王萌,等.前哨淋巴結導航技術在早期胃癌內鏡非治愈性切除后腹腔鏡處理中的應用價值[J].中華消化內鏡雜志,2016,33(12):826-828.
[16] 龔慶豪,蔡一亭,陳海群,等.胃癌患者血清HMGB1及前哨淋巴結檢測與腫瘤標志物含量、腫瘤組織惡性分子表達量的關系[J].海南醫學院學報,2016,22(16):1855-1858.
[17] 何元.二級前哨淋巴結技術在D2胃癌根治術中的臨床應用[J].空軍醫學雜志,2016,32(3):192-195.
[18] 吳凱,劉偉,馮旭剛,等.前哨淋巴結定位檢測在早期診斷進展期胃癌中的作用分析[J].海南醫學院學報,2015,21(6):805-807.
[19] 涂敏,朱振舒,時林森,等.胃癌轉移淋巴結評估手段的研究現狀及遠景[J].中華胃腸外科雜志,2012,15(2):197-200.
[20] 王征,周志祥,梁建偉,等.早期胃癌的淋巴結轉移規律及預后分析[J].癌癥進展,2011,9(3):315-319.
[21] 李丹丹.早期胃癌臨床病理特征與淋巴結轉移的相關分析[J].中國現代醫生,2017,55(11):94-96.
[22] Han J P, Hong S J, Kim H K,etal. Risk stratification and management of non-curative resection after endoscopic submucosal dissection for early gastric cancer[J].Surg Endosc, 2016,30(1):184-189.
[23] 周博,楊言通,王公平,等.前哨淋巴結導航技術在老年早期胃竇部腺癌手術中的應用價值[J].新鄉醫學院學報,2017,34(4):316-319.
[24] 費挺,余勤,齊長磊.進展期胃癌根治術中二級前哨淋巴結技術的應用[J].中華胃腸外科雜志,2016,19(10):1184-1186.
[25] 汪志仿.術中分站淋巴結活檢在進展期胃癌根治術中的臨床意義[J].現代醫學,2015,43(6):775-777.
[26] 趙剛,武青生,穆元忠,等.腹腔鏡輔助下D2根治術對進展期遠端胃癌患者臨床療效、術后并發癥及住院時間的影響[J].癌癥進展,2017,15(11):1335-1337,1341.
[27] 劉紅權,劉傳淵,方傳發.腹腔鏡胃癌D2根治術與傳統開腹胃癌D2根治術的療效與安全性比較[J].中國當代醫藥,2013,20(32):24-25,27.
[28] 梁麗,張繼新,戎龍,等.80例早期胃癌及癌前病變內鏡黏膜下剝離術標本的處理及病理學評估[J].中華消化內鏡雜志,2016,33(9):589-597.
[29] 屠惠明,費伯健,楊帆,等.術前活檢方法對早期胃癌及上皮內瘤變內鏡黏膜下剝離術手術過程的影響[J].中華消化內鏡雜志,2015,32(11):743-746.
[30] 武育衛,何雙麗,胡文華,等.內鏡黏膜下剝離術治療食管和胃早期癌及上皮內瘤變的臨床研究[J].臨床內科雜志,2017,34(2):123-125.

