A型肉毒素重鏈干預神經細胞組蛋白3乙酰化水平的初步研究
蘭 婧,劉 福,高 揚,李志強,劉 雅,趙明偉,袁海霞,李夏青*
(1.山西醫科大學病理生理教研室,太原 030001; 2.山西醫科大學第一臨床醫學院,太原 030001)
A型肉毒素(botulinum neurotoxin serotype A,BoNT/A)是目前研究較為廣泛、也是臨床作為藥物應用的主要生物毒素制劑之一,例如:利用BoNT/A阻止神經突觸前膜神經遞質釋放的毒性機制將其用于緩解或治療某些與肌肉收縮過度有關的臨床疾患(斜頸、面肌痙攣、尿失禁、偏頭痛、簇集性頭痛、多汗癥、皮膚除皺等)。BoNT/A分子由一條重鏈(heavy chain-HC, 分子量為100×103)和一條輕鏈(light chain-LC,分子量為50×103)構成,由二硫鍵相互連接。重鏈的羧基端含有與突觸前膜蛋白受體結合的位點,可與膜受體結合形成毒素-受體復合物,輕鏈隨重鏈內吞進入細胞發揮毒性作用[1]。本研究團隊的前期研究結果顯示人工重組的BoNT/A重鏈可促進體外培養的神經細胞突起生長;在體實驗也進一步證實BoNT/A重鏈可干預脊髓損傷后局部多種分子量水平的蛋白表達[2-3]。然而,就目前而言,BoNT/A的很多功能并不能單獨用毒素的致毒機理解釋。毒素分子中的重鏈與宿主細胞膜受體結合所引起的細胞內信號系統的改變及其影響已受到重視。
經典遺傳學信息提供了各種蛋白(包括表觀遺傳學修飾蛋白在內)、RNA的結構信息,而表觀遺傳學信息則提供何時、何處合成何種蛋白及 RNA的指令,從而嚴密地控制著蛋白及RNA的功能[4]。組蛋白乙酰化屬于組蛋白表觀修飾的表現之一,組蛋白的乙酰化/去乙酰化相互作用可形成特殊的密碼而影響其他蛋白因子的活動[5]。在所有的組蛋白中,組蛋白3(H3)和組蛋白4(H4)的乙酰化對基因表達調控及隨后的蛋白合成表達的影響已有較為廣泛的研究[4]。
神經損傷后的再生修復依賴于蛋白合成、尤其是生長相關蛋白的合成。有文獻報道[6],BoNT/A重鏈可以促進體外培養的運動神經細胞突起增長,本研究團隊的前期實驗也觀察到在體應用BoNT/A重鏈可以使脊髓損傷局部蛋白表達出現多種變化。這些研究結提示:BoNT/A重鏈可干預蛋白合成相關的細胞內各種信號途徑。基于組蛋白乙酰化對蛋白合成及表達的重要作用,本研究擬通過離體和在體兩種方法觀察BoNT/A對組蛋白亞型3的乙酰化水平的影響,旨在對BoNT/A重鏈的生物學作用有更進一步的認識。
1 材料和方法
1.1 實驗動物
SPF級SD大鼠48只,雄性,體重200~220 g,6周齡,來源于北京海淀興旺實驗動物養殖場[SCXK(京)2014-0013],飼養于本實驗室獨立動物房[SYXK(晉)2015-0001]。動物模型的手術操作按照山西醫科大學動物使用倫理委員會的規定執行(IACUC2017-001)。
1.2 主要試劑與儀器
Neuro-2a細胞購自中國科學院上海細胞庫; BoNT/A重鏈、A型肉毒素重鏈購自美國List Biological Laboratories, Inc; Bradford 法蛋白濃度測定試劑盒 (Sangon Biotech, C503031,China); EasySee Western blot kit (TRAN, DW101, China); 10%胎牛血清(美國Hyclone公司);兔抗乙酰化-H3抗體 (1∶1000,monoclone,CST,USA);HRP標記的goat anti rabbit二抗(1∶500,上海生工);凝膠成像系統(Bio-Rad,USA); 多功能酶標儀(Molecular Devices, SpectraMax@190,USA);多功能電泳儀(Bio-Rad, USA)。
1.3 實驗方法
1.3.1細胞培養
將Neuro-2a細胞懸浮含有10%胎牛血清和1%青鏈霉素的DMEM-HG培養液后、接種于用0.01%多聚賴氨酸鋪被的培養板內, 置于37℃ 5% CO2的孵箱內進行培養。用于蛋白表達測定的細胞接種密度為1×106/mL,置于24孔培養板內,每6孔為一組,分為4組:(1)正常對照組;(2)BoNT/A重鏈處理24 h組;(3)BoNT/A重鏈處理48 h組;(4)BoNT/A重鏈處理72 h組。根據前期實驗結果,BoNT/A給予劑量為: 1 ng/L (終濃度)。待細胞完全貼壁生長后(4 h左右)加入BoNT/A重鏈,用于神經突起測定的細胞接種密度為每孔1×105,置于96孔培養板內,分組和BoNT/A重鏈劑量同上。
1.3.2神經突起測定
BoNT/A重鏈作用后Neuro-2a 細胞突起測定:細胞接種后隨機分為對照組和實驗組(0.1 nmol/L 組和1 nmol/L 組)每組8個孔,于細胞貼壁生長后4 h時,實驗組加入不同濃度的BoNT/A重鏈,陰性對照組加入等劑量的DMEM 基礎培養液,分別于給藥后24 h、48 h 和72 h將細胞置于相差倒置顯微鏡攝影,每孔隨機視野拍攝2~3張圖片,每組共20張圖片,用于細胞突起的測定,包括:(1)具有突起的細胞占細胞總數的比例(%),細胞計數采用Photoshop CS軟件;(2)測量神經突起長度,采用ImageJ軟件進行。
1.3.3脊髓損傷及BoNT/A重鏈給藥
采用鞘內注射給藥:6 μg/20 μL,BoNT/A重鏈+生理鹽水,收取不同時間點脊髓組織。經皮腰骶部鞘內給藥的方法參照文獻[3]略作改動,具體方法如下:1%的戊巴比妥鈉腹注射麻醉,0.4 mL/100 g。將全身麻醉后的脊髓損傷模型大鼠后背位固定于鼠臺,大鼠腰骶部下方放置直徑約為3~5 cm圓柱狀筒物體,使L6~S1間隙充分張開便于實驗操作。剪毛,碘伏消毒穿刺中心皮膚,拇指和中指觸摸大鼠雙側髂嵴并向兩側繃緊皮膚,食指于兩側髂嵴連線同一水平觸摸大鼠脊椎,觸及最高點即為L6 棘突,在 L6~S1 間隙采用 20 G穿刺針垂直刺入皮膚、皮下肌層,當出現落空感、同時看到大鼠甩尾,證明針尖已經進入蛛網膜下腔,此時將針頭旋轉180°,同時刺針向尾側傾斜約30°,繼續向前推進1 mm 左右。隨后將充滿生理鹽水的經改造的PE-10 聚乙烯導管從穿刺針內部緩慢插入約1 cm,導管插入過程中可出現腦脊液流出、動物甩尾等顯著特征以充分證明導管置入成功。此時用微量注射器將6 μg/20 μL,BoNT/A重鏈+生理鹽水沿PE-10管緩慢注射到鞘內,注射完成后停留片刻再將20 μL的生理鹽水沿PE-10管注入鞘內,以保證BoNT/A重鏈制劑全部進入鞘內。單獨脊髓損傷動物注射相同劑量生理鹽水。在注射后保持頭低足高位約5 min。給藥后每只單獨飼養,分別于給藥后2 h、12 h、24 h、48 h、4 d、8 d收取大鼠脊髓標本,每組6只。
模型動物術后的大體解剖及組織學觀察皆顯示明顯的脊髓單側損傷(圖1)。
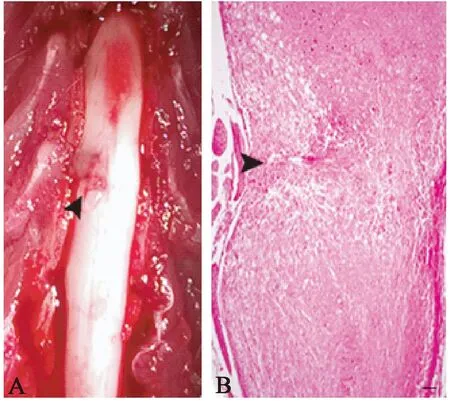
注:箭頭:損傷部位。圖1 脊髓損傷的大體及組織學觀察(Bar=100 μm)Note.The arrow heads indicate the injury sites.Fig.1 Gross and histological changes of spinal cord injury in a rat
1.3.4Western blot
組織和細胞樣本經Bradford protein assay確定蛋白含量后,每個樣本上量樣為30 μg。進行SDS-PAGE后轉至PDVF膜,將膜浸于5%脫脂奶粉溶液內封閉1 h,加入兔抗乙酰化-H3抗體(1∶1000,monoclone,CST,USA),4℃搖床過夜,次日用TBST液充分洗滌(5次× 5 min),HRP標記的goat anti rabbit二抗(1∶500)孵育1 h,TBST洗膜(5次× 5 min),發光液作用3 min,暗室曝光,Bio-Rad圖像處理。
1.4 統計學方法
2 結果
2.1 BoNT/A重鏈的促神經突起生長與細胞內H3乙酰化水平相匹配
將不同濃度的BoNT/A 重鏈加入Neuro-2a細胞培養不同時間可見細胞突起生長明顯增長,尤以濃度為1 nmol/L時作用最為顯著。24,48,72 h三個時間點的突起測定結果顯示,1 nmol/L濃度時神經突起增長的長度約是對照組細胞突起長度的2倍以上(P< 0.001)。但是,1 nmol/L濃度各時間點所測得的神經突起長度之間的差異無顯著性。除此外,在重鏈作用下,具有突起的細胞占所計數細胞的百分比較對照組明顯增加,以濃度為1 nmol/L、作用24 h最為明顯,其百分比約為對照組的2.5倍(P< 0.001)。(圖2)
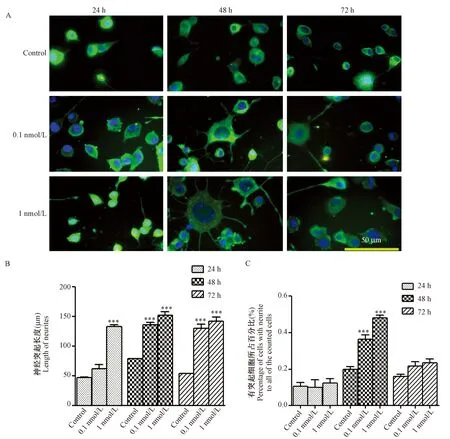
注:與同一時間段對照組相比,***P< 0.001。圖2 不同濃度BoNT/A 重鏈對Neuro-2a 細胞生長的影響及β-tublin免疫熒光染色(Bar=50 μm)Note. Compared with the control group at the same time point,***P< 0.001.Fig.2 The effect of BoNT/A heavy chain on the growth of Neuro-2a cells and the immunofluorescence staining of β-tubulin

注:BoNT/A HC為A型肉毒素重鏈;AcH3為乙酰化的組蛋白3; 與對照組相比,***P< 0.001。圖3 BoNT/A 重鏈對Neuro-2細胞組蛋白H3乙酰化水平的影響(Bar=50 μm)Note. BoNT/A HC: Botulinum neurotoxin serotype A heavy chain. AcH3: Acetylated histone 3. Compared with the control group,***P< 0.001.Fig.3 The effect of BoNT/A heavy chain on the acetylation of H3 in the Neuro-2a cell cultures
SDS-PAGE 和Western blot 結果顯示:給予BoNT/A 重鏈后,在不同時間段(短時程 1~8 h;長時程48~72 h),H3的乙酰化呈現雙時相增多現象(圖3)。第一個H3乙酰化水平增高的時間出現于重鏈作用后的1 h和2 h,此時H3乙酰化水平是對照組的2倍(P< 0.001);第二個H3乙酰化高峰時間點為BoNT/A重鏈作用后48 h,Neuro-2細胞的組蛋白H3乙酰化水平也達到對照組的2倍(P< 0.001)。
從神經突起的增長及H3乙酰化水平的變化趨勢及程度可以推測,BoNT/A重鏈引起的Neuro-2a細胞乙酰化水平增高似乎與細胞突起生長之間有一定的內在聯系。
2.2 在體應用BoNT/A 重鏈促進脊髓損傷局部H3乙酰化
結果顯示:脊髓損傷同時給予BoNT/A重鏈的動物其損傷局部H3乙酰化水平較單純損傷組明顯升高。同細胞培養結果相似,脊髓組織的乙酰化水平也呈現兩個時相的高峰,第一個處于給藥后的2 h,第二個處于給藥后2 d(48 h),其升高水平為對照組的1.5~2倍(P< 0.05)。(圖4)

注:BoNT/A HC為A型肉毒素重鏈;與對照組相比,*P< 0.05,**P< 0.01。圖4 脊髓損傷基礎上給予BoNT/A重鏈后不同時間脊髓組織H3乙酰化變化Note. BoNT/A HC: Botulinum neurotoxin serotype A heavy chain. Compared with the control group,*P< 0.05,**P< 0.01.Fig.4 Alterations in the acetylation of histone 3 after treated with BoNT/A heavy chain based on the spinal cord injury model
3 討論
組蛋白是真核生物染色體的基本結構蛋白,是一類小分子堿性蛋白質,有6種類型:H1、H2A、H2B、H3、H4及古細菌組蛋白,由于其結構中多為堿性氨基酸,因此可以同DNA中帶負電荷的磷酸基團相互作用。H3、H4的乙酰化可打開一個開放的染色質結構,增加基因的表達。更重要的是組蛋白的乙酰化/去乙酰化可形成一種特殊的密碼,被其他蛋白質識別,故可影響多種蛋白因子的功能活動[5]。研究表明[7-8],組蛋白通過乙酰化/去乙酰化相互作用參與神經系統蛋白功能的調節,組蛋白乙酰化的增強可促進某些胞內蛋白質的合成。還有研究者認為,細胞內組蛋白乙酰化,尤其是H3的乙酰化過程增強有助于神經再生[9]。
神經突起生長或損傷后的軸突再生是以胞漿內生長相關蛋白合成增加為基礎的。本實驗的結果表明:BoNT/A促神經軸突增長的同時,神經細胞及其組織內組蛋白3乙酰化水平同時增高,因此可以推測,組蛋白的乙酰化增強可能是BoNT/A重鏈促進神經突起再生的核內機制之一,通過組蛋白3的乙酰化增強機制或間接干預胞漿內多種蛋白質的合成,從而促使神經突起延長再生。然而,由于組蛋白本身在核酸序列的分布及種類不同,發生乙酰化后所涉及的表觀遺傳改變復雜多樣,H3乙酰化與去乙酰化密切相關,因此,BoNT/A 重鏈干預組蛋白乙酰化的途徑還需通過探討其他組蛋白的亞類(H4, H9等)進一步證實。不同組蛋白乙酰化與神經突起再生之間的確切內在聯系還需進一步澄清。
根據本實驗的結果,可以推論:BoNT/A 重鏈可促進組蛋白3的乙酰化;在同一時間點,組蛋白3的乙酰化水平與神經突起增長的長度相一致;組蛋白3乙酰化可能是BoNT/A重鏈促神經突起生長的相關機制之一。

