兩種氮雜環卡賓Pd(Ⅱ)配合物的合成及表征
謝丹妮,霍 丹, ,司傳領
(1. 天津市制漿造紙重點實驗室,天津科技大學造紙學院,天津 300457;2. 中國科學院可再生能源重點實驗室,廣州 510640;3. 江蘇省生物質綠色燃料與化學品重點實驗室,南京林業大學化工學院,南京210037)
在金屬有機領域中,氮雜環卡賓(NHC)主要用作配體.它們和其他帶有兩對孤電子的配體相似,是一類很好的給電子配體,與金屬鍵有很強的結合能力,在催化反應中不易解離.氮雜環卡賓易于制備,且可以通過調節氮原子上的取代基,生成具有不同空間位阻和電子效應的卡賓,生成配合物的結構也具有多樣性.氮雜環卡賓的后過渡金屬配合物對水、熱和空氣穩定,并且在催化反應中可表現出很高的活性.因此,氮雜環卡賓受到越來越多的關注和研究.
吡啶增強前催化劑的制備、穩定和引發型鈀催化劑[1-2]是指一類卡賓與吡啶同時配位的 Pd(Ⅱ)的配合物,在 2005年由 Organ等首先報道.這類配合物具有優異的催化性能,可以催化多種胺化反應和交叉偶聯反應,且催化劑用量低[3].與其他類型的鈀催化劑相比,這類配合物易于制備,穩定性高[4-16],在氮氣保護下,即使在二甲亞砜中 110,℃加熱 12,h也無法使其分解[17].
經典的氮雜環卡賓由咪唑、咪唑啉、苯并咪唑衍生而來.這類卡賓的共同點在于卡賓中心與兩個氮原子直接相連.本文關注具有其他結構的氮雜環卡賓,比如以吲唑為母體的卡賓.這類化合物中,卡賓中心只與一個氮原子直接相連,其電子與空間效應都與經典氮雜環卡賓不同.相應的配合物可能具有不同的催化性質[18].本文以咪唑和吲唑為原料,分別合成了與后過渡金屬鈀絡合的氮雜環卡賓配合物并對其進行了表征.
1 材料與方法
1.1 試劑與儀器
咪唑,98%,,美國 Sigma公司;溴乙烷、乙醚,化學純,國藥集團化學試劑有限公司;碳酸鉀、二氯甲烷、氫氧化鈉,分析純,國藥集團化學試劑有限公司;甲苯、溴化鈉、無水乙醇、乙腈、吡啶、乙酸乙酯,分析純,江蘇強盛功能化學股份有限公司;甲醇,分析純,上海凌峰化學試劑有限公司;吲唑,99%,,上海源葉生物科技有限公司;碘乙烷,99%,,Adamas 公司;氯化鈀,59.0%,,上海達瑞精細化學品有限公司;氘代氯仿,美國CIL產品北京漢威士波譜公司分裝.
Unity-Inova-400型超導核磁共振儀,美國瓦里安技術中國有限公司.
1.2 合成方法
1.2.1 化合物1的合成[19]
在 50,mL的圓底燒瓶中加入咪唑(0.68,g,10,mmol),再加入 5,mL甲苯,室溫下攪拌至完全溶解.向甲苯溶液中加入 NaOH水溶液(1.6,mL,6.25,mol/L),混合攪拌 30,min.隨后加入溴乙烷(1.64,mL,22,mmol),加熱回流 12,h.反應結束后,待混合物溫度降到室溫,觀察到體系上層為清液,下層為淡黃色油狀物.旋轉蒸發除去易揮發物質.向殘余的固體中加入少量二氯甲烷至固體不再溶解,抽濾除去不溶物.冷凍干燥濾液,得到淡黃色油狀物.對該油狀物進行萃取,向其中加入 2,mL甲醇至全溶.將甲醇溶液緩慢滴入 20,mL乙醚中,不斷攪拌15,min.靜置后將上層清液倒出,下層淡黃色油狀物繼續溶在甲醇中,轉移至20,mL乙醚中攪拌.如此反復進行3次,將最后得到的淡黃色油狀物(化合物1)冷凍干燥至體積不再變化,保存在真空環境(1.088,1,g,產率 53%,).
1.2.2 化合物2的合成[20-21]
在 25,mL的 Schlenk管中先分別加入化合物 1(0.061,5,g,0.3,mmol)、氯化鈀(0.053,2,g、0.3,mmol)、碳酸鉀(0.207,3,g,1.5,mmol)、溴化鈉(0.102,9,g,1,mmol),再加入 6,mL 吡啶,加熱至 80,℃,反應12,h.反應結束后,待混合物溫度降至室溫,觀察到體系上層為清液,下層有少許不溶物.旋轉蒸發除去易揮發物質.向殘余的固體中加入少量二氯甲烷,不斷攪拌至固體不再繼續溶解.靜置后將上層清液倒出,向下層不溶物繼續加入少許二氯甲烷攪拌.如此反復進行3次,將最后得到的二氯甲烷混合溶液旋轉蒸發除去溶劑.向旋干后得到的黃色固體中加入20,mL乙醚,攪拌 15,min,靜置后將上層清液倒出,向下層不溶物中繼續加入少許乙醚攪拌.如此反復進行 3次,將最后得到的乙醚混合液冷凍干燥,得到淡黃色粉末.將該淡黃色粉末溶于少量二氯甲烷中,利用硅膠層析柱對混合物進行純化.最后得到的純化后產物(化合物 2)為淡黃色粉末(0.017,9,g,產率12%,).
1.2.3 化合物3的合成[19]
在 50,mL的圓底燒瓶中加入吲唑(0.590,9,g,5,mmol)、NaOH 水溶液(1.3,mL,6.25,mol/L),再加入10,mL乙腈,在室溫下攪拌 2,h.隨后加入碘乙烷(1.6,mL,20,mmol),加熱至 75,℃,反應 36,h.反應結束后,待混合物溫度降到室溫,觀察到體系上層為黃褐色清液,下層有少許沉淀.旋轉蒸發除去易揮發物質.向殘余的黃褐色黏稠液中加入少量二氯甲烷,不斷攪拌 15,min.靜置后將上層清液倒出,下層不溶物繼續加入少許二氯甲烷攪拌.如此反復進行 3次,將最后得到的二氯甲烷混合溶液冷凍干燥.向干燥后得到的混合物中加入20,mL乙酸乙酯,攪拌15,min,靜置后將上層清液倒出,下層不溶物繼續加入少許乙酸乙酯攪拌.如此反復進行 3次,將最后得到的乙酸乙酯混合液冷凍干燥至體積不再變化,得到黃褐色黏稠物.將該黏稠物溶于少許甲醇中,緩慢滴入 20,mL乙醚,不斷攪拌 15,min.靜置后將上層清液倒出,下層的沉淀繼續在乙醚中攪拌.如此反復進行3次.將最后得到的不溶物冷凍干燥,得到淡黃色粉末,即化合物3(0.223,3,g,產率15%,).
1.2.4 化合物4的合成[20-21]
在 25,mL的 Schlenk管中先分別加入化合物 3(0.090,6,g,0.3,mmol)、氯化鈀(0.053,2,g,0.3,mmol)、碳酸鉀(0.207,3,g,1.5,mmol)、溴化鈉(0.102,9,g),1,mmol),再加入6,mL吡啶,加熱升溫至80,℃,反應12,h.反應結束后,待混合物溫度降至室溫,觀察到體系上層為清液,下層有少許不溶物.旋轉蒸發除去易揮發物質.向旋干的固體中加入少量二氯甲烷,不斷攪拌 15,min.靜置后將上層清液倒出,下層不溶物繼續加入少許二氯甲烷攪拌.如此反復進行 3次,將最后得到的二氯甲烷混合液冷凍干燥.向干燥后得到的淡黃色固體中加入20,mL乙醚,攪拌15,min,靜置后將上層清液倒出,下層不溶物繼續溶在乙醚中,加入少許乙醚攪拌.如此反復進行 3次,將最后得到的不溶物冷凍干燥,得到黃色粉末,即化合物 4(0.142,3,g,產率 89 %,).
1.3 1H NMR和13C NMR測試
將合成的 4種化合物分別溶于氘代氯仿中(約0.5,mL),在室溫下于Unity-Inova-400型核磁共振儀上進行測試.
2 結果與討論
2.1 化合物1的合成及表征
咪唑與溴乙烷發生烷基化反應,反應以甲苯為溶劑,并加入氫氧化鈉水溶液,以脫去咪唑中的活潑氫(圖 1).

圖1 反應式1Fig. 1 Equation 1
反應分離得到的化合物 1為淡黃色油狀物,經1H NMR表征,為溴化1,3-二乙基咪唑鹽,其核磁共振氫譜結果如圖2所示.從圖2可以看出:化學位移為 10.26的峰為多重峰,積分值為 1,歸屬為連在兩個氮原子之間的碳原子上的氫;化學位移為 7.68的峰為雙峰,積分值為 2,歸屬為咪唑環中碳碳雙鍵上的兩個氫;化學位移為4.45的峰為多重峰,積分值為4,歸屬為兩個乙基中的亞甲基氫;化學位移為 1.62的峰為多重峰,積分值為 6,歸屬為兩個乙基中的甲基氫.產物的氫譜數據如下:
1H NMR(400,MHz,CDCl3):δ 10.26(m,1H,CH),7.68(d,J=1.50,Hz,2H,CH=CH),4.45(m,J=7.20,Hz,4H,CH2),1.62(m,J=7.60,Hz,6H,CH3).

圖2 化合物1的1H NMR譜圖Fig. 2 1H NMR spectrum of Compound 1
2.2 化合物2的合成及表征
在 80,℃條件下,化合物 1與氯化鈀、過量的碳酸鉀和溴化鈉在吡啶中反應(圖 3).加入碳酸鉀的目的在于脫掉卡賓前體中兩個氮原子之間的碳原子上的氫,原位生成卡賓與Pd(Ⅱ)配位.加入過量溴化鈉的目的在于保證溴離子與 Pd(Ⅱ)配位,避免生成既有氯離子又有溴離子配位的混合物.吡啶既是反應溶劑,又是配體.
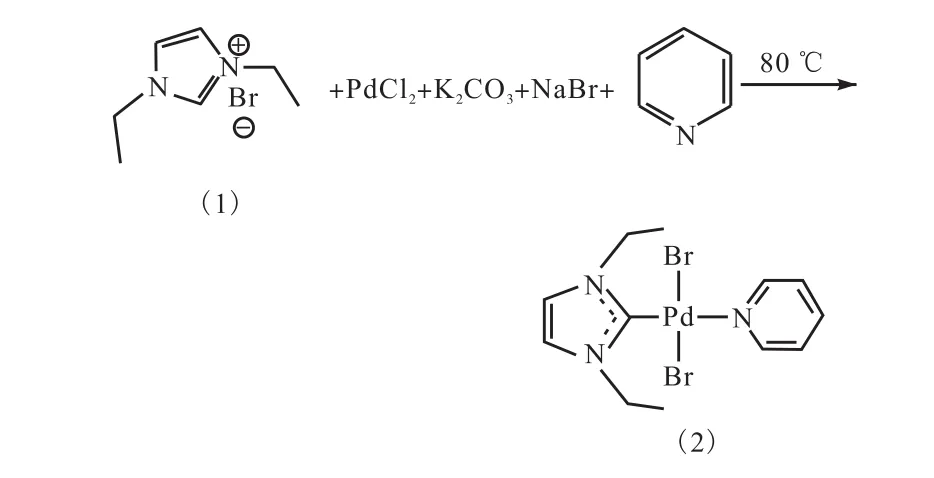
圖3 反應式2Fig. 3 Equation 2
反應結束后分離得到的化合物2為黃色粉末,經1H NMR和13C NMR進行表征,為(1,3-二乙基咪唑基)吡啶基二氯化鈀(Ⅱ),其核磁共振氫譜和碳譜結果如圖4和圖5所示.從圖4可以看出:化學位移為9.05的峰為多重峰,積分值為 2,歸屬為吡啶上氮原子鄰位上的兩個氫;化學位移為7.75的峰為多重峰,積分值為 1,歸屬為吡啶中氮原子對位上氫;化學位移為 7.33的峰為多重峰,積分值為 2,歸屬為吡啶中氮原子間位上的兩個氫;化學位移為 6.96的峰為單峰,積分值為 2,歸屬為咪唑環中碳碳雙鍵上的兩個氫;化學位移為 4.60的峰為四重峰,積分值為 4,歸屬為兩個乙基中的亞甲基氫;化學位移為 1.60的峰為三重峰,積分值為 6,歸屬為兩個乙基中的甲基氫.值得注意的是,化合物 1中 10.26處的峰在化合物2的譜圖中沒有出現,說明兩個氮原子之間的碳原子上的氫被脫去,成功生成了卡賓的 Pd(Ⅱ)配合物.從圖5可以看出:在化學位移121.3~152.8的范圍內出現 4個峰,可歸屬為芳環上的碳原子.咪唑環中兩個氮原子之間的碳原子所對應峰的化學位移應在 160~200,但由于四級碳較難出峰,且13C NMR測試時間不足,因此對應峰并未在譜圖中出現.甲基和次甲基碳原子對應的峰則分別出現在 46.3和15.8.譜圖中1.13處是溶劑峰.產物的氫譜及碳譜數據如下:
1H NMR(400,MHz,CDCl3):δ 9.05(m,J=8.36,Hz,2H,Ar-H),7.75(m,J=18.49,Hz,1H,Ar-H),7.33(m,J=14.03,Hz,2H,Ar-H),6.96(s,2H,CH=CH),4.60(q,J=22.20,Hz,4H,CH2),1.60(t,J=14.68,Hz,6H,CH3).
13C NMR(100,MHz,CDCl3):δ 121.3~152.8(Ar-C),46.3(CH3),15.8(CH2).
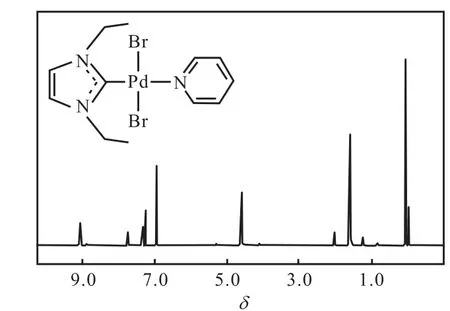
圖4 化合物2的1H NMR譜圖Fig. 4 1H NMR spectrum of Compound 2
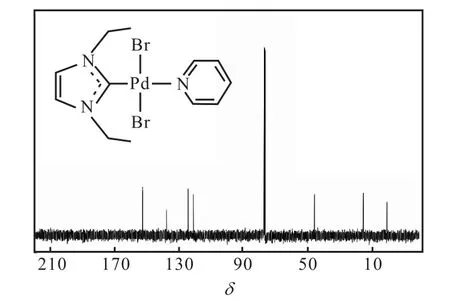
圖5 化合物2的13C NMR譜圖Fig. 5 13C NMR spectrum of Compound 2
2.3 化合物3的合成及表征
在成功合成咪唑鹽及其相應卡賓 Pd(Ⅱ)配合物的基礎上,繼續研究具有不同骨架的卡賓前體的吲唑鹽的合成,并嘗試合成其相應卡賓Pd(Ⅱ)配合物.
吲唑與碘乙烷發生烷基化反應,反應以乙腈為溶劑,在 75,℃條件下進行,并加入過量的氫氧化鈉水溶液,以脫去吲唑中的活潑氫(圖6).

圖6 反應式3Fig. 6 Equation 3
反應完成后分離得到的化合物3為淡黃色粉末,經1H NMR表征,為碘化 1,2-二乙基吲唑鹽,其核磁共振氫譜如圖7所示.從圖7可以看出:化學位移為 9.67的峰為多重峰,積分值為 1,歸屬為五元雜環上與苯環相連碳上的氫;化學位移為8.08~7.50的峰為多重峰,積分值為4,歸屬為苯環上的氫;化學位移為 5.21的峰為多重峰,積分值為 2,歸屬兩個乙基中其中一個的亞甲基氫;化學位移為 4.97的峰為多重峰,積分值為 2,歸屬兩個乙基中另外一個的亞甲基氫;化學位移為 1.80的峰為多重峰,積分值為 3,歸屬兩個乙基中其中一個的甲基氫;化學位移為 1.56的峰為多重峰,積分值為 3,歸屬兩個乙基中另外一個的甲基氫.譜圖中未歸屬的峰為溶劑殘余峰.產物的氫譜數據如下:
1H NMR(400,MHz,CDCl3):δ 9.67(m,1H,CH),8.08(m,J=8.35,Hz,1H,Ar-H),7.83(m,J=16.64,Hz,1H,Ar-H),7.71(m,J=8.40,Hz,1H,Ar-H),7.50(m,J=15.39,Hz,1H,Ar-H),5.21(m,J=21.14,Hz,2H,CH2),4.97(m,J=21.64,Hz,2H,CH2),1.80(m,J=13.88,Hz,3H,CH3),1.56(m,J=14.30,Hz,3H,CH3).

圖7 化合物3的1H NMR譜圖Fig. 7 1H NMR spectrum of Compound 3
2.4 化合物4的合成及表征
參照化合物2的合成方法,進行吲唑衍生的卡賓Pd(Ⅱ)配合物的合成.化合物 3與氯化鈀、過量的碳酸鉀和溴化鈉在吡啶中反應,反應溫度為 80,℃(圖 8).
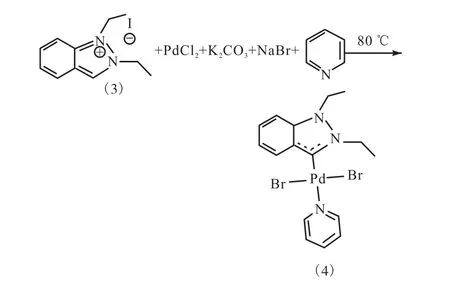
圖8 反應式4Fig. 8 Equation 4
分離得到的化合物 4為黃色粉末,經1H NMR表征,為(1,2-二乙基吲唑基)吡啶基二溴化鈀(Ⅱ),其核磁共振氫譜如圖9所示.由圖9可以看出:與化合物 3的譜圖相比,9.67處的單峰消失,證明五元雜環上與苯環相連碳上的氫被脫掉.化學位移為 8.91的峰為雙峰,積分值為 2,歸屬為吡啶環上氮原子鄰位上的兩個氫;化學位移為8.62的峰為雙峰,積分值為 1,歸屬為吡啶環上氮原子對位上的氫;化學位移為 7.72的峰為多重峰,積分值為 2,歸屬為吡啶環上氮原子間位上的兩個氫;化學位移為7.35~7.26的峰為多重峰,積分值為4,歸屬為苯環上的氫;化學位移為 3.49的峰為多重峰,積分值為 4,歸屬為兩個乙基中亞甲基上的氫;化學位移為1.41的峰為多重峰,積分值為 6,歸屬為兩個乙基中甲基上的氫.產物的氫譜數據如下:
1H NMR(400,MHz,CDCl3):δ 8.91(d,J=5.89,Hz,2H,Ar-H),8.62(d,J=4.17,Hz,1H,Ar-H),7.72(m,J=47.52,Hz,2H,Ar-H),7.35~7.26(m,J=24.73,Hz,4H,Ar-H),3.49(m,J=19.83,Hz,4H,CH2),1.41(m,J=13.73,Hz,6H,CH3).
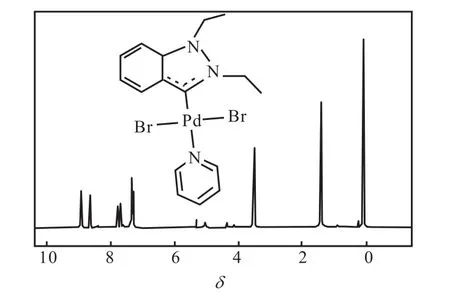
圖9 化合物4的1H NMR譜圖Fig. 9 1H NMR spectrum of Compound 4
2.5 咪唑鹽與吲唑鹽制備過程的比較
咪唑中兩個氮原子之間有一個碳原子,而吲唑中的兩個氮原子處于鄰位.由于氮原子的電負性大于碳原子,因此吲唑中氮原子的電荷密度會小于咪唑中的氮原子電荷密度使親核取代反應難以進行.因此,在制備吲唑鹽時,用極性較大的乙腈作為溶劑,有利于鹽的生成.
另外,由于碘是一個很好的離去基團,碘乙烷是一個比溴乙烷更強的烷基化試劑.因此,在制備咪唑鹽時使用的是溴乙烷,而在制備吲唑鹽時則使用的是碘乙烷.
3 結 語
本文以咪唑和吲唑為原料合成了兩種卡賓前體及相應后過渡金屬 Pd(Ⅱ)配合物.以咪唑鹽作為卡賓前體,在 K2CO3存在的條件下,與 PdCl2在吡啶中反應,分離得到了氮雜環卡賓 Pd(Ⅱ)配合物,其中Pd(Ⅱ)與卡賓和吡啶同時配位.以吲唑鹽作為卡賓的前體,嘗試了吲唑衍生的卡賓 Pd(Ⅱ)配合物的合成.核磁共振結果表明,實驗中利用溴乙烷制備咪唑鹽,碘乙烷和乙腈制備吲唑鹽能夠達到較好的效果,并且成功合成了兩種氮雜環卡賓 Pd(Ⅱ)配合物,即(1,3-二乙基咪唑基)吡啶基二氯化鈀(Ⅱ)和(1,2-二乙基吲唑基)吡啶基二溴化鈀(Ⅱ).
[1] O'Brien C J,Kantchev E A B,Valente C,et al. Easily prepared air-and moisture-stable Pd-NHC(NHC=N-Heterocyclic Carbene)complexes:A reliable,user-friendly,highly active palladium precatalyst for the Suzuki-Miyaura reaction[J]. Chemistry-A European Journal,2006,12(18):4743-4748.
[2] Organ M G,Avola S,Dubovyk I,et al. A user-friendly,all-purpose Pd-NHC(NHC=N-heterocyclic carbene)precatalyst for the negishi reaction:A step towards a universal cross-coupling catalyst[J]. Chemistry-A European Journal,2006,12(18):4749-4755.
[3] Wanzlick H W. Aspects of nucleophilic carbene chemistry[J]. Angewandte Chemie International Edition,1962,1(2):75-80.
[4] Organ M G,Abdel-Hadi M,Avola S,et al. Biaryls made easy:PEPPSI and the Kumada-Tamao-Corriu reaction[J]. Chemistry-A European Journal,2007,13(1):150-157.
[5] Valente C,Baglione S,Candito D,et al. High yielding alkylations of unactivated sp3and sp2centres with alkyl-9-BBN reagents using an NHC-based catalyst:Pd-PEPPSI-IPr[J]. Chemical Communications,2008(6):735-737.
[6] Organ M G,Calimsiz S,Sayah M,et al. Pd-PEPPSIIPent:An active,sterically demanding cross-coupling catalyst and its application in the synthesis of tetra-orthosubstituted biaryls[J]. Angewandte Chemie International Edition,2009,48(13):2383-2387.
[7] Achonduh G T,Hadei N,Valente C,et al. On the role of additives in alkyl-alkyl Negishi cross-couplings[J].Chemical Communications,2010,46(23):4109-4111.
[8] Calimsiz S,Sayah M,Mallik D,et al. Pd-PEPPSI-IPent:Low-temperature negishi cross-coupling for the preparation of highly functionalized,tetra-ortho-substituted biaryls[J]. Angewandte Chemie International Edition,2010,49(11):2014-2017.
[9] Dowlut M,Mallik D,Organ M G. An efficient lowtemperature Stille-Migita cross-coupling reaction for heteroaromatic compounds by Pd-PEPPSI-IPent[J]. Chemistry-A European Journal,2010,16(14):4279-4283.
[10] Nasielski J,Hadei N,Achonduh G,et al. Structureactivity relationship analysis of Pd-PEPPSI complexes in cross-couplings:A close inspection of the catalytic cycle and the precatalyst activation model[J]. Chemistry-A European Journal,2010,16(35):10844-10853.
[11] Valente C,Belowich M E,Hadei N,et al. Pd-PEPPSI complexes and the Negishi reaction[J]. European Journal of Organic Chemistry,2010(23):4343-4354.
[12] Calimsiz S,Organ M G. Negishi cross-coupling of secondary alkylzinc halides with aryl/heteroaryl halides using Pd-PEPPSI-IPent[J]. Chemical Communications,2011,47(18):5181-5183.
[13] Hadei N,Achonduh G T,Valente C,et al. Differentiating C=Br and C=Cl bond activation by using solvent polarity:Applications to orthogonal alkyl-alkyl Negishi reactions[J]. Angewandte Chemie International Edition,2011,50(17):3896-3899.
[14] Hoi K H,?alimsiz S,Froese R D J,et al. Amination with Pd-NHC complexes:Rate and computational studies on the effects of the oxidative addition partner[J]. Chemistry-A European Journal,2011,17(11):3086-3090.
[15] Hunter H N,Hadei N,Blagojevic V,et al. Identification of a higher-order organozincate intermediate involved in negishi cross-coupling reactions by mass spectrometry and NMR spectroscopy[J]. Chemistry-A European Journal,2011,17(28):7845-7851.
[16] Valente C,?alimsiz S,Hoi K H,et al. The development of bulky palladium NHC complexes for the mostchallenging cross-coupling reactions[J]. Angewandte Chemie International Edition,2012,51(14):3314-3332.
[17] 李玉. 苯并咪唑類卡賓鈀化合物的合成及其在N-芳基化反應中的應用[D]. 鄭州:鄭州大學,2010.
[18] Arduengo III A J,Goerlich J R,Krafczyk R,et al. 1,3,4,5-Tetraphenylimidazol-2-ylidene:The realization of Wanzlick's dream[J]. Angewandte Chemie International Edition,1998,37(13/14):1963-1965.
[19] Meiries S,Le Duc G,Chartoire A,et al. Large yet flexible N-heterocyclic carbene ligands for palladium catalysis[J]. Chemistry-A European Journal,2013,19(51):17358-17368.
[20] Kumar A,Katari M,Ghosh P. Understanding the lability of atransbound pyridine ligand in a saturated sixmembered N-heterocyclic carbene based(NHC) PdCl2(pyridine)type complex:A case study[J]. Polyhedron,2013,52:524-529.
[21] Zhong R,P?thig A,Feng Y,et al. Facile-prepared sulfonated water-soluble PEPPSI-Pd-NHC catalysts for aerobic aqueous Suzuki-Miyaura cross-coupling reactions[J]. Green Chemistry,2014,16(12):4955-4962.

