四逆酸棗仁湯合方對失眠大鼠海馬GABAARα1、γ2及NKCC1的影響
林炳岐,馬捷,劉燕,于雪,范盎然,張煒悅,戴寧,張蔚,劉夢,溫佳雨,李峰(北京中醫藥大學 中醫學院-中醫診斷系,北京 100029)
失眠癥是臨床常見疾病,失眠癥是以頻繁且持續的入睡困難或睡眠維持困難,并導致睡眠滿意度不足為特征的睡眠障礙[1]。由于現代社會的特點,人們的工作壓力增大,生活節奏加快,導致睡眠不規律,失眠的人數呈不斷的上升趨勢,尤其腦力勞動者最為嚴重。有學者研究發現,導致失眠的病因很多,但是由于現代社會人們心理負擔的加重,情志因素已經成為失眠的主要原因[2]。同時,在臨床的實踐和文獻分析中,很多學者發現失眠的病位在心,但是和肝臟的影響密切相關[3]。人的正常睡眠和海馬中的γ-氨基丁酸(gamma-aminobutyric acid,GABA)能神經系統密切相關,它是存在于中樞神經系統中的抑制性神經遞質,能夠抑制神經系統,具有保護神經的作用,能夠起到催眠、鎮靜和抗焦慮等功能[4]。GABA所起到的神經保護作用是通過結合其A受體來完成的,A受體中以GABAARα1和GABAARγ2型受體最多,也是GABAA受體重要的功能基團。這些受體都含有配體門控氯離子通道蛋白,在Na+-K+-Cl-協同轉運蛋白1(NKCC1)的作用下,使Cl-快速內流,聚集于神經元內,當GABAA受體被激活時產生神經元的抑制保護作用。四逆散和酸棗仁湯是從肝論治失眠的經典方劑,具有疏肝解郁、養血安神的作用。本實驗觀察四逆酸棗仁湯合方對失眠大鼠GABA能傳導系統中GABAARα1、GABAARγ2和NKCC1的影響,探討四逆酸棗仁湯合方在GABA能傳導系統中的作用。
1 實驗材料
1.1 實驗動物
本研究選用清潔級SD健康雄性大鼠90只,體質量180~200 g。動物購自北京斯貝福生物技術有限公司,許可證編號為SCXX(京)2016-0002。大鼠飼養于清潔級動物房,40 W日光燈照射,光照節律為12 h(06:00—18:00);室內溫度為(23±1)℃,相對濕度為30%~40%;正常大鼠飼料喂養,自由飲水。
1.2 藥物
四逆散:柴胡6 g,白芍6 g,枳實6 g,炙甘草6 g;酸棗仁湯:酸棗仁15 g,川芎9 g,知母9 g,茯苓9 g,炙甘草3 g;四逆酸棗仁湯合方:酸棗仁15 g,川芎9 g,知母9 g,茯苓9 g,炙甘草9 g,柴胡6 g,白芍6 g,枳實6 g。以上生藥均由北京同仁堂醫藥有限責任公司提供,并由北京創立有限責任公司加工成浸膏備用,出膏率分別為:18.3%、17.6%、18.1%,4℃保存。艾司唑侖:1盒,常溫保存,備用,購自中日友好醫院。
1.3 主要試劑和儀器
對氯苯丙氨酸(PCPA)(Sigma,美國);戊巴比妥鈉(Sigma,美國);BCA蛋白濃度測定試劑盒(索萊寶生物科技有限公司);兔抗GAPDH(Protein tech,美國),兔抗GABAARα1(Protein tech,美國),兔抗GABAARγ2(Protein tech,美國),NKCC1(Protein tech,美國),兔二抗(中山金橋);Reveraid First Strand cDNA Synthesis Kit(Thermo,美國),PCR Master Mix(Thermo,美國),PCR引物合成(上海生工公司);酶標儀Multiskan GO(Thermo,美國);電泳槽(Bio-RAD,美國),電轉槽(Bio-RAD,美國);Alpha Innotech凝膠成像儀(FLUORCHEM,美國);CFX96 PCR檢測儀(Bio-RAD,美國),PCR擴增儀(Bio-RAD,美國),Gene Amp PCR System 9700(Applied Biosystems,美國)。
2 實驗方法
2.1 失眠模型復制
大鼠適應性喂養7天,自由進食、進水,保持墊料干燥,7 d后稱體質量編號,隨機分為正常組(15只)和造模組(75只),造模組腹腔注射PCPA混懸液[5-6]。PCPA用量按400 mg/10 mL/kg,用弱堿性生理鹽水配置成混懸液備用,正常組腹腔注射等體積的弱堿性生理鹽水,于每日8:00—8:30進行,兩組連續注射2 d。第1次腹腔注射36 h后,造模組大鼠出現晝夜節律缺失,白天與夜晚活動不斷,易激惹,整體觀察和正常組不同,提示造模成功。將復制成功的模型大鼠隨機分為模型組、西藥組、四逆散組、酸棗仁湯組、合方組,并設置空白對照正常組。
2.2 實驗動物分組和給藥
正常組:連續7 d生理鹽水灌胃;失眠模型復制成功的大鼠75只,按隨機數字表法分成以下5組,每組15只。模型組:連續7 d生理鹽水灌胃;西藥組:連續7 d艾司唑侖灌胃;四逆散組:連續7 d四逆散浸膏灌胃;酸棗仁湯組:連續7 d酸棗仁湯浸膏灌胃;四逆酸棗仁湯合方組(以下簡稱:合方組):連續7 d四逆酸棗仁湯合方浸膏灌胃。各用藥組根據中藥浸膏的出膏率和大鼠給藥體表面積公式計算出各組大鼠給藥量。
2.3 觀察指標
2.3.1 一般狀態
觀察大鼠的活動狀態、精神狀態、皮毛顏色、進食量、飲水量和對外界刺激的反應等。
2.3.2 體質量變化
記錄各組大鼠的每天體質量,觀察各組大鼠每天體質量的變化。
2.4 檢測指標
2.4.1 取材
給藥結束后第2天,大鼠戊巴比妥鈉腹腔注射麻醉,腹主動脈取血、斷頭,冰上快速剝離大鼠海馬,置于液氮中快速冷凍,再轉移到-80℃冰箱冷凍保存待測,每組隨機選取5只海馬進行RCR檢測,隨機選取6只海馬進行Western Blot檢測。
2.4.2 實時熒光定量PCR
用Trizol破碎各組大鼠海馬腦組織,離心取上清,依次加入氯仿、異丙醇等提取總RNA;根據總RNA濃度和反轉錄試劑盒逆轉錄成cDNA,反應條件為:退火25 ℃,5 min,延伸42 ℃,60 min,失活79 ℃,5 min;GABAARα1mRNA上游引物:5′-AGCTATACCCCTAACTTAGCCAGG-3′,下游引物:5′-AGAAAGCGATTCTCAGTGCAGAGG-3′;GABAARγ2mRNA上游引物:5′-CTTCTTCGGATGTTTTCCTTCAGG-3′,下游引物:5′-CATAGGGTATTAGATCGTTGGACT-3′;NKCC1mRNA:上游引物:5′-TTACTACCTGCGCACCTTCG-3′,下游引物:5′-TCCAGCTCATCGTGGAACTC-3′;β-actin上游引物:5′-CCCATCTATGAGGGTTACGC-3′,下游引物:5′-TTTAATGTCACGCACGATTTC-3′。PCR擴增反應條件:95 ℃ 30 s;95 ℃ 10 s~60 ℃ 30 s擴增40個循環。反應結束后,讀取PCR軟件內循環閾值(CT值),采用ΔΔCT法處理結果,以β-actin 為內參,計算GABAARα1、GABAARγ2和NKCC1的相對表達量,以2-ΔΔCT表示。
2.4.3 Western Blot
用ripa裂解液提取大鼠海馬腦組織蛋白,采用BCA試劑盒測定總蛋白濃度,根據總蛋白濃度配平,使各樣本蛋白等量,取40 μg蛋白樣品,電泳分離,再電轉到PVDF膜上,0.5%的脫脂奶粉封閉1h后,分別加入一抗GABAARα(1∶2 000)、GABAARγ2(1∶2 000)、NKCC1(1∶2 000),GAPDH(1∶50 000),4 ℃孵育過夜,經TBST洗膜后加入二抗,室溫孵育1 h,經TBST洗膜后加入ECL試劑盒A、B混合液(1∶1),然后曝光、顯影、定影,掃描膠片,用軟件處理系統分析目標條帶的光密度值。
2.5 統計學處理

3 實驗結果
3.1 一般狀態觀察
正常組的大鼠精神狀態良好,活動靈敏,毛發有光澤,體質量明顯增加。模型組的大鼠精神亢奮,易激惹,毛發干枯、無光澤,飲水量明顯增加,消瘦。西藥組和各中藥組的大鼠精神狀態、活動情況與模型組相比有所改觀。
3.2 體質量變化
實驗結束后,各組大鼠體質量增量有非常顯著性差異(P<0.01),和正常組相比,模型組體質量增量非常顯著性降低(P<0.01);和模型組相比,西藥組、酸棗仁湯組、合方組非常顯著性升高(P<0.01);和西藥組相比,酸棗仁湯組、合方組無統計學差異(P>0.05)。結果表明酸棗仁湯組、合方組均可增加大鼠的體質量,見表1。

表1 大鼠體質量增量變化
注:與正常組相比,##P<0.01;與模型組相比,**P<0.01
3.3 失眠大鼠海馬腦組織中GABAARα1mRNA、GABAARγ2 mRNA和NKCC1 mRNA的表達
實時熒光定量PCR結果顯示:各組大鼠GABAARα1mRNA的表達有顯著性差異(P<0.05),和正常組相比,模型組表達顯著性下降(P<0.05);和模型組相比,西藥組、酸棗仁湯組表達顯著性上升(P<0.05),合方組GABAARα1mRNA表達非常顯著性上升(P<0.01);和西藥組相比,酸棗仁湯組、合方組無顯著性差異(P>0.05)。各組大鼠GABAARγ2mRNA的表達沒有顯著性差異(P>0.05),但模型組表達顯示出明顯降低趨勢,且各用藥組都有提高其表達的趨勢。各組大鼠NKCC1mRNA的表達沒有顯著性差異(P>0.05),但模型組表達顯示出明顯升高趨勢,且各用藥組都有降低其表達的趨勢,見表2。
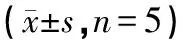
表2 大鼠海馬GABAARα1mRNA、GABAARγ2mRNA、NKCC1mRNA表達變化
注:與正常組相比,#P<0.05;與模型組相比,*P<0.05,**P<0.01
3.4 失眠大鼠海馬腦組織中GABAARα1、GABAARγ2和NKCC1蛋白的表達
Western Blot結果顯示:各組大鼠GABAARα1有非常顯著性差異(P<0.01),和正常組相比,模型組表達非常顯著性下降(P<0.01);和模型組相比,西藥組顯著性升高(P<0.05),酸棗仁湯組、合方組非常顯著性升高(P<0.01);和西藥組相比,四逆散組、酸棗仁湯組、合方組無顯著性差異(P>0.05)。各組大鼠GABAARγ2有非常顯著性差異(P<0.01),和正常組相比,模型組表達非常顯著性下降(P<0.01);和模型組相比,西藥組、四逆散組顯著性升高(P<0.05),合方組非常顯著性升高(P<0.01);和西藥組相比,四逆散組、酸棗仁湯組、合方組無顯著性差異(P>0.05)。各組大鼠NKCC1有非常顯著性差異(P<0.01),和正常組相比,模型組表達非常顯著性上升(P<0.01);和模型組相比,西藥組、四逆散組、酸棗仁湯組、合方組非常顯著性下降(P<0.01);和西藥組相比,四逆散組、合方組無顯著性差異(P>0.05),見表3,電泳圖見圖1。
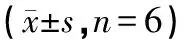
表3 大鼠海馬GABAARα1、GABAARγ2、NKCC1蛋白的表達變化
注:與正常組相比,#P<0.05,##P<0.01;與模型組相比,*P<0.05,**P<0.01
4 討論
失眠是臨床上一種常見的疾病,由于現在的時代特點和人們不規律的生活方式,失眠的人數也越來越多。有關失眠的發生機制,有兩種比較公認的假說,一種是神經生物學層面的“過度覺醒假說”[7],另一種是認知行為學方面的“3P假說”[8-9]。而這兩種機制的發生和海馬腦組織中的GABA能神經系統有一定的關系,GABA是腦中重要的抑制性神經遞質,一直被認為和睡眠密切相關,它通過和GABAA受體結合而發揮抑制性神經保護作用。GABAA受體是由2個α、2個β和1個γ組成的五聚體大分子[10],在這些受體中, GABAARα1和GABAARγ2是數量最多的受體,也是反應睡眠的最重要的功能基團,這些受體上的門控氯離子通道蛋白開放導致Cl-內流或者外流,從而發生抑制或者興奮作用。在成熟的神經細胞中,胞膜內Cl-的濃度受到NKCC1的影響,若NKCC1表達量升高時,胞內出現高Cl-狀態,當GABAA受體被激活,Cl-通道開放,Cl-外流,胞膜去極化,產生神經興奮性作用;若NKCC1表達量下降時,胞內出現低Cl-狀態,當GABAA受體被激活,Cl-通道開放,Cl-以內流,胞膜超極化,產生神經抑制性作用[11]。有研究發現[12],失眠通過不同強度的電針刺激能夠上調GABAARα1的表達而起到治療作用。也有研究發現酸棗仁-五味子藥對醇水雙提物能夠提高GABAARα1和GABAARγ2的表達而達到失眠的治療效果[13]。因此,本實驗選取GABAARα1、GABAARγ2和NKCC1作為反應失眠機制的觀察指標。

圖1 各組大鼠海馬GABAARα1、GABAARγ2、NKCC1蛋白的表達注:A.正常組;B.模型組;C.西藥組;D.四逆散組;E.酸棗仁湯組;F.合方組
失眠中醫又稱為“不寐”“不得眠”“臥不安”等,中醫認為失眠的病位在心,但是睡眠的發生也依賴于肝的正常生理功能,肝主疏泄和藏血功能正常,則人臥魂歸于肝,神志安靜,睡眠安穩;若由于各種情志因素導致肝的疏泄和藏血功能異常,就會出現失眠,正如《普濟本事方·獨活湯》云:“平人肝不受邪,故臥則魂歸于肝,神靜而得寐。今肝有邪,魂不得歸,是以臥則魂揚若離體也。”治療上我們選用四逆散和酸棗仁湯合方,二方出自《金匱要略》,是疏肝氣、養肝血的經典方劑,二方合用可以恢復肝的正常生理功能,使睡眠正常。
本次實驗中通過觀察各組大鼠的一般狀態,發現正常組的大鼠精神狀態良好,活動靈敏,毛發有光澤,體質量明顯增加。模型組的大鼠精神亢奮,易激惹,毛發干枯、無光澤,飲水量明顯增加,消瘦。西藥組和各中藥組的大鼠精神狀態和活動情況和模型組相比有所改善,體質量增量也有所增加。
Western Blot的實驗結果顯示:失眠大鼠和正常大鼠相比,海馬中GABAARα1和GABAARγ2的表達明顯降低,經過西藥和各中藥治療,西藥、合方能夠有效升高失眠大鼠海馬中GABAARα1和GABAARγ2的表達量,而四逆散能有效升高大鼠海馬中GABAARγ2表達量,酸棗仁湯能夠有效升高大鼠海馬中GABAARα1的表達量。NKCC1的結果顯示:失眠大鼠和正常大鼠相比,海馬中NKCC1的表達明顯升高,經過西藥和各中藥治療,都能夠有效降低大鼠海馬中NKCC1的表達量,并且四逆散、合方和西藥治療效果無差異。實時熒光定量PCR的實驗結果中顯示:失眠大鼠和正常大鼠相比,GABAARα1mRNA表達明顯下降,西藥、酸棗仁湯、合方能夠有效提高GABAARα1mRNA的表達,酸棗仁湯、合方和西藥效果無差異;各組大鼠海馬中的GABAARγ2mRNA和NKCC1mRNA表達雖然沒有統計學差異,但是模型組GABAARγ2mRNA的表達有明顯下降趨勢,NKCC1mRNA表達有明顯上升趨勢,且各用藥組都有升高GABAARγ2mRNA、降低NKCC1mRNA表達的趨勢。兩種實驗說明,失眠大鼠海馬中GABAARα1和GABAARγ2的蛋白和mRNA表達都降低,而NKCC1的蛋白和mRNA升高,經過藥物治療,西藥和各組中藥能夠有效地升高GABAARα1和GABAARγ2蛋白和mRNA的表達,同時降低NKCC1蛋白和mRNA的表達,從而起到治療作用,并且合方組治療效果更全面。
綜上所述,本實驗觀察到,四逆酸棗仁湯合方能夠有效地改善失眠大鼠的睡眠節律,并且可能是通過上調大鼠海馬中GABAARα1和GABAARγ2,降低NKCC1而發揮治療作用。
[1] 中華醫學會神經病學分會睡眠障礙學組.中國成人失眠診斷與治療指南[J].中華神經科雜志,2012,45(7):534-540.
[2] 賈玉,賈躍進,鄭曉琳.中醫對失眠認識的探討及展望[J].中華中醫藥雜志,2015,30(1):163-166.
[3] 馬捷,李峰,宋月晗,等. 從肝論治失眠的文獻研究[J]. 中華中醫藥雜志,2012,27(4):1076-1080.
[4] 蔣潔,趙百孝,哈略,等.不同波形電針對 PCPA 致失眠大鼠下丘腦5-HT和Glu、GABA含量的影響[J].上海針灸雜志,2015,34(7):678-681.
[5] Adrien J, Laguzzi R, Bourgoin S, et al, Sleep in the rate raphe lesion: pharmacologic of the systeme serotoninergique [J] . Waking and Sleeping,1980(4):80-85.
[6] 肖成榮,馬增春,李海靜,等. PCPA失眠大鼠模型的制作及其機制[J].毒理學雜志,2007,21(4):326.
[7] Riemann D, Spiegelhalder K, Feige B, et al. The hyperarousal model of insomnia: a review of the concept and its evidence[J]. Sleep Med Rev, 2010,14:19-31.
[8] Levenson JC, Kay DB, Buysse DJ. The pathophysiology of insomnia[J].Chest,2015(147):1179-1792.
[9] Laura Palagini, Knut Biber, Dieter Riemann.The genetics of insomniae Evidence for epigenetic mechanisms?[J]. Sleep Medicine Reviews,2014,18:225-235.
[10] 劉祖麗,唐成林,余敏,等.不同強度電針對PCPA失眠大鼠下丘腦γ-氨基丁酸及受體的影響[J].生命科學研究,2011,15(3):236-240.
[11] Kristopher T. The role and the mechanism of γ-aminobutyric acid during central nervous system development[J]. Neurosci Bull, 2008,24(3):195-200.
[12] 趙小明,張健.不同強度電針治療對氯苯丙氨酸失眠大鼠模型的相關機制[J].醫療衛生裝備,2016,37(5):13-16.
[13] 高家榮,季文博,姜輝,等.酸棗仁-五味子藥對醇水雙提物對PCPA致失眠大鼠氨基酸類神經遞質的影響[J].中藥材,2013,36(10):1635-1639.

