植物-土壤反饋?zhàn)饔脤?duì)2種引進(jìn)樹種的菌根侵染率和生物量的影響
陳璐璐,雷妮婭
(北京林業(yè)大學(xué) 林學(xué)院,北京100083)
現(xiàn)代植物生態(tài)學(xué)視植物與其生存的環(huán)境為一個(gè)彼此依賴且相互影響的整體,其中,植物-土壤反饋關(guān)系最具代表性。植物體扎根土壤并從中獲取水肥資源用于生長,直接影響到土壤微生物群系種類組成及其動(dòng)態(tài)變化,此類變化反過來又作用于植物根系,通過影響根系吸收從而作用于植物體的生長發(fā)育,形成一個(gè)相互影響的反饋?zhàn)饔铆h(huán)[1]。目前,植物-土壤反饋研究主要集中在植物對(duì)不同來源土壤微生物的反饋響應(yīng),供試樹種、試驗(yàn)方法及測(cè)定指標(biāo)均是影響植物-土壤反饋?zhàn)饔媒Y(jié)果的重要因素[2-3]。KULMATISKI等[3]對(duì)2008年以前的329個(gè)反饋試驗(yàn)進(jìn)行總結(jié)和分析,發(fā)現(xiàn)反饋?zhàn)饔枚嘁怨┰嚪N生物量、株高及種子存活率等進(jìn)行衡量,其中近70%的反饋試驗(yàn)表明土壤微生物對(duì)植物為負(fù)反饋?zhàn)饔茫瑑H28%為正反饋?zhàn)饔茫倭吭囼?yàn)為中立反饋即無影響,且試驗(yàn)樹種是影響反饋結(jié)果的一個(gè)重要因素。土壤微生物接種方法是影響植物-土壤反饋結(jié)果的另一個(gè)重要因素。近年來,科學(xué)家們發(fā)現(xiàn)不同徑級(jí)的土壤微生物在反饋體系中的作用差別顯著[4-5]。關(guān)于不同徑級(jí)土壤微生物群對(duì)植物菌根真菌的影響情況則少見報(bào)道。叢枝菌根真菌(arbuscular mycorrhizal fungi,AM)是土壤中對(duì)植物生長有重要有益作用的微生物群,促進(jìn)植物根系對(duì)水分、營養(yǎng)元素等的吸收[6],在植物生長、定植乃至群落演替中扮演重要角色[7-8]。目前,反饋試驗(yàn)中關(guān)于叢枝菌根真菌的報(bào)道不少,肯定了叢枝菌根真菌在植物-土壤反饋?zhàn)饔弥芯哂兄匾饔茫?-11]。研究表明:叢枝菌根真菌促進(jìn)植物生物量積累,而該種有益作用在不同的反饋體系中未得到表現(xiàn)[9,12],它們?cè)谥参?土壤相互作用關(guān)系中的響應(yīng)情況仍需進(jìn)一步研究。近百年來,中國大量引進(jìn)復(fù)葉槭Acer negundo和美國白蠟Fraxinus americana作為庭院及 “四旁”綠化樹種,2個(gè)樹種在中國生長良好,并在華北地區(qū)廣泛分布。復(fù)葉槭擴(kuò)散能力強(qiáng),作為園林樹種引進(jìn)歐洲后被不少地區(qū)視為入侵樹種,人們認(rèn)為復(fù)葉槭入侵成功源于逃離了本土專性有害土壤微生物的抑制作用,也即天敵釋放假說[13-14]。目前,對(duì)美國白蠟在不同土壤反饋體系下的響應(yīng)研究不多,關(guān)于它是否發(fā)展為入侵物種及其引入機(jī)制尚未見報(bào)道。本研究以復(fù)葉槭和美國白蠟2個(gè)引進(jìn)樹種為對(duì)象,研究?jī)烧邔?duì)不同徑級(jí)及不同來源土壤微生物的反饋響應(yīng),采用少量接種土壤與基質(zhì)土壤混合的盆栽育苗方法,針對(duì)供試種構(gòu)建不同的植物-土壤反饋體系。通過比較幼苗在不同植物-土壤反饋體系中感染叢枝菌根真菌和積累生物量的情況,來判定其植物-土壤反饋?zhàn)饔玫姆较蚺c強(qiáng)度,從而初步確定2個(gè)引進(jìn)樹種在中國的擴(kuò)散機(jī)制。
1 材料與方法
1.1 試驗(yàn)材料
供試樹種為美國白蠟和復(fù)葉槭,2013年底分別從美國Louisiana Forest Seed Company和匈牙利Juhasz&Co.Ltd購進(jìn)當(dāng)?shù)卦a(chǎn)的成熟種子。于2014年4月以營養(yǎng)草炭土為基質(zhì)育苗,7月選取相同規(guī)格的幼苗移植到口徑為14 cm,高16 cm的塑料花盆,進(jìn)行盆栽試驗(yàn)。育苗和移植過程中所用器具、材料(含種子及幼苗根系)均經(jīng)過體積分?jǐn)?shù)為75%的乙醇擦拭或浸泡進(jìn)行表面消毒處理,并以純凈水沖洗后使用。育苗期及幼苗移植后緩苗期采用人工噴灑純凈水進(jìn)行水分管理。制備接種劑所用到野外土壤,分別從中國林木種子公司大興苗圃內(nèi)自留的美國白蠟片林和復(fù)葉槭片林林下采集。采集的土壤過2 mm篩分成4份備用。
1.2 盆栽試驗(yàn)設(shè)計(jì)
1.2.1 不同徑級(jí)微生物類群下植物-土壤反饋試驗(yàn) 將從野外采集的美國白蠟和復(fù)葉槭片林下土壤過2.00 mm篩(保留大型土壤動(dòng)物及大型真菌等)作為原狀土壤處理(field soil,F(xiàn)S2.00,<2.00 mm),過2.00 mm篩并用無菌水浸泡24 h后經(jīng)快速定量濾紙(0.12 mm)濾出上層澄清液制備土壤浸提液(去除大型動(dòng)物及大型真菌等),作為土壤浸提液處理(soil wash,SW0.12,<0.12 mm),滅菌土壤為對(duì)照(ck),滅菌方法參考文獻(xiàn)[15]。其中浸提液處理添加與其他處理等量的滅菌土壤以保持各處理之間土壤養(yǎng)分等的均一性。接種土壤與基質(zhì)按V(土壤)∶V(基質(zhì))=1∶2,充分混合均勻。分別在各處理土壤中移栽前期培育良好的美國白蠟和復(fù)葉槭幼苗,10株·處理-1,共60株。
1.2.2 不同來源土壤微生物類群下植物-土壤反饋試驗(yàn) 將從野外采集的美國白蠟和復(fù)葉槭片林下土壤分別過2.00 mm篩,與無菌草炭土按V(林下土)∶V(草炭土)=1∶2充分混勻,互相作為同種樹下土壤(home soil,HS)及異種樹下土壤處理(away soil,AS),即美國白蠟的異種樹下土壤處理以復(fù)葉槭片林下取得的土壤接種獲得,復(fù)葉槭異種樹下土壤處理同理。10株·處理-1,共計(jì)40株。試驗(yàn)采用完全隨機(jī)區(qū)組設(shè)計(jì),花盆擺放在透光帳篷內(nèi)的高腳木架上,每周按電腦臨時(shí)生成的隨機(jī)表進(jìn)行一次重新排位。木架腳用塑料薄膜包覆,包覆高度為15 cm,以防止蚯蚓Pheretima等土壤動(dòng)物爬上高架進(jìn)入花盆。緩苗期內(nèi)浸提液處理噴灑土壤浸提液,其他處理噴灑純凈水;緩苗期過后統(tǒng)一進(jìn)行常規(guī)管護(hù)。經(jīng)過2個(gè)生長季后,于2015年9月底將試驗(yàn)苗木帶回實(shí)驗(yàn)室收集相關(guān)數(shù)據(jù)。
1.3 苗木收獲與數(shù)據(jù)采集
1.3.1 生物量測(cè)定 逐株收獲苗木,輕輕抖落根系土壤,將基質(zhì)從根系上剝離,必要時(shí)借助水沖。將收獲的苗木用自來水沖洗干凈后用紙巾吸干表面水分,分葉、莖干、粗根(直徑>2 mm)、細(xì)根(直徑<2 mm)等4個(gè)部分分別稱取并記錄鮮質(zhì)量,然后各取一定質(zhì)量的樣品于60℃烘箱中烘干至恒量,進(jìn)行各部分含水率測(cè)定,并將鮮質(zhì)量換算為生物量(干質(zhì)量)。
1.3.2 菌根結(jié)構(gòu)特征觀察 在對(duì)細(xì)根進(jìn)行取樣烘干處理之前留取少量乳白色根端,切成約1 cm的根段,清洗干凈后用甲醛-乙醇-醋酸混合固定液[FAA, V(體積分?jǐn)?shù)為 50%乙醇)∶V(甲醛水)∶V(冰醋酸)=90∶5∶5]固定保存,并加入5 mL甘油長期固定[16],用于叢枝菌根菌侵染率測(cè)定樣。叢枝菌根菌侵染率測(cè)定參考PHILLIPS等[17]的方法。從固定液中取出根段樣本并放入質(zhì)量濃度為10%氫氧化鉀溶液中,90℃水浴加熱1.5 h至根系透明;洗去堿液后用體積分?jǐn)?shù)為10%的過氧化氫漂白15 min;清洗干凈并用0.2 mol·L-1的鹽酸酸化1 h;酸化根段用臺(tái)盼藍(lán)染色15 min后用乳酸酚脫色30 min;最后將脫色處理過的根段清洗干凈后壓片進(jìn)行顯微鏡鏡檢。隨機(jī)取幼苗根段10條·株-1,共100條·處理-1進(jìn)行鏡檢。鏡檢采用十字交叉法計(jì)數(shù)[18],對(duì)視野內(nèi)被十字絲所搭上的菌絲、泡囊和叢枝結(jié)構(gòu)分別進(jìn)行計(jì)數(shù)并記錄在同一個(gè)交叉點(diǎn)下,通過等距移動(dòng)玻片使每組根段形成不少于150個(gè)觀察視野,用佳能PC1591對(duì)2個(gè)樹種幼苗的叢枝菌根結(jié)構(gòu)特征進(jìn)行拍攝記錄[19]。泡囊侵染率=(泡囊侵染的交叉點(diǎn)數(shù)和/總交叉數(shù))×100%,叢枝侵染率=(叢枝侵染的交叉點(diǎn)數(shù)和/總交叉數(shù))×100%。菌絲侵染率=(菌絲侵染的交叉點(diǎn)數(shù)和/總交叉數(shù))×100%,總侵染率=(總交叉點(diǎn)-無侵染點(diǎn)數(shù))/總交叉點(diǎn)×100%。
1.4 數(shù)據(jù)處理與分析
利用Excel 2007對(duì)數(shù)據(jù)進(jìn)行平均值、標(biāo)準(zhǔn)誤等初步處理,生物量和菌根侵染率采用SPSS 17.0進(jìn)行單因素方差分析(one-way ANOVA),Duncan多重比較及Pearson相關(guān)分析。相關(guān)圖表在SigmaPlot 12.0中完成。
2 結(jié)果與分析
2.1 供試種根系菌根結(jié)構(gòu)與類型
2個(gè)供試樹種的菌根結(jié)構(gòu)組成差異明顯。美國白蠟根系菌根為典型的A型(arum-type)叢枝結(jié)構(gòu),復(fù)葉槭的菌根結(jié)構(gòu)為典型的P型(paris-type)。美國白蠟根系菌根菌絲除少量觀測(cè)胞內(nèi)菌絲圈(圖1 A)外,多為胞間菌絲和根圍菌絲,且多為無隔菌絲,少見有隔菌絲;泡囊結(jié)構(gòu)的形態(tài)則主要有橢圓形、球形及棒狀,偶見不規(guī)則狀泡囊(圖1C);叢枝結(jié)構(gòu)為典型的二叉分支結(jié)構(gòu)(圖1D)。復(fù)葉槭根系菌根的菌絲則以胞內(nèi)菌絲和菌絲圈為主,少量觀測(cè)到胞間菌絲(圖2A,B,C);各處理中泡囊均不常見,形狀多為橢圓形(圖2D);叢枝結(jié)構(gòu)多為消解狀態(tài),僅在細(xì)胞皮層中形成點(diǎn)狀。
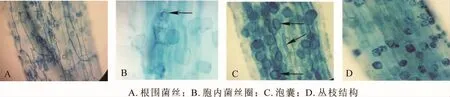
圖1 美國白蠟根系叢枝菌根結(jié)構(gòu)(800倍)Figure 1 Arbuscular mycorrhizal fungi structure of Fraxinus americana(800 ×)
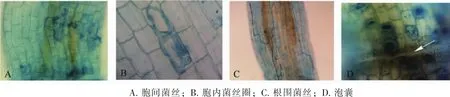
圖2 復(fù)葉槭根系叢枝菌根結(jié)構(gòu)(800倍)Figure 2 Arbuscular mycorrhizal fungi structure of Acer negundo(800 ×)
2.2 不同徑級(jí)土壤微生物接種處理下供試種反饋響應(yīng)情況
2.2.1 不同徑級(jí)土壤微生物接種下2個(gè)樹種幼苗生物量 由圖3可見:美國白蠟在SW0.12處理下總生物量最高,地上部分莖、葉生物量積累均受到促進(jìn)作用;美國白蠟在FS2.00處理下總生物量最低,地下部分生物量顯著低于對(duì)照(P<0.05),F(xiàn)S2.00處理抑制了地下部分生物量的積累;美國白蠟在SW0.12處理下各部分生物量顯著高于FS2.00處理下各部分生物量(P<0.05)。復(fù)葉槭在FS2.00處理下總生物量最高,且該處理下細(xì)根、粗根、莖、葉等各部分生物量也是最高,SW0.12與FS2.00處理下復(fù)葉槭各部分生物量無顯著差異。
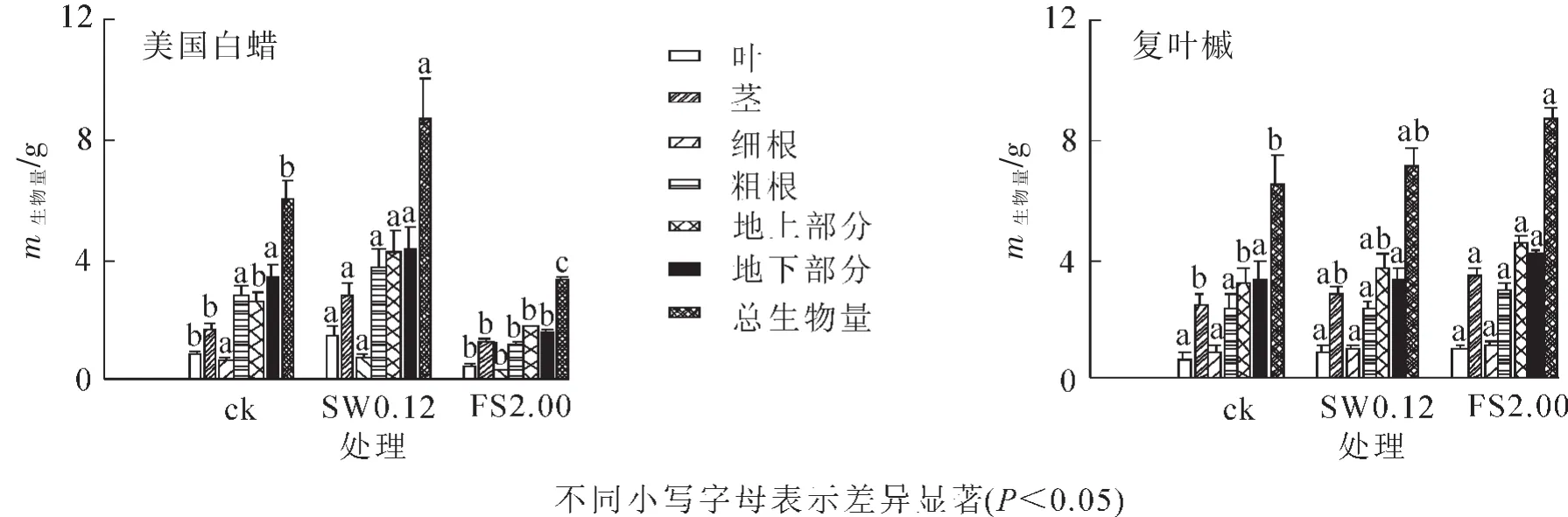
圖3 不同徑級(jí)土壤微生物接種下美國白蠟和復(fù)葉槭各部分生物量Figure 3 Effects of different size class of soil biota on the biomass of Fraxinus americana and Acer negundo
2.2.2 不同徑級(jí)土壤微生物接種下2個(gè)樹種幼苗菌根侵染 由圖4可見:不同土壤處理對(duì)美國白蠟菌根各結(jié)構(gòu)發(fā)育有影響,叢枝結(jié)構(gòu)定殖率在SW0.12處理下最高,而在FS2.00處理下最低;菌絲侵染率在FS2.00處理下最高,而在SW0.12處理下最低,SW0.12處理抑制美國白蠟菌絲侵染;就總侵染率而言,SW0.12處理下最高,其次是FS2.00處理,對(duì)照(ck)處理最低。不同土壤處理對(duì)復(fù)葉槭各菌根結(jié)構(gòu)發(fā)育無影響,菌根總侵染率在FS2.00處理下最高,其次是SW0.12處理,ck處理下最低。

圖4 不同徑級(jí)微生物接種下美國白蠟和復(fù)葉槭菌根侵染率Figure 4 Effects of different size class of soil biota on the mycorrhizal colonization of Fraxinus americana and Acer negundo
2.3 不同來源土壤對(duì)供試種反饋?zhàn)饔貌町?/h3>
2.3.1 不同來源土壤微生物接種下2個(gè)樹種生物量 由圖5可見,美國白蠟在AS處理下葉、莖、細(xì)根、粗根等各部分生物量均顯著高于HS處理,分別高出133.2%,75.0%,106.5%,167.7%,總生物量高出量為119.3%(P<0.05)。相反,復(fù)葉槭在HS處理下葉、莖、細(xì)根、粗根等各部分生物量顯著高于AS處理(P<0.05),分別高出為144.1%,95.0%,72.7%,112.9%,HS處理下總生物量比AS處理高出102.2%。2個(gè)樹種地上部分和地下部分生物量均受AS和HS處理影響顯著。
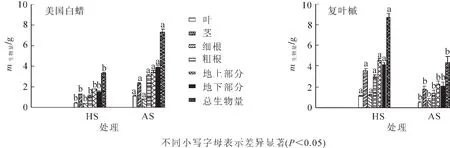
圖5 不同土壤來源微生物接種下美國白蠟和復(fù)葉槭生物量Figure 5 Effects of soil source on the biomass of Fraxinus americana and Acer negundo
2.3.2 不同土壤來源微生物接種下2個(gè)樹種菌根侵染率 從圖6可見:美國白蠟總侵染率在AS處理下顯著高于HS處理(P<0.05),高出81.4%,各菌根結(jié)構(gòu)中,除叢枝結(jié)構(gòu)定殖率在HS和AS之間無差異外,其他結(jié)構(gòu)均為AS處理高于HS處理(P<0.05)。不同土壤處理下復(fù)葉槭各菌根侵染率及總侵染率無顯著差異(P>0.05)。
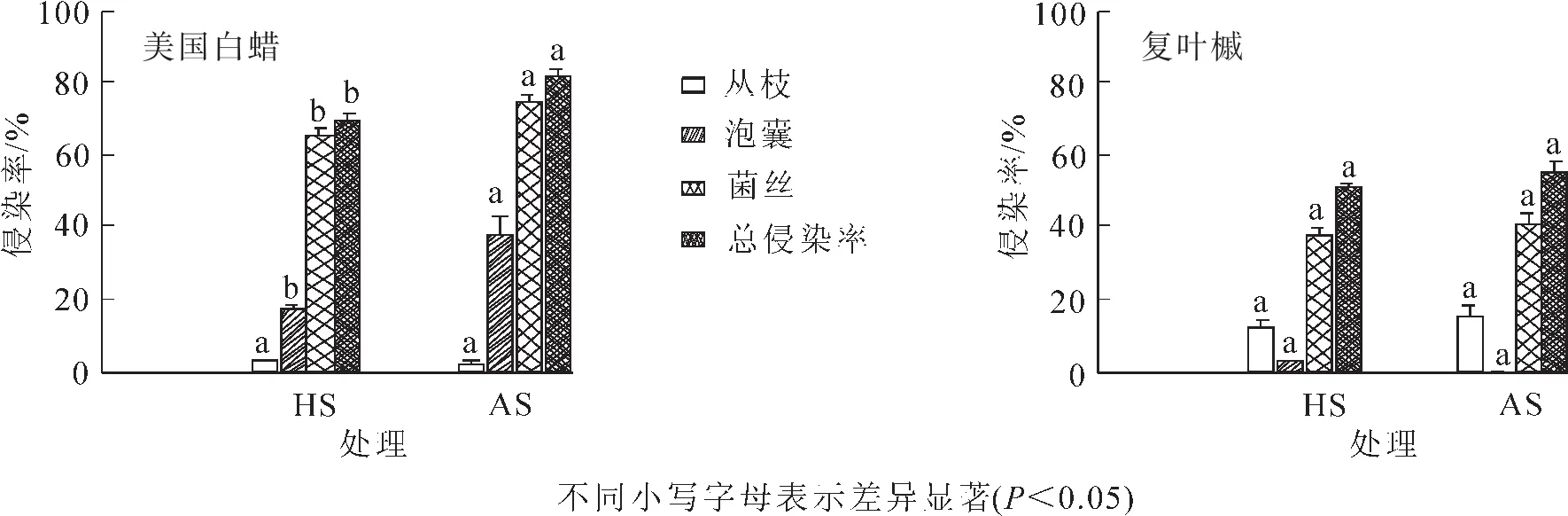
圖6 不同土壤來源微生物處理下美國白蠟和復(fù)葉槭的菌根侵染率Figure 6 Effects of soil source on the mycorrhizal colonization of Fraxinus americana and Acer negundo
2.4 2個(gè)樹種菌根侵染與生物量相關(guān)關(guān)系分析
總體來看,各處理下2個(gè)樹種總生物量與總侵染率無顯著相關(guān)性,不同處理影響2個(gè)樹種生物量與各菌根結(jié)構(gòu)的相關(guān)關(guān)系。在特定植物-土壤反饋體系內(nèi),幼苗生物量與菌根侵染率間表現(xiàn)出顯著或極顯著相關(guān)性。表1可見:對(duì)照處理下,美國白蠟幼苗葉生物量、地上部分生物量及總生物量均與泡囊侵染率有顯著正相關(guān)關(guān)系(P<0.05);HS處理下美國白蠟葉生物量、莖生物量與泡囊侵染率顯著負(fù)相關(guān)(P<0.05);AS處理下美國白蠟粗根生物量與泡囊侵染率顯著負(fù)相關(guān)(P<0.05)。由表2可見:HS處理下復(fù)葉槭幼苗泡囊定殖率與其細(xì)根生物量、莖生物量顯著正相關(guān)(P<0.05),與地上部分生物量和總生物量極顯著正相關(guān)(P<0.01)。在植物-土壤反饋體系中,2個(gè)樹種根系泡囊侵染率是一個(gè)相對(duì)比較敏感的指標(biāo)。
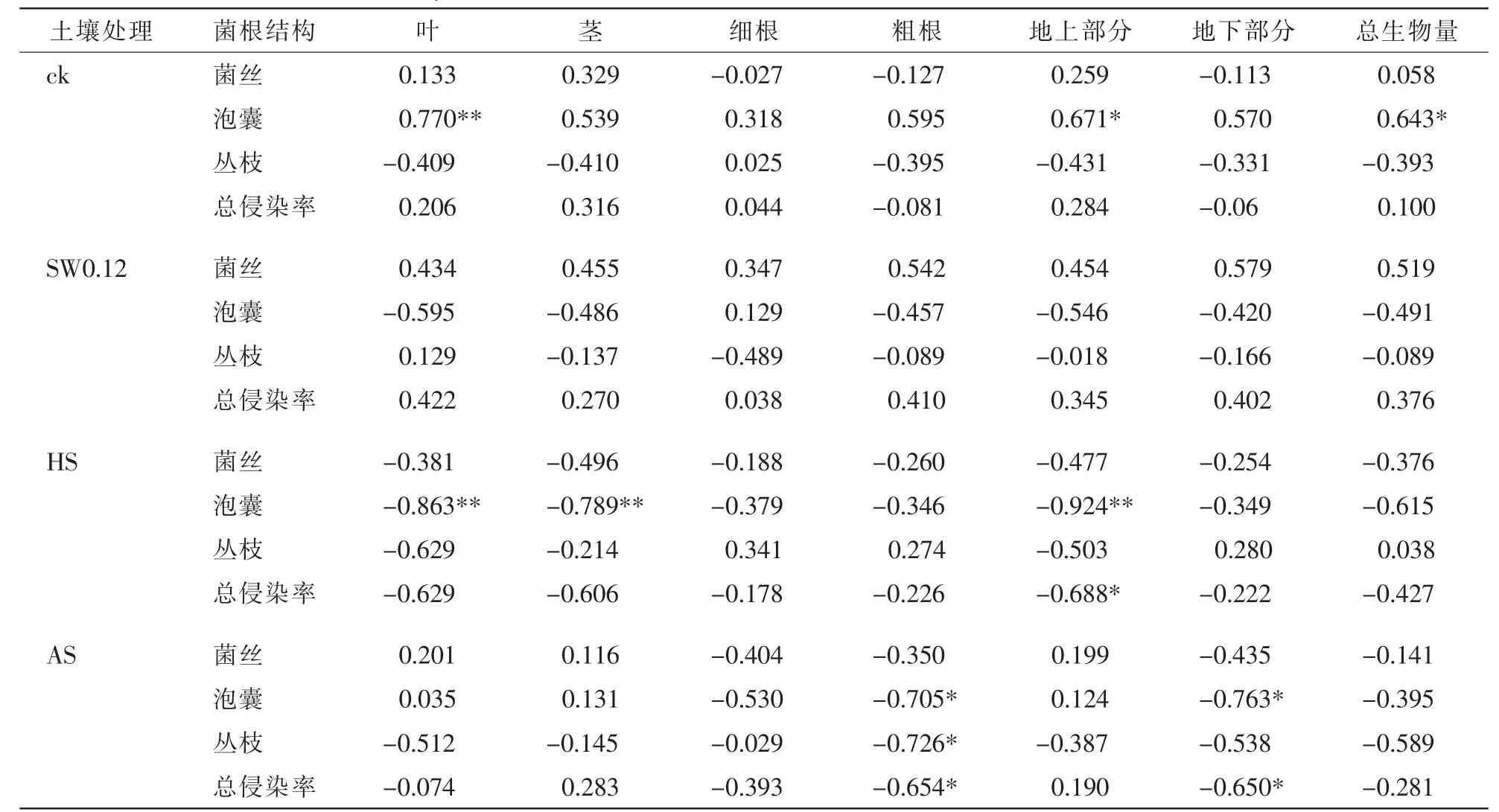
表1 不同處理下美國白蠟各菌根結(jié)構(gòu)侵染率與各部分生物量相關(guān)性分析Table 1 Correlation analysis of AMF colonization and biomass of Fraxinus omericana under different treatments
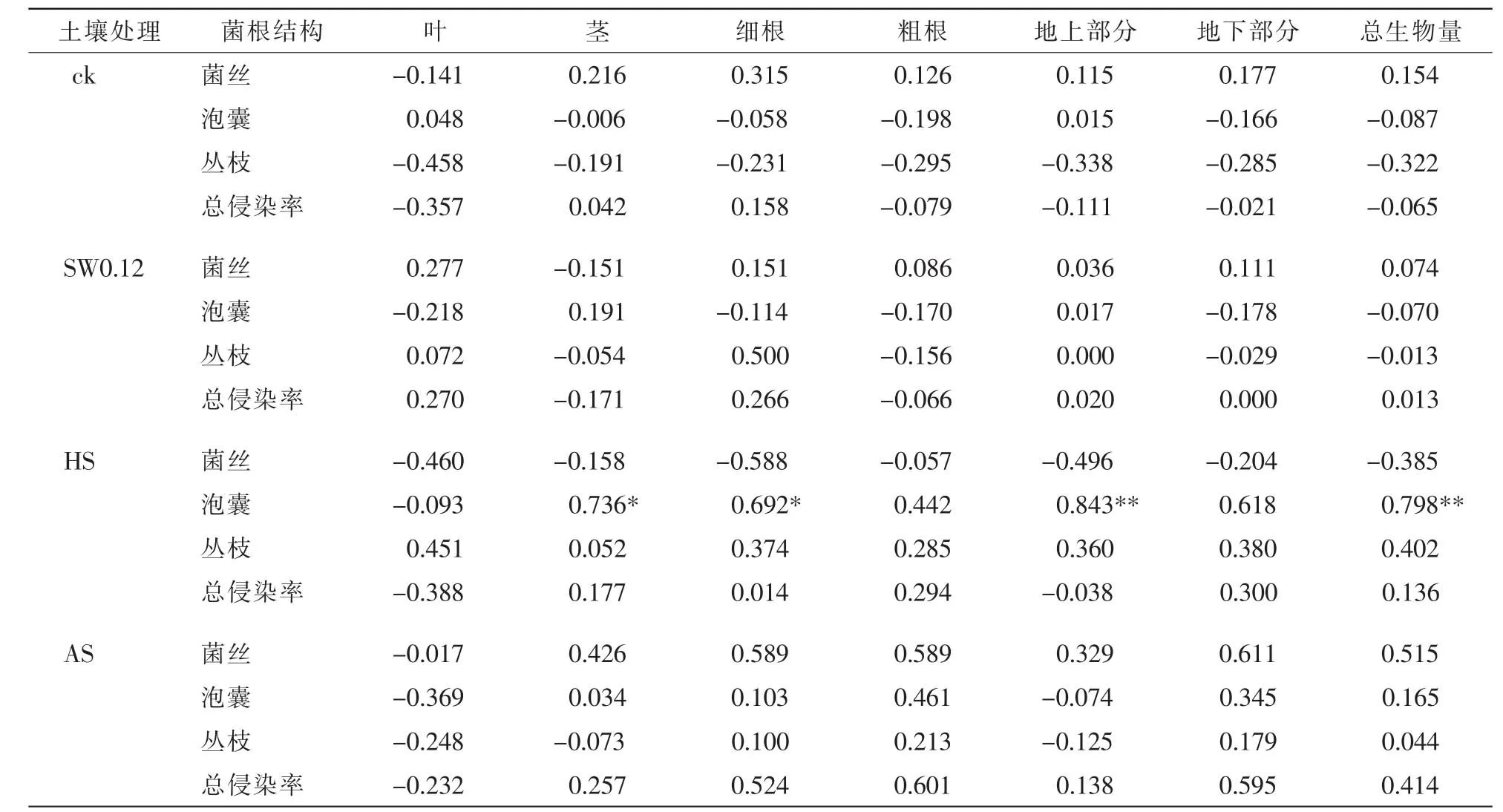
表2 不同處理下復(fù)葉槭各菌根結(jié)構(gòu)侵染率與各部分生物量的相關(guān)性分析Table 2 Correlation analysis of AMF colonization and biomass of Acer negundo under different treatments
3 討論
3.1 同樹種林下不同徑級(jí)土壤微生物類群對(duì)幼苗的反饋?zhàn)饔?/h3>
目前,判定植物-土壤反饋?zhàn)饔脧?qiáng)度和方向主要通過測(cè)定供試種生物量、株高及種子萌發(fā)等情況。從原狀土處理與對(duì)照組的對(duì)比來看,美國白蠟林下土壤不利于其幼苗生長,即表現(xiàn)為植物-土壤反饋體系中的負(fù)反饋?zhàn)饔茫欢鴱?fù)葉槭林下土壤則是利于其幼苗生長,表現(xiàn)為正反饋?zhàn)饔谩?個(gè)樹種幼苗的生長均受土壤微生物影響較大,美國白蠟林下土壤存在抑制其同種幼苗生長的專性真菌或病原菌,可能抑制自身的林下更新,能有效地規(guī)避同種內(nèi)部代際競(jìng)爭(zhēng),維持群落物種多樣性[20-22]。復(fù)葉槭林下的土壤正反饋?zhàn)饔脛t可能有利于其幼苗在林下的更新以及持續(xù)生存,從而增加樹種在群落中的豐度,也可能增強(qiáng)該物種在某地的入侵能力[3,13-14]。對(duì)比不同徑級(jí)土壤微生物類群(<2.00 mm,<0.12 mm)處理下2種植物生長表現(xiàn)可知,去除大型動(dòng)物及大型真菌等的土壤浸提液更有利于美國白蠟幼苗生長,表明美國白蠟林下土壤中大型土壤動(dòng)物抑制幼苗更新及生長,且該類大型動(dòng)物可能抑制徑級(jí)相對(duì)較小的微生物類群的有益作用;而就復(fù)葉槭而言,浸提液處理中(<0.12 mm)幼苗各部分生物量較原狀土壤接種處理的略低但無顯著差異,表明不同徑級(jí)土壤微生物類群對(duì)復(fù)葉槭植物-土壤反饋?zhàn)饔貌划a(chǎn)生影響。不同的土壤處理方式或土壤接種方式對(duì)反饋?zhàn)饔玫膹?qiáng)度和方向影響較大[4-5],但這種影響也因物種而異。
對(duì)照處理下2種幼苗根系侵染率均不為0,可能是前期育苗基質(zhì)中含有一定量的真菌類群,致使幼苗根系有一定的菌根侵染,用體積分?jǐn)?shù)為75%的乙醇消毒基質(zhì)并不能抑制其生長或?qū)⑵湎麥纭牟煌瑥郊?jí)土壤微生物類群對(duì)2種植物菌根真菌的反饋?zhàn)饔脕砜矗瑹o論是浸提液還是原狀土壤接種中微生物類群較對(duì)照均有益于2種植物菌根真菌侵染,但這2種土壤處理方式對(duì)供試種菌根真菌定殖率影響差異不大。
3.2 不同土壤來源微生物對(duì)植物的反饋?zhàn)饔?/h3>
對(duì)比同種樹下土壤及異種樹下土壤處理下的植物生長表現(xiàn),美國白蠟受到同種樹下土壤微生物類群的抑制作用,而在異種樹下土壤中則受到促進(jìn)作用;復(fù)葉槭則受到同種樹下土壤微生物類群的促進(jìn)作用,而在異種樹下土壤中則受到抑制作用。NIJJER等[23]進(jìn)行了與本研究相似的試驗(yàn),即同種樹下土壤較異種樹下土壤不利于烏桕Sapium sebiferum幼苗定植和生長,并在進(jìn)一步的反饋試驗(yàn)中認(rèn)為同種樹下土壤中抑制幼苗生長的是土壤中的真菌。本研究發(fā)現(xiàn)美國白蠟在同種樹下土壤菌根侵染率及生物量均顯著低于異種樹下土壤,該種抑制作用是否也來源于同種成年樹林下土壤中具有抑制作用的真菌則需要進(jìn)一步的實(shí)驗(yàn)驗(yàn)證。美國白蠟在異種土壤接種中有較高的菌根侵染率及生物量積累,而相關(guān)性分析卻表明菌根侵染率與生物量無顯著相關(guān)關(guān)系。復(fù)葉槭菌根侵染率在2種土壤處理下無顯著差異,而生物量同種樹下土壤處理顯著高于異種樹下土壤處理,菌根真菌的有益作用并未在生物量積累中得到顯現(xiàn)。不少反饋試驗(yàn)也證實(shí)供試種生物量與菌根真菌并無顯著相關(guān)關(guān)系[9,24-25],菌根真菌對(duì)植物的促進(jìn)作用無法與土壤中發(fā)揮負(fù)反饋?zhàn)饔玫奈⑸镱惾嚎购猓湔答佔(zhàn)饔每赡苁艿揭种疲?0,23,26]。
美國白蠟植物-土壤反饋關(guān)系符合JANZEN-CONNELL模型假說[20,27],即植物-土壤反饋?zhàn)饔靡种瞥赡陿淞窒峦N幼苗生長從而維持較高物種多樣性;該種植物-土壤反饋模式有利于森林群落維持較高的物種豐富度,從而避免單一物種結(jié)構(gòu),促進(jìn)森林群落健康發(fā)展。復(fù)葉槭植物-土壤反饋關(guān)系則符合物種入侵機(jī)制中逃離天敵假說[28]:物種引入?yún)^(qū)域內(nèi)自然天敵遠(yuǎn)少于本土區(qū)域,從而促進(jìn)該物種大量定植。REINHART等[13]研究表明:復(fù)葉槭在美國本土區(qū)域受到同種樹下和異種樹下土壤負(fù)反饋?zhàn)饔茫就羺^(qū)域土傳病原菌對(duì)其擴(kuò)散有嚴(yán)重抑制作用。本研究中,復(fù)葉槭在中國引種區(qū)則受到正反饋?zhàn)饔茫砻鲝?fù)葉槭在中國有較強(qiáng)擴(kuò)散能力和入侵潛力,鑒于復(fù)葉槭在北美及歐洲部分地區(qū)成功入侵并帶來嚴(yán)重后果,建議對(duì)其(大苗、幼樹、成年樹)植物-土壤反饋?zhàn)饔眠M(jìn)行跟蹤研究,并對(duì)其入侵能力進(jìn)行全面評(píng)估。
3.3 菌根結(jié)構(gòu)及類型在植物-土壤反饋體系中的響應(yīng)
供試種美國白蠟和復(fù)葉槭叢枝菌根類型分別為A型和P型。叢枝P型結(jié)構(gòu)較A型結(jié)構(gòu)發(fā)育更慢,2種類型菌根結(jié)構(gòu)吸收養(yǎng)分的能力也有差異[29-30]。根據(jù)本研究中美國白蠟和復(fù)葉槭在不同反饋體系中的響應(yīng),推斷不同菌根類型可能影響供試種在植物-土壤反饋體系中的表現(xiàn)。目前沒有對(duì)這一觀點(diǎn)進(jìn)行闡明的研究,需進(jìn)一步驗(yàn)證。不同的土壤接種方式對(duì)美國白蠟菌根各結(jié)構(gòu)的組成有顯著影響,其中不同徑級(jí)土壤微生物及不同來源土壤微生物處理均對(duì)美國白蠟泡囊及菌絲結(jié)構(gòu)定殖率有顯著影響;而與此不同的,復(fù)葉槭在各土壤處理下各菌根結(jié)構(gòu)定殖率無顯著差異;不同反饋體系下土壤接種劑對(duì)2種植物菌根泡囊與生物量的相關(guān)關(guān)系有顯著影響,在不同反饋體系下泡囊結(jié)構(gòu)表現(xiàn)相對(duì)敏感。2個(gè)樹種表現(xiàn)出明顯的營養(yǎng)吸收方式的差異,在不同處理中美國白蠟菌根侵染率可達(dá)70%,復(fù)葉槭僅45%~55%。同時(shí),在相同土壤接種下復(fù)葉槭細(xì)根及粗根生物量均高于美國白蠟細(xì)根及粗根生物量,表明2個(gè)樹種對(duì)菌根的依賴性確有差異;結(jié)合供試種在不同土壤接種中反饋響應(yīng)差異,推斷寄主植物菌根依賴強(qiáng)度在一定程度上可能影響植物與土壤微生物之間的耦合關(guān)系[31]。
4 結(jié)論
本研究在一定程度上闡明了美國白蠟和復(fù)葉槭在中國引種區(qū)的反饋模式,并探討它們的不同反饋機(jī)理。得到以下結(jié)論:①試驗(yàn)方法影響植物-土壤反饋?zhàn)饔媒Y(jié)果。不同的反饋體系的設(shè)計(jì)影響植物物種生物量及菌根侵染率表現(xiàn),土壤中大型動(dòng)物及大型真菌對(duì)美國白蠟幼苗生長有重要影響,研究植物-土壤反饋?zhàn)饔脵C(jī)制時(shí)應(yīng)考慮土壤中不同徑級(jí)土壤微生物類群的功能差異性。②試驗(yàn)植物種類影響植物-土壤反饋?zhàn)饔媒Y(jié)果。美國白蠟和復(fù)葉槭表現(xiàn)出不同反饋模式,美國白蠟林下土壤抑制其幼苗生長的植物-土壤反饋模式有利于森林群落規(guī)避同種內(nèi)部代際競(jìng)爭(zhēng),而復(fù)葉槭林下土壤促進(jìn)其幼苗生長的反饋模式則提示其具有較強(qiáng)的入侵潛能。③不同菌根類型植物反饋?zhàn)饔貌町惷黠@,菌根特性是植物-土壤反饋?zhàn)饔迷u(píng)估的重要指標(biāo)。菌根類型差異導(dǎo)致植物根系吸收養(yǎng)分的方式有很大差異,從而可能引起不同植物在植物-土壤反饋?zhàn)饔弥械牟町悾⑶以诒狙芯康姆答佔(zhàn)饔弥校菽医Y(jié)構(gòu)對(duì)植物種類差異及反饋體系差異的響應(yīng)較為敏感。因此,在今后的植物-土壤反饋研究中,與植物互利共生作用的菌根特性應(yīng)考慮在內(nèi)。
5 參考文獻(xiàn)
[1]BEVER J D,DICKIE I A,FACELLI E,et al.Rooting theories of plant community ecology in microbial interactions[J].Trends Ecol Evol,2010,25(8):468 - 478.
[2]HARRISON K A,BARDGETT R D.Influence of plant species and soil conditions on plant-soil feedback in mixed grassland communities [J].J Ecol,2010,98(2):384 - 395.
[3]KULMATISKI A,BEARD K H,STEVENS J R,et al.Plant-soil feedbacks:a meta-analytical review [J].Ecol Lett,2008,11(9):980 - 992.
[4]BRINKMAN E P,van der PUTTEN W H,BAKKER E J,et al.Plant-soil feedback:experimental approaches,statistical analyses and ecological interpretations [J].J Ecol,2010,98(5):1063 - 1073.
[5]van de VOORDE T F J,van der PUTTEN W H,BEZEMER T M.Soil inoculation method determines the strength of plant-soil interactions [J].Soil Biol Biochem,2012,55(1):1 - 6.
[6]劉永俊.叢枝菌根的生理生態(tài)功能[J].西北民族大學(xué)學(xué)報(bào)(自然科學(xué)版),2008,29(1):54-59.LIU Yongjun.The physiological and ecological functions of arbuscular mycorrhiza [J].J Northwest Univ Natl Nat Sci,2008,29(1):54 - 59.
[7]梁倩倩,李敏,劉潤進(jìn),等.全球變化下菌根真菌的作用及其作用機(jī)制[J].生態(tài)學(xué)報(bào),2014,34(21):6039-6048.LIANG Qianqian,LI Min,LIU Runjin,et al.Function and functioning mechanisms of mycorrhizal fungi under global changes [J].Acta Ecol Sin,2014,34(21):6039 - 6048.
[8]BUNN R A,RAMSEY P W,LEKBERG Y.Do native and invasive plants differ in their interactions with arbuscular mycorrhizal fungi?a meta-analysis [J].J Ecol,2015,103(6):1547 - 1556.
[9]YANG Qiang,CARRILLO J,JIN Hongyue,et al.Plant-soil biota interactions of an invasive species in its native and introduced ranges:implications for invasion success [J].Soil Biol Biochem,2013,65(5):78 - 85.
[10]CALLAWAY R M,BEDMAR E J,REINHART K O,et al.Effects of soil biota from different ranges on Robinia invasion:acquiring mutualists and escaping pathogens [J].Ecology,2011,92(5):1027 - 1035.
[11]CALLAWAY R M,CIPOLLINI D,BARTO K,et al.Novel weapons:invasive plant suppresses fungal mutualists in America but not in its native Europe [J].Ecology,2008,89(4):1043 - 1055.
[12]KLIRONOMOS J N.Feedback with soil biota contributes to plant rarity and invasiveness in communities [J].Nature,2002,417(6884):67 - 70.
[13]REINHART K O,CALLAWAY R M.Soil biota facilitate exotic Acer invasions in Europe and North America [J].Ecol Appl,2004,14(6):1737 - 1745.
[14]REINHART K O,TYTGAT T,van der PUTTEN W H,et al.Virulence of soil-borne pathogens and invasion by Prunus serotina [J].New Phytol,2010,186(2):484 - 495.
[15]侯永俠,周寶利,吳曉玲,等.土壤滅菌對(duì)辣椒抗連作障礙效果[J].生態(tài)學(xué)雜志,2006,25(3):340-342.HOU Yongxia,ZHOU Baoli,WU Xiaoling,et al.Effects of soil sterilization on preventing continuous pepper cropping obstacles [J].Chin J Ecol,2006,25(3):340 - 342.
[16]張春英.云錦杜鵑菌根及其菌根真菌多樣性研究[D].北京:北京林業(yè)大學(xué),2008.ZHANG Chunying.Diversity of Ericoid Mycorrhiza and the Related Fungi Isolated from Hair Roots of Rhododendron fortune L.[D].Beijing: Beijing Forestry University,2008.
[17]PHILLIPS J M, HAYMAN D S.Improved procedures for clearing roots and staining parasitic and vesicular-arbusular mycorrhizal fungi for rapid assessment of infection [J].Trans Bri Mycol Soc,1970,55(1):158 - 161.
[18]MCGONIGLE T P,MILLER M H,EVANS D G,et al.A new method which gives an objective measure of colonization of roots by vesicular-arbuscular mycorrhizal fungi[J].New Phytol,1990,115(3):495 - 501.
[19]曾端香,袁濤,王蓮英.AM真菌接種劑與栽培基質(zhì)對(duì)牡丹容器苗叢枝菌根侵染的影響[J].中國農(nóng)學(xué)通報(bào),2011,27(10):108-112.ZENG Duanxiang, YUAN Tao, WANG Lianying.The effects of AM fungus and culture substrates on colonization of arbuscular mycorrhizal for tree peony container seedling [J].Chin Agric Sci Bull,2011,27(10):108-112.
[20]LIU Yu,YU Shixiao,XIE Zhiping,et al.Analysis of a negative plant-soil feedback in a subtropical monsoon forest[J].J Ecol,2012,100(4):1019 - 1028.
[21]HOVATTER S,BLACKWOOD C B,CASE A L.Conspecific plant-soil feedback scales with population size in Lobelia siphilitica (Lobeliaceae) [J].Oecologia,2013,173(4):1295 - 1307.
[22]肖博,周文,劉萬學(xué),等.紫莖澤蘭入侵地土壤微生物對(duì)紫莖澤蘭和本地植物的反饋[J].中國農(nóng)業(yè)科技導(dǎo)報(bào),2014,16(4):151 - 158.XIAO Bo,ZHOU Wen,LIU Wanxue,et al.Feedback of Ageratia adenophora soil microbe on A.adenophora and native plants [J].J Agric Sci Technol,2014,16(4):151 - 158.
[23]NIJJER S,ROGERS W E,SIEMANN E.Negative plant-soil feedbacks may limit persistence of an invasive tree due to rapid accumulation of soil pathogens [J].Proc R Soc B,2007,274(1625):2621 - 2627.
[24]NIJJER S,ROGERS W E,SIEMANN E.The effect of mycorrhizal inoculum on the growth of five native tree species and the invasive Chinese tallow tree (Sapium sebiferum) [J].Tex J Sci,2004,56(4):357 - 368.
[25]NIJJER S,ROGERS W E,LEE C T A,et al.The effects of soil biota and fertilization on the success of Sapium sebiferum [J].Appl Soil Ecol,2008,38(1):1 - 11.
[26]NIJJER S.Understanding Belowground Community Regulation in an Invaded Forest [D].Houston:Rice University,2006.
[27]McCARTHY-NEUMANN S,KOBE R K.Conspecific and heterospecific plant-soil feedbacks influence survivorship and growth of temperate tree seedlings [J].J Ecol,2010,98(2):408 - 418.
[28]MITCHELL C E,POWER A G.Release of invasive plants from fungal and viral pathogens [J].Nature,2003,421(6923):625 - 627.
[29]劉潤進(jìn),陳應(yīng)龍.菌物學(xué)[M].北京:科學(xué)出版社,2007.
[30]柏艷芳,郭紹霞,李敏.入侵植物與叢枝菌根真菌的相互作用[J].應(yīng)用生態(tài)學(xué)報(bào),2011,22(9):2457-2463.BAI Yanfang,GUO Shaoxia,LI Min.Interactions between invasive plants and arbuscular mycorrhizal fungi:a review[J].Chin J Appl Ecol,2011,22(9):2457 - 2463.
[31]李立青,張明生,梁作盼,等.叢枝菌根真菌促進(jìn)入侵植物紫莖澤蘭的生長和本地植物競(jìng)爭(zhēng)效應(yīng)[J].生態(tài)學(xué)雜志, 2016,35(1):79 - 86.LI Liqing,ZHANG Mingsheng,LIANG Zuopan,et al.Arbuscular mycorrhizal fungi enhance invasive plant,Ageratina adenophora growth and competition with native plants [J].Chin J Ecol,2016,35(1):79 - 86.

