3例局灶性皮質發育不良Ⅰ型診治思考并文獻復習
余佳佳,孔慶霞
局灶性腦皮質發育不良(focal cortical dysplasia,FCD)是指由神經元移行障礙或細胞增殖障礙所導致的局灶性腦皮質結構發育異常的疾病,是導致難治性癲癇(intractable epilepsy,IE)最常見的病因之一[1]。本研究通過回顧性分析近期我院神經外科確診的3例 FCD Ⅰ型患者的臨床資料,探討其臨床特點、輔助檢查及手術治療及預后等方面進行分析。
1 臨床資料
病例1:女,20歲,發作性抽搐12 y。患者約12 y前發高熱后出現抽搐發作,曾在當地醫院及北京等多家醫院就診,診斷為癲癇,給予丙戊酸鈉等藥物口服后,效果欠佳。平時間斷發作,發作時伴有小便失禁,多于睡眠時出現,夜間發作頻繁,抽搐后意識欠清醒,常因“感冒、勞累、月經來潮”等誘因出現抽搐發作。7 m前患者頻繁出現抽搐發作,緩解后意識無恢復,給予“丙戊酸鈉緩釋片、左乙拉西坦片、卡馬西平片”等抗癲癇藥物治療后,癥狀有所控制。腦頭皮視頻腦示右后頭部導聯可見頻發散在或成簇出現中高幅度尖波、尖慢復合波(見圖1)。行顱腦MRI檢查未見異常(見圖2)。PET-CT檢查示:右側頂葉較對側攝取FDG明顯減低(見圖3)。PET融合MRI示:右側頂葉異常信號(見圖4)。經患者的臨床表現及相關輔助檢查,最終定位癲癇灶位于右側頂葉。術前評估完全后在全麻下行右側頂葉癲癇灶切除術,術中見右側頂葉后部蛛網膜增厚、腦皮質萎縮;觸診腦組織顯示頂下小葉發硬。術后常規病理提示部分區域皮質神經元排列紊亂,正常六層結構消失,可見未知成熟神經元和巨大神經元,反應性星形膠質細胞增生(見圖5)。術后服用卡馬西平片 450 mg bid。經電話及門診隨訪患者3 m,未在出現癲癇發作,Engel分級:Ⅰ級。
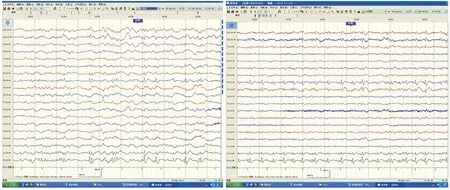
圖1 可見頻發散在或成簇出現中高幅度尖波、尖慢復合波,右頂葉為著
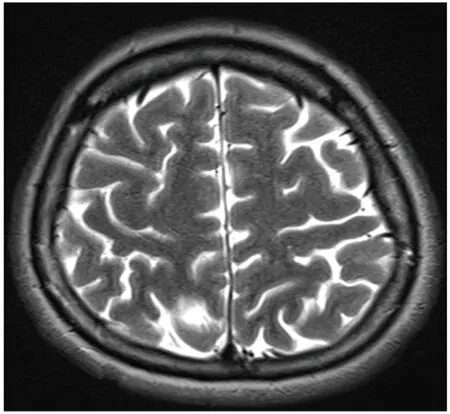
圖2 MRI未見明顯異常
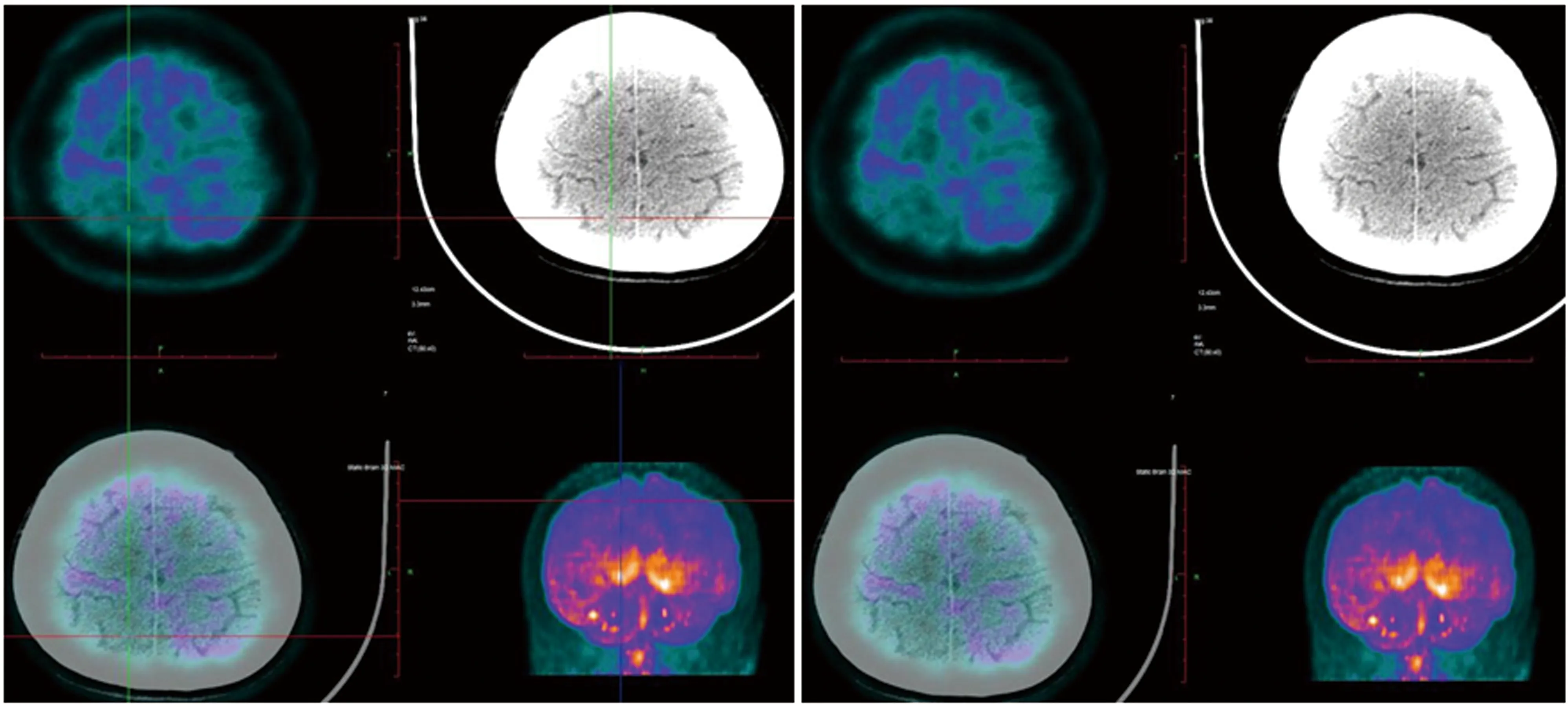
圖3 右側頂葉較對側攝取FDG明顯減低
圖4 PET-MRI右側頂葉異常信號
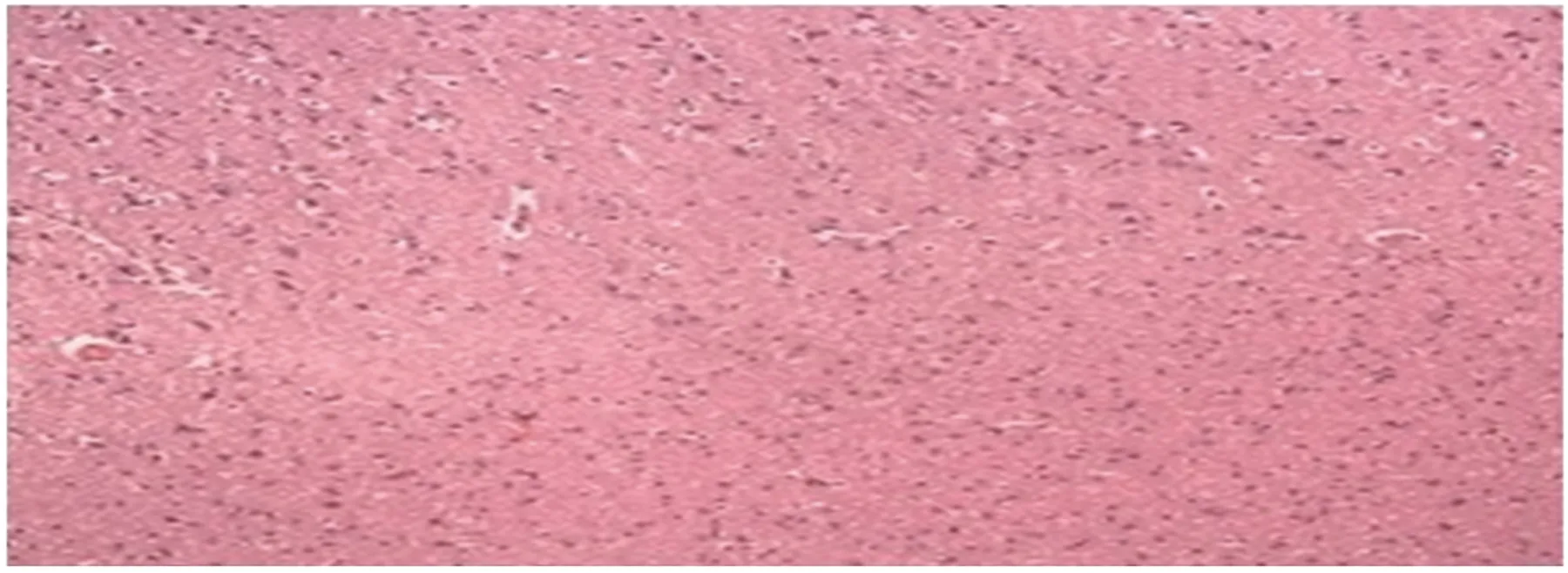
圖5 右側頂葉部分區域灰質內神經元排列紊亂,正常六層結構消失,可見未成熟神經元和巨大神經元,并膠質細胞輕度增生
病例2:男,11歲10月,反復發作性肢體抽搐6 y。患者6 y前無明顯誘因出現抽搐發作,發作時表現為意識不清,頭頸眼向左側偏斜,咂嘴,左手麻木,持續約1 min,白天發作多,每月均有發作。曾來我院就診,診斷為癲癇,給予德巴金治療,此后4 y未再有癲癇發作,但2 y前患者又出現抽搐發作,發作形式同前,再次來我院就診,給予口服卡馬西平300 mg bid,效果較差,進2 y來發作近30次。頭部MRI未見明顯異常。PET-CT檢查示:右側額中回交左側代謝減低。腦皮腦電圖示右側額-前顳起源的局限性發作并泛化。PET融合MRI示:右側額中回異常信號。綜合臨床表現及相關輔助檢查最終定位癲癇灶位于右側額葉。術前評估完全后在靜息符合麻醉下行右側額葉癲癇灶切除術,術中見右側額葉局部蛛網膜下腔擴大,蛛網膜肥厚,其下腦組織萎縮,呈小腦回樣改變、腦溝深、質地硬。術后常規病理提示部分區域神經元排列紊亂,正常六層結構消失,星形膠質細胞反應性增生,并可見含鐵血黃色沉著。術后服用卡馬西平片 300 mg bid,經電話隨訪2 m未再出現癲癇發作。Engel分級:Ⅰ級。
病例3:男,16歲,反復發作性意識不清12 y。患者于12 y前反復發熱,發熱后出現突發意識喪失,雙眼上翻,頭眼向左偏斜,口吐白沫,四肢抽搐,持續約2 min緩解。病情反復發作,發作頻率為每周1次至每月1次不等,發作間期無明顯不適。半年前患者發作頻繁,約每天發作1次,就診于我院,給予托吡酯、苯妥英鈉片、丙戊酸鈉、氯硝西泮等藥物,效果尚可。頭部MRI示:右側額中回-腦溝異常形態。腦皮腦電圖示:8.0~9.0 Hz α背景節律,清醒期和睡眠期均可見右側額區(FP2、F4導聯),中央區(C4導聯)可見少量高幅棘慢波;左側顳區陣發中等波幅尖波、棘波。PET-CT檢查示:雙側額葉、左側顳葉放射性攝取減低,左側額顳葉為著。綜合患者的臨床表現及相關輔助檢查,最終定位癲癇灶位于右側額葉。在靜吸復合麻醉下行右側額葉癲癇灶切除術。術中見右側額中回蛛網膜肥厚、腦皮質萎縮;觸診腦組織顯示額中回后部皮質硬化。沿腦溝將皮質和白質硬化區切除,額中回切除范圍約3 cm×2 cm×3 cm。術后常規病理提示:部分區域皮質神經元排列紊亂,正常六層結構消失,可見巨大神經元和未成熟神經元,反應性星形膠質細胞增生,符合局灶性皮質發育不良(FCD ⅠB型)。術后服用丙戊酸鈉緩釋片 500 mg bid、卡馬西平片 450 mg bid。術后隨訪2 m,仍間斷出現癲癇發作,但發作次數較術前較少。Engel分級:Ⅲ級。
2 討 論
1971年自Taylor等首次提出FCD以來,前后提出的多種分類方法,2004年Palmini根據病理學表現將FCD分為I型和II型[2],在臨床上得到了廣泛的使用。近年來隨著人們對有關FCD臨床基礎研究的大量開展,對FCD的分類提出了更高的要求,2011年國際抗癲癇協會(International League against Epilepsy,ILAE)在Palmini分類的基礎上進行了修改,增加了結合型FCD分類,將海馬硬化、癲癇相關性腫瘤、血管畸形相鄰的FCD命名為結合型FCD。這樣FCD分為單純型FCD和結合型FCD,單純型FCD包括Ⅰ型和Ⅱ型,結合型FCD為Ⅲ型[3]。
FCD最主要的臨床特征表現為難治性癲癇,是兒童部分性難治性癲癇和成人癲癇手術患者較為常見的病因[4]。Tassi等研究發現FCD的患者更容易產生高熱驚厥,FCD Ⅰ型有48%有高熱驚厥病史[5]。本組例1與例2患者癲癇發作前有高熱史,符合既往文獻報道。文獻報道[6]FCD 可以發生于大腦的任意腦葉,FCD Ⅰ 型常見于顳葉,也更易累及多個腦葉。FCD Ⅱ型常見于顳葉以外的腦葉,尤其是額葉。該3例患者中,例1患者病灶位于右側頂葉;例2患者病灶位于右側額中回;例3患者病灶位于右側額葉,表明FCD可以發生于大腦的任何腦葉,與文獻報道相符。與腫瘤、海馬硬化等因素引起的難治性癲癇不同,FCD一般在兒童發病較早[7],本組3例患者均在兒童時期發病,平均發病年齡5.7歲和既往研究結果相符。但是也有研究表明,有些FCD患者發病年齡超過18歲[8],這表明有相當部分的FCD患者因為沒有臨床癥狀而沒有被發現。文獻指出[9]累及多個腦葉、病變范圍較大的FCD患者的發病年齡要比微小病變更早。一些病例分析顯示[7,8],FCD Ⅰ型患者的發病年齡晚于FCD Ⅱ型,結合型FCD較單純型FCD發病年齡要晚。但也有研究表明[10],FCD Ⅰ型患者的平均發病年齡為 2.1歲,持續5.3 y,FCD Ⅱ 患者的平均發病年齡為2.4歲,平均持續4.5 y,統計分析后,兩者的差異并沒有統計學意義。
對于FCD的影像學檢查方法,目前還沒有任何一種影像學技術能夠對FCD達到完全檢測,有不少患者的顱腦MRI檢查及其他功能性影像學檢查無明顯異常。MRI是檢查FCD的重要檢查方法[11],FCD Ⅰ型多表現為局部大腦發育不良、白質萎縮、白質T2WI信號增高,但是有些FCD Ⅰ型病變輕微,僅僅表現為結構異常,在MRI中常常難以發現,特別是顳葉外側皮質的FCD往往不容易被發現。有文獻報道FCD患者術前MRI檢查的陽性率50%~70%[12],部分患者可無異常表現[13]。另一文獻也報道,約有33%~37%的FCD Ⅰ在MRI上呈陰性。本組例1與例2患者行MRI檢查均為未發現異常,呈陰性表現,與文獻報道相符。然而,對于MRI難以發現的FCD,是否還有其他的檢查方法?經查閱相關文獻[14,15]發現PET對發現病灶的敏感性較高,甚至能夠檢測出 MRI陰性的輕型FCD,對 MRI高度懷疑而不能夠明確的病灶,PET-CT 檢查是有效的輔助檢查手段。研究表明,在癲癇發作期致灶局部組織葡萄糖利用率升高,呈高代謝表現;發作間期局部組織葡萄糖利用率降低,呈低代謝表現。本例1與例2患者MRI均未發現病灶,但行PET-CT檢查后發現病灶。由此提醒臨床醫生當MRI未發現病灶而臨床又支持FCD時,并不能排除FCD,此時我們可以考慮行FET-CT檢查進一步排查病灶。
神經電生理檢查對診斷FCD也有一定的意義,FCD的電生理學檢查往往表現為腦電圖上的局限性的節律性放電,和病灶具有空間關聯性,但是和其它的難治性癲癇并沒有特異性的差別。研究發現[16]FCD所致難治性癲癇頭皮EEG間歇期癲癇樣放電形態與FCD類型之間有一定關系:其中FCD Ⅰ型和FCD Ⅱ型間歇期放電形態以棘波多見;FCD Ⅱ型中以多棘波形態多見。腦磁圖是一種無創性探測大腦神經電磁信號的一種腦功能檢測技術,它在癲癇灶的定位和腦功能區定位兩方面具有重要的作用。近年來有研究發現[17],幾近一半的腦磁圖無棘波的癲癇患者,腦磁圖檢查中都可以發現棘波。由此可見,當EEG未發現異常時,腦磁圖不失為一種重要的檢查方法。顱內電極對發現癲癇灶也具有重要的意義,它能更加準確的定位癲癇起始灶,但因患者家屬的經濟承受能力以及設備因素,本組患者未采用腦磁圖以及皮質腦電圖的檢查方法。
對于FCD相關性癲癇通常是藥物難治性的,目前還沒有針對FCD的特異性抗癲癇藥物,因此廣譜抗癲癇藥物丙戊酸鈉及一些部分性抗癲癇藥物在臨床上廣泛使用。外科手術是治療FCD所致難治性癲癇較為有效的方法。研究表明,FCD致難治性癲癇術后的癲癇緩解率可達50%~80%[7]。FCD病理分型對手術預后的是否有影響目前仍存在較大爭議。有報道FCD Ⅱ型手術效果好于FCD Ⅰ型[18],認為FCD Ⅱ型病變較為局限且其致病性更高,較易被MRI檢出及腦電圖等精確定位,更有可能被完全切除,手術效果較好。但是也研究者持相反的觀點[19],其認為FCD Ⅰ型手術效果好于FCD Ⅱ型原因是:(1)FCD Ⅰ型主要位于顳葉,顳葉病灶更容易被完全切除;(2)在同等切除病灶的情況下,FCD Ⅱ型殘余病灶的致癇性高于FCD Ⅰ型。Krsek 等[20]就報道FCD Ⅰ型的患兒智力較差,行為異常更為多見,手術效果明顯比較差。本3例患者術后未發現此規律,術后均未再出現癲癇發作,恢復較好,這也可能與隨訪時間短有關。
雖然現在有不少輔助檢查方法輔助臨床診斷,但是達到明確診斷并不是那么容易。比如一些難治性癲癇患者行顱腦MRI檢查其結果極有可能是陰性的,此時給我們診斷帶來一定的阻力。因此我們寄希望進一步輔助診段技術以達到明確診斷。盡管目前手術治療是成功的,但是位于功能區的、多灶性的,有冀于將來用微創和藥物的手段來治療難治性癲癇。
[參考文獻]
[1]Barkovich AJ,Guerrini R,Kuzniecky RI,et al. A developmental and genetic classification for malformations of cortical development[J]. Brain,2012,135(5):1348-1369.
[2]Palmini A,Najm I,Avanzini G,et al. Terminology and classification of the cortical dysplasias[J]. Neurology,2004,62(6 Suppl 3):S2-8.
[3]Blumcke I,Thom M,Aronica E,et al. The clinicopathologic spectrum of focal cortical dysplasias:a consensus classification proposed by an ad hoc Task Force of the ILAE Diagnostic Methods Commission[J]. Epilepsia,2011,52(1):158-174.
[4]Hauptman JS,Mathern GW. Surgical treatment of epilepsy associated with cortical dysplasia:2012 update[J]. Epilepsia,2012,53(Suppl 4):98-104.
[5]Tassi L,Meroni A,Deleo F,et al. Temporal lobe epilepsy:neuropathological and clinical correlations in 243 surgically treated patients[J]. Epileptic Disord,2009,11(4):281-292.
[6]武 江,何利兵,李文玲. 局灶性腦皮質發育不良的臨床特征分析[J]. 河北醫藥,2013,35(24):3785-3787.
[7]Cepeda C,André VM,Levine MS,et al. Epileptogenesis in pediatric cortical dysplasia:the dysmature cerebral dexelopmental hypothesis[J]. Epilepsy Behav,2006,9(2):219-235.
[8]Lerner JT,Salamon N,Hauptman JS,et al. Assessment and surgical outcomes for mild type I and severe type Ⅱ cortical dysplasia:a critical review and the UCLA experience[J]. Epilepsia,2009,50(6):1310-1335.
[9]Siegel AM,Cascino GD,Elger CE,et al. Adult-onseh epilepsy in focal cortical dysplasia of Taylor type[J]. Neurology,2005,64(10):1771-1774.
[10]Yao K,Duan Z,Zhou J,et al. Clinical and immunohistochemical characteristics of type Ⅱ and type Ⅰ focal cortical dysplasia[J]. Oncotarget,2016,7(47):76415-76422.
[11]Ahmed B,Brodley CE,Blackmon KE,et al. Cortical feature analysis and machine learning improves detection of “MRI-negative” focal cortical dysplasia[J]. Epilepsy Behav,2015,48(1):21-28.
[12]Bast T,Ramantani G,Seitz A,et al. Focal cortical dysplasia:prevalence,clinical presentation and epilepsy in children and adults[J]. Acta Neurol Scand,2006,113(2):72-81.
[13]Colombo N,Tassi L,Galli C,et al. Focal cortical dysplasias:MR imaging,histopathologic,and clinical correlations in surgically treated treated patients with epilepsy[J]. AJNR Am J Neuroradiol,2003,24(4):72.
[14]Gok B,Jallo G,Hayeri R,et al. The evaluation of FDG-PET imaging for epileptogenic focus localization in patients with MRI positive and MRI negative temporal lobe epilepsy[J]. Neuroradiology,2013,55(5):541-550.
[15]Chassoux F,Rodrigo S,Semah F,et al. FDG-PET improves surgical outcome in negative MRI Taylor-type focal cortical dysplasias[J]. Neurology,2010,75(24):2168-2175.
[16]陳述花,張冰清,王 靜,等. 難治性癲癇中局灶性腦皮質發育不良類型與頭皮腦電圖的關系[J]. 中華神經外科雜志,2013,29(12):1216-1219.
[17]Kharkar S,Knowlton R. Magnetoencephalography in the presurgical evaluation of epilepsy[J]. Epilepsy Behav,2015,46(5):19-26.
[18]Rowland NC,Englot DI,Cage TA,et al. A meta-analysis of predictors of seizure freedom in the surgical management of focal cortical dysplasia[J]. J Neurosurg,2012,116(5):1035-1041.
[19]林元相,林 壟,康德智,等. 局灶性皮質發育不良相關性難治性癲癇的手術預后及其相關影響因素分析[J]. 中華醫學雜志,2012,92(25):1763-1766.
[20]Krsek P,Pieper T,Karlmeier A,et al. Different presurgical characteristics and seizure outcomes in children with focal cortical dysplasia type Ⅰ or Ⅱ[J]. Epilepsia,2009,50(1):125-137.

