蝦青素對急性腦出血小鼠的神經功能的保護及機制研究
何 洋,高 揚,曹 芳,張 強,陳 偉,冉啟山,劉喜平,楊 露,姚聲濤
腦出血(intracerebral hemorrhage,ICH)是神經科常見的疾病,其發病率約占全部腦血管疾病的35%,是腦血管最重要疾病之一,全球每年約有300萬新發的ICH患者,其發病率、致死致殘率極高,遠超其他種疾病對人群造成的危害,ICH后存活的患者均會出現不同程度的神經功能障礙[1]。盡管目前ICH的致病機制的研究已取得了顯著進展,臨床有許多關于ICH藥物治療和手術治療的研究,但到目前為止仍缺乏公認有效的治療措施。ICH誘發的繼發性炎癥損傷造成神經元凋亡,在神經功能缺損中發揮著重要的作用,因此干預ICH神經元的凋亡是治療ICH的重要措施之一。蝦青素(3,3’-二羥基-β,β-胡蘿卜素-4,4’-二酮;AST)在自然界廣泛分布,是主體甲殼類動物的色素,如鮭魚等生物[2]。蝦青素于1987年被美國食品和藥物管理局批準為飼料添加劑,1999年被批準為膳食補充劑[3]。近年來,許多關于蝦青素的體外和體內研究試驗中證明其抗氧化作用,例如對單線態氧的猝滅作用,對超氧化物、過氧化氫和羥基自由基的強烈清除作用以及對脂質的抑制作用過氧化[4,5];除此之外,蝦青素的其他幾種生物活性,包括抗癌、抗炎、抗氧化、抗凋亡、抗糖尿病,免疫調節活性和神經保護作用也已有報道[2]。蝦青素具有廣泛的藥理活性,其中神經保護作用頗受研究人員關注,蝦青素藥動學研究表明,蝦青素可以定位于脂質膜表面或者穿過脂質膜AD[6],同時在嚙齒動物中可以通過血腦屏障,從而對神經系統疾病也有較好的功效。研究發現蝦青素可改善由脂多糖誘發的小鼠腦內神經炎癥反應,顯著抑制大腦中的IL-1α、IL-6和TNF-α的表達[7,8]。蝦青素治療與降低的皮質損傷體積、神經元損失和皮質中的神經變性相關,這可能通過模擬神經營養因子和促進突觸存活而發生。蝦青素對小鼠ICH的神經保護的影響尚未見報道,因此本研究以炎癥和凋亡為切入點,采用小鼠自體尾血定位注射建立尾狀殼核腦出血模型,進一步研究蝦青素對ICH的保護作用的靶點,觀察蝦青素改善ICH小鼠神經炎癥損傷的作用是否與抑制炎癥細胞釋放炎癥因子IL-1β和TNF-α以及凋亡基因Caspase-3的有關,為進一步研究蝦青素在ICH的繼發性的炎性損傷提供藥理依據。
1 材料與方法
1.1 實驗動物 實驗動物為清潔級C57BL/6小鼠,雄性,6~8周齡,16~20 g,由第三軍醫大學實驗動物中心提供,合格證號:SCXK(渝)20120913。飼養于遵義醫學院SPF級實驗動物中心,飼養條件是光照時間7:00-19:00,黑暗時間19:00~7:00,相對空氣濕度45%~55%,溫度22~26 ℃,可自由進食進水。
1.2 主要藥品與試劑 蝦青素(美國Santa Cruz公司);DW-2000腦立體定位儀(成都泰盟公司);IL-1β、TNF-α和Caspase-3 ELISA試劑盒(美國eBioscience公司);NeuN兔抗小鼠和Caspase-3兔抗小鼠單克隆抗體(美國Abcam公司);羊抗兔IgG二抗、TUNEL試劑盒、ELISA試劑盒和Hoeschst染料(美國Invitrogen公司);Neuronal Medium-basal培養基,高糖DMEM和FBS(美國Gibco公司)。
1.3 小鼠腦皮質神經元原代培養 取18 d胎齡的C57小鼠,顯微鏡下剝取胎鼠大腦前皮質,去除腦膜和血管。眼科剪剪碎至約1 mm×1 mm×1 mm,0.125%胰蛋白酶37 ℃孵育10 min,吹打15~20次,2500 r/min離心10 min。棄上清液,用完全培養基含10%胎牛血清、2 μmol/L谷氨酰胺的DMEM高糖培養基重懸細胞沉淀,計數細胞至5×105個/ml,接種于多聚-L-賴氨酸(Poly-L-Lysine)包被的細胞培養板中。置于37 ℃、含5% CO2及飽和濕度的培養箱中培養,24 h后換液至含2% B27、0.4×10-4mol/L阿糖胞苷(Ara-C)和0.5 mM谷氨酰胺Neuronal Medium-basal培養基,以后每隔72 h半量換液,培養至8 d。實驗分組:(1)空白對照組為生理鹽水組;(2)實驗組為2個AST濃度組(10-4和10-5mol/L),加入20 μmol/L Hb至培養液中;(3)實驗對照組為Hb 20 μmol/L Hb處理。
1.4 小鼠ICH模型的制備 C57小鼠用10%水合氯醛(40 mg/kg)腹腔麻醉注射,俯臥固定于小鼠大腦立體定位儀上,頭皮酒精消毒,暴露頂骨,取尾動脈血50 μl,用注射泵(5 μl/min)注射至左腦紋狀體(小鼠前囟右側2.5 mm,向前0.2 mm,向腹側3.5 mm);注射后針頭停留8~10 min,拔出針頭用醫用骨蠟封閉注射孔,縫合頭皮切口。假手術組以同樣的方法注射等量生理鹽水。
1.5 分組與給藥 實驗分組為假手術組、ICH模型組、10 mg/kg和30 mg/kg AST治療組,各6只小鼠。各組做腦出血手術,于2 h、12 h、24 h、48 h連續灌胃給予相應藥物(AST用1 ml/kg橄欖油溶解配制,假手術組和ICH模型組小鼠僅給予連續橄欖油灌胃處理),每天1次。
1.6 腦出血小鼠神經功能缺損評分(NDS) 將24只小鼠隨機分為4組。各組術后連續給藥后,并于給藥后的1 d、3 d、5 d、7 d參照文獻[9]對各處理組小鼠作神經功能缺損程度評分,神經功能評分在2級以上的小鼠視為ICH模型成功,納入實驗研究對象,剔除評分在0級或4級以上的模型小鼠。主要包括行走測試、提尾反射、平衡測試、感覺測試、反射缺失和反常運動。最大得分為18分,輕型傷:1~6分;中型傷:7~12分;重型傷:13~18分。
1.7 ELISA法測定ICH血腫周圍組織中TNF-α、IL-1β和Caspase-3的含量 取假手術組、ICH模型組、AST不同劑量治療組小鼠在ICH在不同時間點腦血腫灶周組織0.5 g,加入預冷的PBS,使制成質量濃度為10%的腦組織勻漿,4 ℃,4000 r/min,離心15 min,置-70 ℃低溫冰箱保存備用。ELISA檢測組織勻漿液中的TNF-α、IL-1β和Caspase-3的表達變化情況。
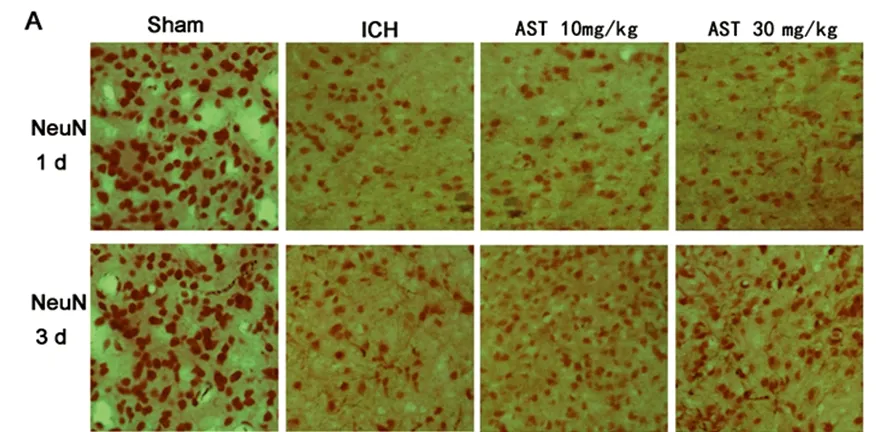
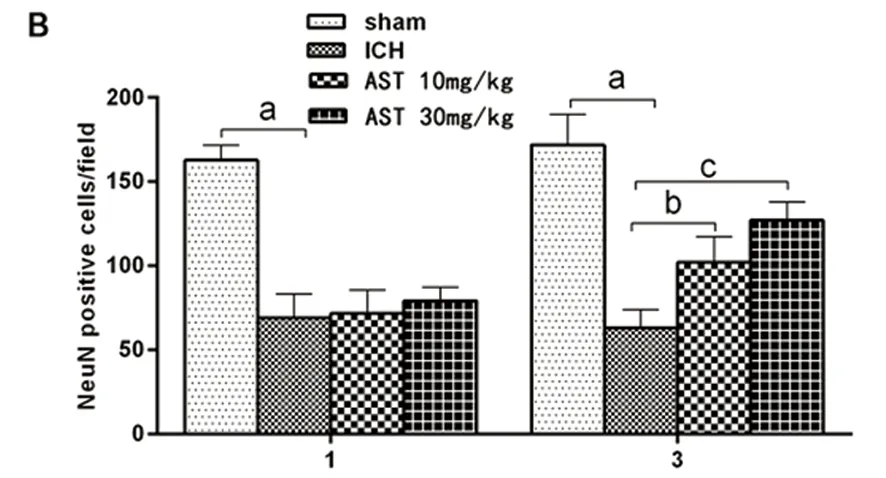
1.8 腦組織病理學檢查 各組分別于1 d、3 d各取3只小鼠,4%多聚甲醛灌流固定后取出腦組織后4 ℃繼續相同的方法固定24 h以上,20%和30%的庶糖梯度脫水,采用冷凍切片的方法,給予腦片冰凍切片漂片法作神經元染色。在光學顯微鏡(10×20)下,隨機選取5個高倍視野,陽性為紅色神經元胞核,計數陽性染色神經元數量。
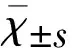
2 結 果
2.1 AST提高了Hb誘導的神經元損傷的存活率 通過神經原代培養實驗考察10-4mol/L和10-5mol/L AST對Hb誘導神經元細胞損傷的保護作用。前期預實驗發現AST對神經元生長無影響,在36 h觀察期內神經元存活率一直穩定在80%;相較于對照組,在光鏡下觀察TUNEL和Caspase-3凋亡實驗發現,模型組(Hb組)神經元在36 h后存活率顯著下降,差異有統計學意義(P<0.01)。同時給予神經元10-4mol/L和10-5mol/L AST后,與模型組(Hb組)比較36 h后AST組神經元存活率得到顯著提高,TUNEL陽性和Caspase-3陽性細胞數量顯著降低,差異有統計學意義(P<0.05),表明AST對Hb誘導原代神經元細胞損傷能顯著提高原代神經元細胞活力,具有明顯神經保護作用(見圖1)。
2.2 AST對腦出血小鼠神經功能缺損評分的影響 神經功能缺損程度評分(NDS)是評估小鼠ICH后損傷程度的重要參考指標模型組的NDS顯著均顯著高于假手術組(P<0.01),ICH模型制備成功;30 mg/kg組在給藥后的1 d、3 d均能明顯改善小鼠的神經功能缺損(P<0.05),而10 mg/kg組只在給藥后3 d能顯著降低腦出血小鼠NDS(P<0.05)(見圖2)。
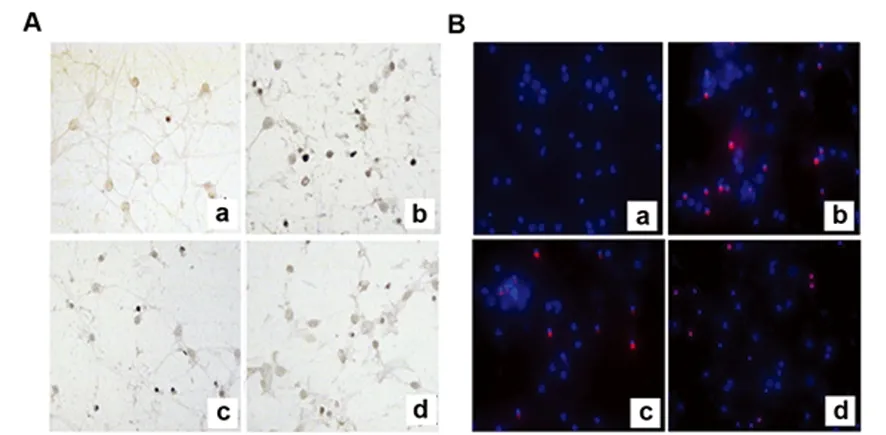
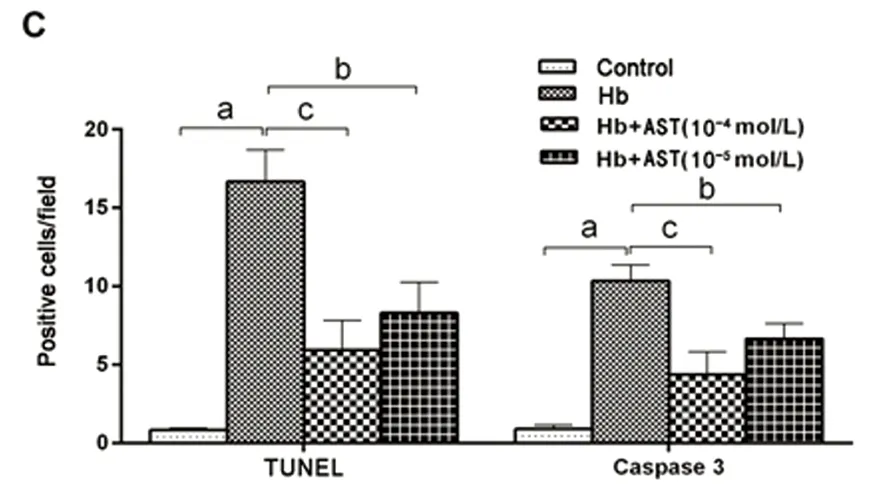
A:TUNEL染色;B:Caspase-3染色;C:不同劑量Ica組TUNEL和Caspase-3陽性細胞數的比較。a-對照組;b-Hb組;c-AST(10-4mol/L)組;d - AST(10-5mol/L)組(n=4)。與對照組比較a:P<0.01;與Hb組比較b:P<0.05,c:P<0.01
圖1 AST對Hb誘導損傷神經元保護作用(×200)
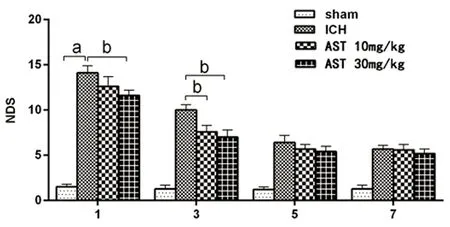
與假手術組組比較a:P<0.01;與ICH模型組比較b:P<0.05圖2 各組不同時間腦出血小鼠神經功能評分比較
2.3 AST對ICH小鼠血腫灶周圍組織中TNF-α、IL-1β和Caspase-3表達的影響 ELISA法檢測小鼠ICH后血腫周圍組織的TNF-α、IL-1β和Caspase-3的蛋白表達變化。假手術組和ICH模型組結果見圖3,由圖3可以看出,TNF-α、IL-1β和Caspase-3在小鼠ICH血腫周圍組織的蛋白表達水平顯著增高(P<0.01),并且在3 d達到最大值。與ICH組比較,30 mg/kg的AST在出血后的1 d、3 d能顯著抑制TNF-α、IL-1β和Caspase-3的表達水平(P<0.05或P<0.01),在出血后的5 d能顯著抑制Caspase-3的表達水平(P<0.01);10 mg/kg在出血后的1 d能顯著抑制TNF-α、IL-1β和Caspase-3的表達水平(P<0.05),在出血后的3 d能顯著抑制TNF-α和Caspase-3的表達水平(P<0.05或P<0.01),在出血后的5 d能顯著抑制IL-1β的表達水平(P<0.05)(見圖3)。
2.4 腦組織病理學改變 假手術組小鼠腦組織各腦區結構完整,神經細胞形態正常,手術后各時間段均未見神經細胞凋亡和炎性細胞浸潤;造模后3 d,與AST組比較,ICH模型組出血灶周圍神經元胞體大小不一、形態各異。與ICH模型組,AST治療組神經元數量在腦出血后各時間點的計數皆顯著增加,差異有統計學意義(P<0.01);造模后3 d時,AST治療組神經元數量明顯多于模型組,差異有統計學意義(P<0.01)(見圖4)。
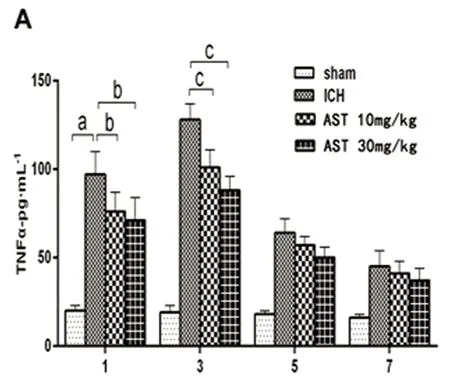
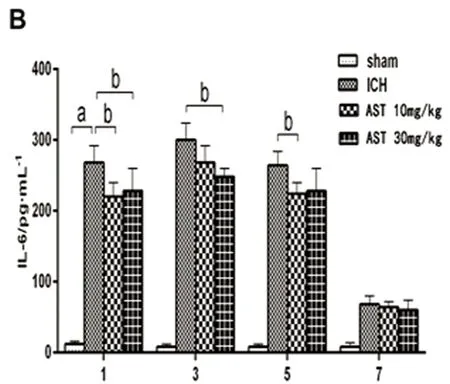
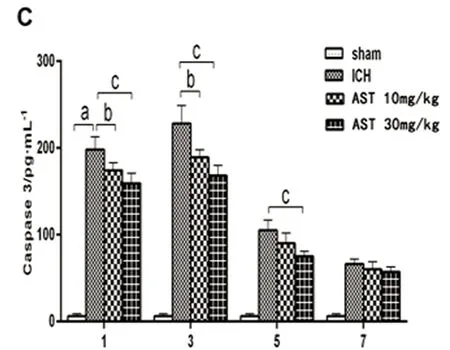
A:TNF-α;B:IL-1β;C:Caspase-3。與假手術組比較a:P<0.01;與ICH模型組比較b:P<0.05,c:P<0.01
3 討 論
血腫灶周圍過度的炎癥反應是ICH后繼發性損傷最重要致病機制之一,其主要表現是血腫灶周小膠質細胞的大量活化和釋放多種炎性因子(如TNF-α、IL-1β、IL-6和TGF-β等)進而加加劇了神經元炎性損傷[10]。Caspase-3是細胞凋亡過程中的最主要效應蛋白,其在ICH的神經變性凋亡的致病過程中起著非常重要的作用。研究發現,蝦青素對多種中樞系統疾病(腦梗死、脊髓損傷、腦創傷、蛛網膜下腔出血和帕金森病)的疾病動物模型中均有顯著的改善作用[11~15]。其作用機制有抗炎抗氧化應激,促進海馬神經發生和可塑性,調節小膠質細胞活性等[16]。蝦青素能抑制LPS誘導的ICR小鼠海馬腦區的TNF-α、IL-1β及環氧化酶等炎癥因子的蛋白表達,改善其學習記憶和空間認知能力[17]。蝦青素是否能抑制ICH后繼發性腦炎癥損傷,目前尚未見文獻報道。TNF-α和IL-1β在ICH血腫灶周圍的神經元的變性凋亡中起著重要的作用。TNF-α是ICH后升高得最快的炎性因子,可引起IL-1β,IL-6的級聯反應[18]。TNF-α可誘導IL-1β大量表達,后者可通過NF-κB細胞信號傳導途徑激活血腫灶區的小膠質細胞活化并分泌大量的炎癥因子,加劇了局部腦組織炎性損害[18]。TNF-α還能夠激活基質金屬蛋白酶-9細胞信號傳導通路,增加腦出血后血腦屏障的通透性,加劇了組織水腫,導致灶周神經元大量變性凋亡[19]。IL-1β誘導腦血管內皮細胞間粘附分子等活化,引起血腫周圍組織的炎性細胞浸潤。另外,IL-1β還可以下調Bcl-2和p-Ak等通路蛋白的表達,并上調bax蛋白,進而活化Caspase-3凋亡因子,誘導神經元細胞變性和凋亡。同時,IL-6還可以激活鈣通道造成細胞內鈣超載,造成神經細胞的變性凋亡[20]。
課題組前期的預實驗中對AST的給藥濃度做了綜合的研究,結果提示10-4mol/L的AST濃度過高,原代大腦皮質神經元出現變性凋亡。10-8~10-5mol/L均未造成皮質原代神經元的變性凋亡,起到了較好的神經元保護的作用。體外研究表明,AST能顯著提高Hb誘導損傷的原代大腦皮質神經元細胞存活率。體內實驗結果提示,給予AST連續灌胃治療小鼠ICH后,AST能明顯改善ICH小鼠的神經功能缺損程度的評分,小鼠腦出血血腫周圍組織炎癥因子TNF-α和IL-1β的表達也明顯低于模型組,提示AST通過抑制炎癥因子的表達改善ICH小鼠的血腫周圍炎癥反應。另外,ICH小鼠血腫周圍組織Caspase-3凋亡蛋白表達顯著高于假手術對照組,證實了Caspase-3在參與了ICH的神經元變性凋亡的過程,而ICH小鼠在給予不同劑量的AST治療后,Caspase-3凋亡蛋白的表達顯著降低,提示AST對ICH的保護作用也可通過抗神經元細胞的凋亡作用有關。
綜上所述,本課題實驗結果與上述文獻報道相符,AST的作用機制可能與其保護受損神經元,減輕小鼠腦出血的炎癥因子、凋亡因子和氧化應激反應有關,為AST臨床用于ICH的防治提供了基礎藥理學依據。
[參考文獻]
[1]Ariesen MJ,Claus SP,Rinkel GJ,et al. Risk factors for intracerebral hemorrhage in the general population:a systematic review[J]. Stroke,2003,34:2060-2065.
[2]Hussein G,Sankawa U,Goto H,et al. Astaxanthin,a carotenoid with potential in human health and nutrition[J]. J Nat Prod,2006,69:443-449.
[3]Guerin M,Huntley ME,Olaizola M. Haematococcus astaxanthin:applications for human health and nutrition[J]. Trends in Biotechnology,2000,21:210-216.
[4]Matsuno T,Miki W. Biological functions and activities of carotenoids[J]. Pure & Applied Chemistry,1991,63:141-146.
[5]Palozza P,Krinsky NI. Astaxanthin and canthaxanthin are potent antioxidants in a membrane model[J]. Archives of Biochemistry & Biophysics,1992,297:291-295.
[6]Goto S,Kogure K,Abe K,et al. Efficient radical trapping at the surface and inside the phospholipid membrane is responsible for highly potent antiperoxidative activity of the carotenoid astaxanthin[J]. Biochimica et Biophysica Acta(BBA)-Biomembranes,2001,1512:251-258.
[7]Nguyen KT,Deak T,Owens SM,et al. Exposure to acute stress induces brain interleukin-1beta protein in the rat[J]. Journal of Neuroscience the Official Journal of the Society for Neuroscience,1998,18:2239.
[8]Rothwell NJ,Luheshi GN. Interleukin 1 in the brain:biology,pathology and therapeutic target[J]. Trends in Neurosciences,2000,23:618-625.
[9]Longa EZ,Weinstein PR,Carlson S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20:84.
[10]Zhang Z,Ze Z,Lu H,et al. Microglial Polarization and Inflammatory Mediators After Intracerebral Hemorrhage[J]. Molecular Neurobiology,2017,54:1874-1886.
[11]Shen H,Kuo CC,Chou J,et al. Astaxanthin reduces ischemic brain injury in adult rats[J]. Faseb J,2009,23:1958-1968.
[12]Masoudi A,Dargahi L,Abbaszadeh F,et al. Neuroprotective effects of astaxanthin in a rat model of spinal cord injury[J]. Behav Brain Res,2017,329:104-110.
[13]Ji X,Peng D,Zhang Y,et al. Astaxanthin improves cognitive performance in mice following mild traumatic brain injury[J]. Brain Res,2017,1659:88-95.
[14]Wu W,Wang X,Xiang Q,et al. Astaxanthin alleviates brain aging in rats by attenuating oxidative stress and increasing BDNF levels[J]. Food Funct,2014,5:158-166.
[15]Grimmig B,Morganti J,Nash K,et al. Immunomodulators as Therapeutic Agents in Mitigating the Progression of Parkinsons Disease[J]. Brain Sci,2016,6(4):41.
[16]Grimmig B,Kim SH,Nash K,et al. Neuroprotective mechanisms of astaxanthin:a potential therapeutic role in preserving cognitive function in age and neurodegeneration[J]. Geroscience,2017,39:19-32.
[17]Jiang X,Chen L,Shen L,et al. Trans-astaxanthin attenuates lipopolysaccharide-induced neuroinflammation and depressive-like behavior in mice[J]. Brain Res,2016,1649:30-37.
[18]Clark IA,Alleva LM,Vissel B. The roles of TNF in brain dysfunction and disease[J]. Pharmacology & therapeutics,2010,128 (3):519-548
[19]Hein AM,Stasko MR,Matousek SB,et al. Sustained hippocampal IL-1β overexpression impairs contextual and spatial memory in transgenic mice[J]. Brain Behavior & Immunity,2010,24(2):243-253.
[20]Ji C,Chen G. Signaling Pathway in Early Brain Injury after Subarachnoid Hemorrhage:News Update[J]. Acta Neurochir Suppl,2016,121:123-126.

