利拉魯肽對腦缺血再灌注損傷大鼠腦自由基代謝及血管內皮生長因子表達的影響
李 強,方 濤,劉 勇,董銀華,崔曉旭,田鳳石
胰高血糖素樣肽-1(GLP-1)是一種主要由分布于結腸和直腸L細胞分泌的含30個氨基酸的多肽類物質[1],它通過與胰高血糖素樣-1受體(GLP-1R)結合而發揮作用,利拉魯肽是其類似物,目前國內外學者對利拉魯肽在阿爾茨海默病、帕金森病、腦卒中等疾病方面做過研究,多項研究表明利拉魯肽不僅具有降糖作用,還可通過血腦屏障[2,3],可能通過抑制炎癥反應、氧化應激和細胞凋亡[4]等機制發揮神經保護作用。本實驗建立腦缺血再灌注模型,觀察利拉魯肽對腦缺血再灌注損傷后大鼠腦組織腦自由基代謝及VEGF的影響。
1 材料與方法
1.1 材料 健康雄性SD大鼠60只,雌雄不分,體質量200~250 g,由中國人民解放軍軍事醫學科學院實驗動物中心提供。許可證號 SCXK-(軍);利拉魯肽(由丹麥諾和諾德公司提供,批號:國藥準字J20110026);隨機分為假手術組(A組)、腦缺血再灌注(B組)組和利拉魯肽小劑量組(C組、80 μg/kg)、利拉魯肽中劑量組(D組、120 μg/kg)、利拉魯肽大劑量組(E組、160 μg/kg),每組12只。
1.2 方法
1.2.1 CIR大鼠模型制作 SD大鼠隨機分為假手術組、腦缺血再灌注組、利拉魯肽干預小、中、大劑量組,每組12只。采用Longa線栓法制作動物模型。術前禁食12 h,釆用 10%的水合氯醛(400 mg/kg)進行腹腔注射達到深度麻醉后,沿頸正中切開皮膚,分離并暴露右側頸總動脈及頸內、 頸外動脈,分別用尼龍線在右側頸總動脈近心端,頸外動脈分叉處予以結扎,靠近頸總動脈分叉處繞線暫不結扎死。用眼科剪在結扎線遠端剪一小口,將尼龍線插入頸內動脈達大腦中動脈,栓線的血管外部分結扎固定。假手術組結扎動脈但不插入栓線,余操作同腦缺血再灌注組。2 h后回抽線栓恢復灌注。利拉魯肽組于再灌注前30 min,按體質量給予腹腔注射。假手術組及腦缺血再灌注組予以同等體積的生理鹽水腹腔注射。
1.2.2 神經功能障礙測定 參照Longa等[5]評分標準對所有大鼠進行神經功能評分:0分:正常,無神經損傷癥狀,活動正常;1分:神經功能損害輕度,不能完全伸展前爪;2分:神經功能損害中度,向一側轉圈;3分:神經功能損害重度,行走時向對側傾倒;4分:大鼠不能自發行走,肢體意識喪失或無自發活動。
1.2.3 腦梗死體積檢測 采用TTC 染色進行檢測;各組分別于再灌注24 h后,處死大鼠后斷頭取腦,置-20℃冰箱15 min,沿冠狀面將其切成5 mm厚切片,將腦片置2%TTC溶液,置于 37 ℃恒溫箱中染色20 min,置4%(質量濃度)多聚甲醛中固定。利用圖像分析軟件Scion Image檢測各腦切片梗死面積,腦梗死體積=腦梗死面積×厚度/2。
1.2.4 MDA、SOD 的測定 各組分別于再灌注24 h后,深度麻醉大鼠,脫臼法處死大鼠后立即斷頭取腦,分析天平稱重,按1∶9 (W/V) 加入生理鹽水制成10%腦組織勻漿,玻璃勻漿器勻漿,2000 r/min,離心10 min,取上清液。保存于-20 ℃冰箱中待測,分別采用黃嘌呤氧化法、硫代巴比妥酸顯色法測定,均嚴格按照試劑盒說明要求操作。
1.2.5 Western blot檢測VEGF濃度 腦組織組織標本加人蛋白裂解液后,采用BCA法進行蛋白定量,蛋白變性后行SDS-PAGE電泳、 轉膜封閉,分別加入兔抗大鼠VEGF (1∶1000) 抗體,4 ℃ 孵育過夜。充分洗滌膜后用辣根過氧化物酶耦聯的IgG作為二抗,增強化學發光法顯色,結果采用Image軟件分析。
1.2.6 實時熒光定量 PCR(Real-time PCR,qPCR)檢測VEGF 腦組織RNA提取、反轉錄、PCR擴增等步驟;VEGF引物序列:上游5’-CAG ATC ATG CGG ATC AAA CC-3’,下游5’-TTT CTG GCT TTG TTC TAT CTT TC-3’;反應條件為94 ℃ 15 s;94 ℃ 20 s、55 ℃ 10 s、72 ℃ 10 s,40次循環;72 ℃ 10 min。采用2-△△CT法進行相對定量分析。
2 結 果
2.1 各組神經功能缺損評分及腦梗死體積比較 假手術組未見腦梗死,神經功能缺損評分 0分;腦缺血再灌注組和干預組再灌注24 h可見腦組織腫脹及梗死灶;與腦缺血再灌注組比較,干預組神經功能缺損評分明顯降低,差異有統計學意義(P<0.05);干預組腦梗死體積較腦缺血再灌注組明顯減小,差異有統計學意義(P<0.05);而利拉魯肽各劑量組比較差異有統計學意義(P<0.05,見表1),與劑量呈正相關性。
2.2 各組大鼠腦組織MDA、SOD 表達變化比較 與假手術組比較,腦缺血再灌注組大鼠腦組織中MDA含量顯著增高,SOD活性顯著降低(P<0.05);與腦缺血再灌注組比較,干預組腦組織中MDA含量均顯著降低(P<0.05),SOD活性顯著增加(P<0.05),且與劑量呈正相關性(見表2)。
2.3 各組大鼠腦組織VEGF蛋白表達變化 Western blot結果可見,假手術組VEGF蛋白表達較少;與假手術組相比,腦缺血再灌注組大鼠VEGF表達增加(P<0.05)。利拉魯肽干預組大鼠分別與腦缺血再灌注組比較,VEGF蛋白表達顯著增加(P<0.05),而利拉魯肽各劑量組比較差異有統計學意義(P<0.05,見表2,圖1)。
2.4 實時熒光定量PCR檢測VEGF mRNA表達情況 腦缺血再灌注組大鼠VEGF mRNA陽性表達水平明顯高于假手術組(P<0.05)。利拉魯肽干預組大鼠分別與腦缺血再灌注組比較,VEGF mRNA表達水平明顯增加(P<0.05),而利拉魯肽各劑量組比較差異有統計學意義(P<0.05)(見表2)。
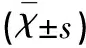
表1 腦梗死體積變化及神經功能評分
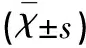
表2 各組大鼠SOD、MDA、VEGF蛋白表達、VEGF mRNA表達水平

A:假手術組;B:腦缺血再灌注;C:利拉魯肽小劑量組;D:利拉魯肽中劑量組;E:利拉魯肽大劑量組
圖1 各組大鼠腦組織VEGF蛋白表達變化
3 討 論
腦缺血再灌注損傷是由于治療或者機體自身的代償機制實現缺血區域的再灌注,可導致組織器官的進一步損傷,腦缺血再灌注損傷的機制十分復雜,包括能量代謝障礙、氧化應激損傷、炎癥反應、興奮性毒性、細胞調亡等。氧化應激反應[6]是造成全腦缺血再灌注損傷的重要機制之一。生理狀態下,機體內氧化和抗氧化功能處于動態平衡。腦缺血再灌注時機體氧化功能和抗氧化功能失衡,導致大量氧自由基釋放,引起腦損傷[7]。其中 MDA是脂質過氧化產物以及氧化損傷的標志物,其含量可直接反映機體脂質過氧化反應的強弱并間接反映細胞損傷程度[8];SOD作為內源性自由基清除劑的重要代表,能清除機體的氧自由基[9],修復受損細胞,間接反映機體抗氧化能力。而促進損傷區域局部血管再生,建立良好的側支循環是腦缺血再灌注后重要的代償機制[10],VEGF是體內誘導血管新生的重要生長因子,被視為血管再生的標志性指標[11],是神經系統中內皮細胞有絲分裂原,主要通過選擇性作用于內皮細胞膜上的VEGF受體,促使內皮細胞分泌相關的膠原酶和組織因子等[12],同時改變內皮細胞的相關基因表達,從而改變內皮細胞的細胞外基質,促進神經元、神經膠質細胞生長和存活[13~15]。
利拉魯肽是腦內具有神經保護作用的一種生長因子,在中樞神經系統,GLP-1受體表達于小腦、下丘腦、海馬及神經細胞中,可通過促進神經發生、促進神經元修復和新記憶形成、降低腦內淀粉樣蛋白合成以及調節突觸可塑性,通過維持腦內 Ca2+穩態、抑制細胞凋亡、減少炎癥反應以及保護神經元免受氧化應激損傷等發揮神經保護作用[16]。Sato等[17]研究表明利拉魯肽可以通過抗氧化應激和上調血管內皮生長因子VEGF對腦卒中發揮神經保護效應。糖尿病和非糖尿病大鼠腦缺血前腹腔注射利拉魯肽,可使梗死體積顯著縮小,并抑制細胞凋亡和氧化應激反應[18]。
實驗研究結果顯示大鼠腦缺血再灌注,MDA和VEGF含量增加,SOD含量減少,給予利拉魯肽干預后SOD和VEGF含量增加,提示利拉魯肽可改善腦缺血再灌注損傷大鼠神經功能障礙,抑制黃嘌呤氧化酶和次黃嘌呤氧化酶的活性,上調VEGF表達促進血管再生,為進一步研究腦缺血再灌注的腦保護機制,提供了新思路。
[參考文獻]
[1]Lovshin JA,Drucker DJ. Incretin-based therapies for type 2 diabetes mellitus[J]. Nat Rev Endocrinol,2009,5(5):262-269.
[2]McClean PL,Parthsarathy V,Faivre E,et al. The diabetes drug liraglutide prevens degenerative processes in a mouse model of Alzheimer’s disease[J]. J Neurosci,2011,31(17):6587-6594.
[3]Hunter K,H?lscher C. Drugs developed to treat diabetes,liraglutide and lixisenatide,cross the blood brain barrier and enhance neurogenesis[J]. BMc Neurosci,2012,13:33.
[4]Briyal S,Shah S,Gulati A. Neuroprotective and anti-apoptotic effects of liraglutide in the rat brain following focal cerebral ischemia[J]. Neuroscience,2014,12(5):269-281.
[5]Longa EZ,Weinstein PR,Carlson S,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[6]Abd-Elsameea AA,Moustaf AA,Mohamed AM. Modulation of the oxidative stress by metformin in the cerebrum of rats exposed to global cerebral isehemia and ischemia/reperfusion[J]. Eur Rev Med Pharmacol Sei,2014,18(16):2387-2392.
[7]Mansoorali KP,Prakash T,Kotresha D,et al. Cerebroprotective effect of Eclipta alba against global model of cerebral ischemia induced oxidative stress in rats[J]. Phytomedieine,2012,19(12):1108-1116.
[8]Rudnicki M,Silveira MM,Pereira TV,et al. Protective effects of Passiflora alata extract pretreatment on carbon tetrachlofide induced oxidative damage in rats[J]. Food Chem Toxicol,2007,45(4):656-661.
[9]Singh PP,Chandra A,Mahdi F,et al. Reeoncene and reeonnect the antioxidant hypothesis in human health and disease[J]. Indian J Clin Biochem,2010,25(3):225-243.
[10]Oshikawa J,Urao N,Kim HW,et al. Extracellular SOD-derived H2o2 promotes VEGF signaling in caveolae /lipid rafts and post-ischemic angiogenesis in mice[J]. Plos one,2010,5(4):e10189.
[11]anredi N,Talwar P,Sandeep K. VEGF antagonist for the prevention of ovarian hyperstimulation syndrome:current status[J]. Med J Armed Forces India,2014,70(1):58-63.
[12]Lapi D,Vagnani S,Sapio D,et al. Effects of bone marrow mesenchymal stem cells (BM-MSCs) on rat pial microvascular remodeling after transient middle cerebral artery occlusion[J]. Front Cell Neurosci,2015,25(9):329.
[13]Guo H,Zhou H,Lu J,et al. Vascular endothelial growth factor:an attractive target in the treatment of hypoxic/ischemic brain injury[J]. Neural Regen Res,2016,2(1):174-179.
[14]Choi M,Lee SH,Chang HL,et al. Hippocampal VEGF is necessary for antidepressant-like behaviors but not sufficient for antidepressant-like effects of ketamine in rats[J]. Biochim Biophys Acta,2016,1862(7):1247-1254.
[15]Xu AL,Zheng GY,Wang ZJ,et al. Neuroprotective effects of Ilexonin A following transient focal cerebral ischemia in rats[J]. Mol Med Rep,2016,13(4):2957-2966.
[16]Sharma MK,Jalewa J,Holscher C. Neuroprotective and anti-apoptotic effects of liraglutide on SH-SY5Y cells exposed to methylglyoxal stress[J]. J Neurochem,2014,128:459-471.
[17] Sato K,Kameda M,Yasuhara T,et al. Neuroprotective effects of liraglutide for stroke model of rats[J]. Int J Mol Sci,2013,14(11):21513-21524.
[18]Briyal S,Shah S,Gulati A. Neuroprotective and anti-apoptotic effects of liraglutide in the rat brain follow ing focal cerebral ischemia[J]. Neuroscience,2014,281:269-281.

