肝癌大鼠肝臟組織Smurf1表達變化及意義
王敏娟,李貝,李莉,謝萍,張川,展玉濤(首都醫科大學附屬北京同仁醫院,北京0003;首都醫科大學)
肝細胞癌(簡稱肝癌)發病原因十分復雜,多種蛋白質的轉錄后修飾在肝癌的發病過程中具有重要意義[1]。蛋白質的轉錄后修飾主要包括泛素化、磷酸化和乙酰化[2~4]。泛素化是肝癌發病一些關鍵蛋白的重要轉錄后修飾,蛋白質的泛素化由泛素激活酶(E1)、泛素結合酶(E2)和泛素蛋白連接酶(E3)共同參與完成[3],其中E3決定泛素底物的特異性[5,6],主要包括RING類和HECT類兩大家族[7]。泛素連接酶Smad泛素化相關因子1(Smurf1)屬于HECT類E3[8,9],目前關于Smurf1在肝癌發生中的作用研究較少。為此,我們于2017年2~7月進行了如下研究。
1 材料與方法
1.1 材料 動物:SPF級雄性Wistar大鼠35只,4周齡,體質量(120±10)g,均購自首都醫科大學實驗動物部。主要試劑:抗Smurf1抗體購自美國Abcam公司,抗β-actin抗體和相關二抗均購自北京中衫金橋生物技術有限公司,二乙基亞硝胺(DEN,純度>99%)購自美國Sigma公司,10%多聚甲醛購自谷歌生物科技有限公司。
1.2 動物分組與肝癌模型建立 將35只Wistar雄性大鼠隨機分為模型組25只和對照組10只,所有大鼠在SPF級動物房中常規飼料喂養。模型組按照體質量給予0.2 mL/100 g DEN溶液(0.25 mL DEN+10 mL生理鹽水)腹腔注射,2次/周;對照組按照體質量給予0.2 mL/100 g生理鹽水腹腔注射,2次/周。連續注射15周。
1.3 相關指標觀察
1.3.1 肝臟質量/體質量與肝臟大體情況 兩組連續注射15周,稱取體質量。10%水合氯醛麻醉后開腹,取肝組織,觀察其大體情況;稱取肝臟質量,計算肝臟質量/體質量。將一部分肝臟組織用10%多聚甲醛固定24 h,常規進行修塊、脫水、二甲苯透明、石蠟浸泡、石蠟包埋及切片,剩余肝臟組織保存于液氮中。
1.3.2 肝臟組織病理情況 采用HE染色。取1.3.1中制備的肝臟組織切片,依次進行烤片、脫蠟、蘇木素-伊紅染色、二甲苯透明及中性樹脂封片。于40倍光學顯微鏡下觀察組織病理情況。
1.3.3 肝臟組織Smurf1表達 ①采用免疫組化法。取1.3.1中制備的肝臟組織切片,經過烤片、切片復水、PBS沖洗3次;加入3% H2O2封閉過氧化物,置于濕盒壁光保存15 min、PBS沖洗3 min×3次,抗原修復后PBS沖洗3 min×3次;以羊血清封閉,加入Smurf1抗體,4 ℃孵育過夜、PBS沖洗3 min×3次;加入Smurf1二抗,37 ℃放置30 min,PBS沖洗3 min×3次。二氨基聯苯胺顯色混勻,顯色2 min后鏡下觀察,蒸餾水沖洗5 min×2次,蘇木素染核,梯度乙醇脫水,二甲苯透明,中性樹脂封片。于40倍光學顯微鏡下觀察并拍照,以肝細胞質內染色呈棕黃色定義為陽性染色。采用IPP軟件分析兩組肝臟組織染色的光密度值,取平均值,以此表示肝臟組織Smurf1陽性表達情況。②采用Western blotting法。取1.3.1中液氮保存的肝臟組織30 mg,置于EP管中;加入300 μL RIPA組織裂解液,組織勻漿儀勻漿,13 000 r/min離心10 min;取100 μL上清加入同體積2×上樣緩沖液(Loading buffer),100 ℃水浴鍋煮15 min,3 000 r/min離心5 min。按照4 μL/孔上樣,SDS-PAGE電泳分離后,轉至硝酸纖維素膜,5%脫脂奶粉封閉1 h,加入抗Smurf1和β-actin抗體(稀釋比例分別為1∶500、1∶1 000),4 ℃孵育過夜。0.1% PBST洗膜后加入二抗,室溫孵育1 h,PBST洗膜,加增強型化學發光劑于暗室壓片。采用GraphPad Prism6.0統計軟件分析條帶灰度值,以目的條帶灰度值與內參β-actin條帶灰度值的比值計算Smurf1相對表達量。
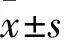
2 結果
連續用藥15周,模型組15只死亡,對照組無死亡。
2.1 兩組體質量、肝臟質量及肝臟質量/體質量比較 模型組體質量及肝臟質量/體質量低于對照組,肝臟質量高于對照組(P均<0.01)。見表1。
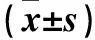
表1 兩組體質量、肝臟質量及肝臟質量/體質量比較
注:與對照組比較,*P<0.01。
2.2 肝臟大體情況 模型組肝臟顏色為棕黃色,肝臟體積明顯增大,被膜下可見大量粟粒樣結節,質地變硬,肝緣變鈍。對照組肝臟顏色為棕紅色,被膜光滑,質地柔軟。
2.3 肝臟組織病理情況 模型組肝臟細胞排列成小梁狀,間質由襯覆單層內皮細胞的血竇樣腔隙組成,細胞核大小不一,核膜增厚,可見核仁,核質比增高。對照組肝組織以中央靜脈為中心呈放射狀排列,肝索排列規整。
2.4 兩組肝臟組織Smurf1表達比較 免疫組化結果顯示,模型組與對照組肝臟組織Smurf1光密度值分別為0.405 5±0.001 7、0.287 6±0.002 4,兩組比較P<0.01。Western blotting結果顯示,模型組與對照組肝臟組織Smurf1蛋白相對表達量分別為7 472±554、1 853±499,兩組比較P<0.01。
3 討論
肝癌動物模型是研究肝癌發病機制與防治手段的重要方法。目前,建立肝癌動物模型的方法主要包括誘發性肝癌動物模型、自發性肝癌動物模型、移植性肝癌動物模型和轉基因動物肝癌模型,其中以化學藥物誘發的動物模型較為常用,常用于誘發動物肝癌模型的化學藥物有DEN、四氯化碳(CCl4)及黃曲霉素(AFB)等。DEN誘發大鼠肝癌所產生的毒性反應和肝臟損傷程度與人體肝癌的發病過程相似,是一種公認的誘導肝癌藥物。研究表明,50 mg/kg的DEN既能提高大鼠成癌率,又能明顯縮短成癌時間[10~12]。腹腔注射方法簡單,成功率高。在動物選擇方面,Wistar大鼠比小鼠個體差異小、敏感性高,成癌效果更穩定,且雄性大鼠較雌性大鼠更易誘發肝癌,有研究表明Wistar雄性大鼠是目前實驗研究肝癌的最常用動物模型[13]。本研究以雄性Wistar大鼠為研究對象,采用腹腔注射0.2 mL/100 g(相當于人體50 mg/kg)DEN溶液的方法建立大鼠肝癌模型。結果表明模型組肝臟呈棕黃色,肝臟體積增大,質地變硬,被膜下可見大量結節,肝細胞排列紊亂,細胞核大小不一,核質比增高,核膜增厚;而對照組肝臟呈棕紅色,質地柔軟,肝緣銳利,肝細胞質均質紅染,肝條索排列規整。以上均證明成功建立大鼠肝癌模型。
Smurf1是HECT類E3的典型代表,最早被發現是Smad1/5的泛素調節因子[14,15],后來發現其能降解 Smad1、Smad5、Runt相關轉錄因子2(Runx2)和有絲分裂原活化蛋白激酶2(MEKK2)等成骨細胞活性相關轉錄因子和信號轉導蛋白,從而負性調控骨形成[16~18]。Smurf1通過調控腫瘤細胞的多種信號途徑和關鍵蛋白等參與腫瘤的發生與發展。研究發現,Smurf1可能通過降解小G蛋白RhoA[14,19,20]和Wnt信號蛋白[21,22]而調控腫瘤細胞的遷移。Smurf1通過促進腫瘤壞死因子受體相關因子4(TRAF4)的泛素化降解,促進乳腺癌細胞的轉移[19,23]。Smurf1能負調控doc2/DAB2互動蛋白(DAB2IP),從而促進胃癌細胞的生長和轉移[24]。本研究免疫組化和Western blotting結果均顯示,模型組肝臟組織Smurf1蛋白表達明顯高于對照組。說明Smurf1在肝癌大鼠肝臟組織中的表達升高,Smurf1可能參與了肝癌的發病過程,但其具體調控機制有待進一步研究。
參考文獻:
[1] Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015,136(5):E359-E386.
[2] Gramantieri L, Fornari F, Callegari E, et al. MicroRNA involvement in hepatocellular carcinoma[J]. J Cell Mol Med, 2008,12(6):2189-2204.
[3] Yin J, Zhu JM, Shen XZ. The role and therapeutic implications of RING-finger E3 ubiquitin ligases in hepatocellular carcinoma[J]. Int J Cancer, 2015,136(2):249-257.
[4] Tang X, Chen X, Xu Y, et al. CD166 positively regulates MCAM via inhibition to ubiquitin E3 ligases Smurf1 and TrCPthrough PI3K/AKT and c-Raf/MEK/ERK signaling in Bel-7402 hepatocellular carcinomacells[J]. Cell Signal, 2015,27(9):1694-1702.
[5] Bielskiene K, Bagdoniene L, Mozūraitiene J, et al. E3 ubiquitin ligases as drug targets and prognostic biomarkers in melanoma[J]. Medicina, 2015,51(1):1-9.
[6] Zou X, Levycohen G, Blank M. Molecular functions of NEDD4 E3 ubiquitin ligases in cancer[J]. Biochim Biophysica Acta, 2015,1856(1):91-106.
[7] Nuber U, Schwarz SE, Scheffner M. The ubiquitin-protein ligase E6-associated protein (E6-AP) serves as its own substrate[J]. Eur J Biochem, 1998,254(3):643.
[8] Bruce MC, Kanelis V, Fouladkou F, et al. Regulation of Nedd4-2 self-ubiquitination and stability by a PY motif located within its HECT-domain[J]. Biochem J, 2008,415(1):155.
[9] Wiesner S, Ogunjimi AA, Wang HR, et al. Autoinhibition of the HECT-type ubiquitin ligase Smurf2 through its C2 domain[J]. Cell, 2007,130(4):651-662.
[10] Bardchapeau EA, Li S, Ding J, et al. PTPN11/Shp2 acts as a tumor suppressor in hepatocellular carcinogenesis[J]. Cancer Cell, 2011,19(5):629.
[11] Fuchs BC, Hoshida Y, Fujii T, et al. Epidermal growth factor receptor inhibition attenuates liver fibrosis and development of hepatocellular carcinoma[J]. Hepatology, 2014,59(4):1577.
[12] Nejak-Bowen KN, Thompson MD, Singh S, et al. Accelerated liver regeneration and hepatocarcinogenesis in mice overexpressing serine-45 mutant beta-catenin[J]. Hepatology, 2010,51(5):1603-1613.
[13] Lund BM, Gehl J, Pedersen BK, et al. Voluntary wheel running reduces the acute inflammatory response to liver carcinogen in a sex-specific manner[J]. Cancer Prevention Res, 2017,10(12):719-728.
[14] Zhu H, Kavsak P, Abdollah S, et al. A SMAD ubiquitin ligase targets the BMP pathway and affects embryonic pattern formation[J]. Nature, 1999,400(6745):687-693.
[15] Ying SX, Hussain ZJ, Zhang YE. Smurf1 facilitates myogenic differentiation and antagonizes the bone morphogenetic protein-2-induced osteoblast conversion by targeting Smad5 for degradation[J]. J Biol Chem, 2003,278(40):39029-39036.
[16] Zhao M, Qiao M, Oyajobi BO, et al. E3 Ubiquitin ligase smurf1 mediates Core-binding Factor α1/Runx2 degradation and plays a specific role in osteoblast differentiation[J]. J Biol Chem, 2003,278(30):27939-27944.
[17] Kaneki H, Guo R, Chen D, et al. Tumor necrosis factor promotes Runx2 degradation through up-regulation of Smurf1 and Smurf2 in osteoblasts[J]. J Biol Chem, 2006,281(7):4326-4333.
[18] Zhang GM. Ubiquitin ligase Smurf1 controls osteoblast activity and bone homeostasis by targeting MEKK2 for degradation[J]. Cell, 2005,121(1):101-113.
[19] Sahai E, Garcia-Medina R, Pouysségur J, et al. Smurf1 regulates tumor cell plasticity and motility through degradation of rhoa leading to localized inhibition of contractility[J]. J Cell Biol, 2007,176(1):35-42.
[20] Fukunaga E, Inoue Y, Komiya S, et al. Smurf2 induces ubiquitin-dependent degradation of smurf1 to prevent migration of breast cancer cells[J]. J Biol Chem, 2008,283(51):35660.
[21] Narimatsu, Masahiro, Bose, et al. Regulation of planar cell polarity by Smurf ubiquitin ligases[J]. Cell, 2009,137(2):295-307.
[22] Wang HR, Zhang Y, Ozdamar B, et al. Regulation of cell polarity and protrusion formation by targeting RhoA for degradation[J]. Science, 2003,302(5651):1775-1779.
[23] Wang X, Jin C, Tang Y, et al. Ubiquitination of tumor necrosis factor receptor-associated factor 4 (TRAF4) by Smad ubiquitination regulatory factor 1 (Smurf1) regulates motility of breast epithelial and cancer cells[J]. J Biol Chem, 2013,288(30):21784-21792.
[24] Li X, Dai X, Wan L, et al. Smurf1 regulation of DAB2IP controls cell proliferation and migration[J]. Oncotarget, 2016,7(18):26057-26069.

