TET1過表達載體構建及其穩定過表達的宮頸癌HeLa細胞鑒定
沈艷,沈鳳,閆海洋,徐殿琴,丁妍,譚玉潔,3( 貴州醫科大學,貴陽550000; 湖北醫藥學院附屬太和醫院;3 貴州醫科大學附屬醫院)
宮頸癌的發生除與遺傳、環境、基因和人乳頭瘤病毒(HPV)感染,尤其是高危型HPV持續感染等因素有關外,還可能與表觀遺傳學改變有關[1]。甲基胞嘧啶雙加氧酶(TET)是由Tahiliani等[2]在研究存在t(10,11)(q22,q23)異位的白血病患者中作為融合蛋白發現的,包括TET1、TET2、TET3三名成員。其中TET1是最早被發現的,也是TET蛋白家族的主要成員之一。TET1是DNA去甲基化的重要基因,通過調節DNA上胞嘧啶和5-羥甲基胞嘧啶含量來改變基因組DNA的表觀遺傳學特征,繼而調控特定基因的表達[3]。在結腸癌、乳腺癌、前列腺癌等組織中TET1低表達[4~7],提示TET1可能具有抑癌基因作用。前期研究發現,宮頸癌組織TET1表達與患者臨床病理分級呈負相關關系[8]。說明TET1表達與宮頸癌發生、發展有關,但其具體作用機制尚不清楚。目前國內外有關TET1與宮頸癌關系的研究較少。2016年6月~2017年11月,本研究構建TET1過表達載體,并對穩定過表達TET1的宮頸癌HeLa細胞進行鑒定,旨在為進一步研究TET1在宮頸癌中的作用奠定基礎。
1 材料與方法
1.1 材料 宮頸癌HeLa細胞,日本TaKaRa公司;大腸桿菌DH5α感受態細胞,北京鼎國昌盛生物技術有限責任公司。帶氨芐抗性人pLVX-Tight-Puro-MYRF質粒(簡稱pLVX-MYRF),美國Invitrogen公司。主要試劑:LipofectamineTM3000轉染試劑,美國Invitrogen公司;T4 DNA Ligase、逆轉錄試劑盒和PCR試劑盒,天根生化科技(北京)有限公司;SYBR Premix Ex Taq試劑盒,日本TaKaRa公司;DMEM培養基,美國Gibco公司;FBS,杭州四季青生物工程材料有限公司;0.25%胰酶,上海碧云天生物技術研究所;核酸內切酶ClaⅠ、SpeⅠ,寶生物工程(大連)有限公司;2×Taq PCR master mix,美國Thermo Fisher Scientific公司;PVDF膜,北京北方同正生物技術發展有限公司;5×蛋白上樣緩沖液(含DTT),美國Roche公司;RIPA裂解液,北京索萊寶科技有限公司;TRIzol,美國Hyclone公司。主要儀器:凝膠成像儀、垂直電泳系統、半干電轉印系統,美國Bio-Rad公司;普通PCR擴增儀、核酸蛋白定量儀,德國Eppendorf公司;超速低溫離心機,美國Thermo Fisher Scientific公司。
1.2 TET1過表達載體構建及鑒定
1.2.1 引物設計合成 根據GenBank中提供的人FAM92A1-289序列(GenBank:DQ327716)及pLVX-MYRF載體圖譜,由上海生工生物工程股份有限公司設計合成引物:上游引物5′-CCGGAATTCATGATGAGGCGCACC-3′(含ClaⅠ酶切位點),下游引物5′-CCGCTCGAGTTACTTGTACAGCTCGT-3′(含SpeⅠ酶切位點)。
1.2.2 目的片段擴增 從人宮頸癌組織中提取總RNA,按逆轉錄試劑盒說明將總RNA逆轉錄為cDNA。以cDNA為模板,按PCR試劑盒說明進行PCR擴增。PCR反應體系共20 μL:cDNA 2 μL,上下游引物各1 μL,ddH2O 6 μL,Mix(含Taq酶)10 μL;反應條件:95 ℃ 5 min;95 ℃ 30 s、58 ℃ 30 s、72 ℃ 90 s,共34個循環;最后72 ℃ 10 min。取PCR產物經1%瓊脂糖凝膠電泳鑒定,DNA純化回收試劑盒純化,- 20 ℃保存。
1.2.3 真核表達載體pLVX-MYRF-TET1構建及鑒定 采用ClaⅠ、SpeⅠ酶分別對純化的PCR產物和質粒pLVX-MYRF載體雙酶切;酶切產物為帶有互補黏性末端的目的片段和載體,再次用1%瓊脂糖凝膠電泳鑒定,DNA純化回收試劑盒切膠回收;將帶有互補黏性末端的TET1片段和pLVX-MYRF載體用T4 DNA Ligase 16 ℃過夜連接,將連接產物轉入大腸桿菌DH5α感受態細胞中,得到真核表達載體pLVX-MYRF-TET1。經42 ℃熱擊化后,涂于帶有氨芐青霉素抗性的LB平板上。次日提取細菌中的質粒,經雙酶切及測序(上海生工生物工程有限公司)進行鑒定,- 80 ℃保存。
1.3 穩定過表達TET1的宮頸癌HeLa細胞鑒定
1.3.1 細胞分組處理 取宮頸癌HeLa細胞接種于含10% FBS的DMEM培養基中,置于37 ℃、5% CO2的恒溫細胞培養箱培養。待細胞融合至80%左右時,取對數生長期生長狀態良好細胞,0.05%胰蛋白酶消化、計數,接種于6孔板,每孔1×105個。將細胞隨機分為陰性對照組、TET1組,按脂質體轉染法分別轉染空質粒pLVX-MYRF、重組質粒pLVX-MYRF-TET1,轉染6 h更換新的培養基繼續培養48 h。
1.3.2 TET1 mRNA和蛋白表達檢測 ①TET1 mRNA表達:采用Real-time PCR法。收集兩組轉染6 h再培養48 h細胞,采用TRIzol法抽提細胞總RNA,按RNA逆轉錄試劑盒說明逆轉錄為cDNA。以cDNA為模板,按SYBR Premix Ex Taq試劑盒說明進行PCR擴增。PCR反應體系共50 μL:10×buffer(含Mg2+)5 μL,2.5 mmol/L dNTP 2 μL,10 μmol/L上下游引物各2 μL,Taq 0.5 μL,ddH2O 36.5 μL;反應條件:95 ℃ 15 s,95 ℃ 5 s、60 ℃ 30 s,共40個循環。以β-actin為內參,采用2-ΔΔCt法計算目的基因相對表達量。實驗重復3次,取平均值。②TET1蛋白表達:采用Western blotting法。收集兩組轉染6 h再培養48 h細胞,RIPA裂解液冰上裂解10 min,4 ℃條件下12 000 r/min離心30 min,留取上清液,BCA法蛋白定量。取部分蛋白加入1×SDS-PAGE蛋白上樣緩沖液,100 ℃水浴或金屬浴5~10 min使蛋白充分變性。取變性蛋白15 μL行SDS-PAGE(10%分離膠、5%濃縮膠),采用濕轉法將蛋白電泳產物轉印至PVDF膜上,用含5% BSA的TBST液封閉2 h,分別加入TET1、GAPDH一抗(稀釋倍數均為1∶1 500),4 ℃孵育過夜;次日,TBST洗膜10 mim×3次,加入辣根過氧化物酶標記的二抗(稀釋倍數1∶2 000),室溫下震蕩孵育1 h,TBST洗膜10 mim×3次,在暗室中化學發光、顯影、定影。采用Image J圖像處理軟件分析各蛋白電泳條帶的灰度值。以GAPDH為內參,以目的蛋白電泳條帶灰度值與內參蛋白電泳條帶灰度值的比值計算目的蛋白相對表達量。實驗重復3次,取平均值。
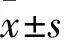
2 結果
2.1 TET1目的片段擴增結果 瓊脂糖凝膠電泳檢測結果顯示,在1 500 bp左右處出現與目的條帶大小一致的條帶。
2.2 重組質粒的雙酶切及測序鑒定結果 雙酶切結果顯示,空質粒只有一個7 000 bp大小的片段,重組質粒則出現1 500、7 000 bp兩個片段。測序結果顯示,重組質粒中正確插入了TET1完整ORF(開放閱讀框)片段。
2.3 兩組TET1 mRNA和蛋白表達比較 見表1。
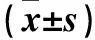
表1 兩組TET1 mRNA和蛋白相對表達量比較
注:與陰性對照組比較,*P<0.05。
3 討論
DNA甲基化是表觀遺傳學和基因組學研究的重要內容[9]。研究發現,腫瘤細胞中抑癌基因的高甲基化狀態可導致轉錄失活,繼而導致腫瘤形成,而機體內去甲基化物質減少或缺失亦能引起腫瘤發生[10]。表明DNA甲基化狀態平衡是維持基因組穩定的關鍵。
癌基因一直是腫瘤學研究的熱點。為了研究癌基因對腫瘤細胞生物學行為的影響和分子發病機制,必須尋找到一種可攜帶目的基因的載體,以保證目的基因進入腫瘤細胞后可正常復制。因此,載體構建是腫瘤學研究的最基本技術,也是實現對癌基因研究的第一步。目前認為,質粒是最理想的載體。故本研究選擇質粒作為載體進行研究。
TET1的主要作用是將5-甲基胞嘧啶轉化為5-羥甲基胞嘧啶,再轉化為5-羧基胞嘧啶及5-甲酰胞嘧啶,從而達到DNA去甲基化的目的[11,12];還能使DNA甲基化介導的基因沉默重新激活。在胚胎干細胞和組織中5-羥甲基胞嘧啶表達豐富,但在腫瘤組織中表達明顯降低甚至缺失。TET1可促進胚胎干細胞基因組CpG島去甲基化,調控DNA甲基化狀態,促進胚胎干細胞多能性因子轉錄[13],即具有自我更新和多向分化潛能。TET1對胚胎干細胞的自我更新能力和多能性潛力主要表現在對分化基因保持“沉默”,對多能性基因保持“激活”[14]。Pei等[15]研究發現,腫瘤組織TET1表達及5-羥甲基胞嘧啶水平明顯降低,TET1可直接與第10號染色體缺失的磷酸酶和張力蛋白同源基因(PTEN)的啟動子區域結合,并通過CpG島的甲基化作用激活轉錄,抑制PTEN激活AKT和FAK通路,加快腫瘤生長,并促進腫瘤細胞侵襲和轉移。研究發現,通過PTEN啟動子中CpG島的去甲基化作用提高5-羥甲基胞嘧啶含量,可使TET1抑制腫瘤生長、侵襲和轉移;TET1通過DNA去甲基化效應及Wnt信號通路上調金屬蛋白酶組織抑制因子2、3表達,繼而抑制腫瘤細胞增殖和侵襲,而TET1缺失則可加速腫瘤細胞侵襲并促進腫瘤轉移[5]。以上研究提示,TET1高表達可抑制腫瘤細胞增殖、侵襲和遷移,而其低表達作用相反。
本研究首先對TET1目的片段進行擴增,通過1%瓊脂糖凝膠電泳對PCR擴增產物進行驗證,發現在1 500 bp左右處出現與目的條帶大小一致的條帶,表明目的片段擴增成功;將目的片段TET1與載體pLVX-MYRF進行雙酶切后,用T4 DNA Ligase連接,構建帶有氨芐青霉素抗性的真核表達載體pLVX-MYRF-TET1,雙酶切及測序鑒定結果顯示成功構建了真核表達載體pLVX-MYRF-TET1。本研究采用脂質體轉染法將真核表達載體pLVX-MYRF-TET1和空質粒pLVX-MYRF轉染宮頸癌HeLa細胞,Real-time PCR法和Western blotting法檢測結果顯示,TET1組TET1 mRNA和蛋白相對表達量均明顯高于陰性對照組。證實目的片段TET1在宮頸癌HeLa細胞中成功過表達。本研究為進一步探究TET1對宮頸癌細胞增殖、侵襲及轉移等生物學行為的影響奠定了重要基礎。
參考文獻:
[1] Tian Y, Pan F, Sun X, et al. Association of TET1 expression with colorectal cancer progression[J]. Scand J Gastroenterol, 2017,52(3):312-320.
[2] Tahiliani M,Koh KP, Shen Y, et al. Converion of 5-methylcytosine to 5-hydroxymethyl cytosin in mammalian DNA by MLL partner TET1[J]. Science, 2009,324(5929):930-935.
[3] 韓競男,魯昊騁,梁靜.DNA甲基化與癌癥[J].中國生物化學與分子生物學報,2012,28(2):108-114.
[4] Cimmino L, Dawlaty MM, Ndiaye-Lobry D, et al. TET1 is a tumor suppressor of hematopoietic malignancy[J]. Nat Immunol, 2015,16(6):653-662.
[5] Neri F, Dettori D, Incarnato D, et al. TET1 is a tumour suppressor that inhibits colon cancer growth by derepressing inhibitors of the WNT pathway[J]. Oncogene, 2015,34(32):4168-4176.
[6] Kudo Y, Tateishi K, Yamamoto K, et al. Loss of 5-hydroxymethylcytosine is accompanied with malignant cellular transformation[J]. Cancer Sci, 2012,103(4):670-676.
[7] Hsu CH, Peng KL, Kang ML, et al. TET1 suppresses cancer invasion by activating the tissue inhibitors of metalloproteinases[J]. Cell Rep, 2012,2(3):568-579.
[8] Ding Y, Yu AQ, WANG XL, et al. Forced expression of Nanog with mRNA synthesized in vitro to evaluate the malignancy of HeLa cells through acquiring cancer stem cell Phenotypes[J]. Oncol Rep, 2016,35(5):2643-2650.
[9] 李惠晨,葉明翔,侯赟,等.TET蛋白去甲基化作用的相關研究進展[J].現代生物醫學進展,2014,14(27):6351-5363.
[10] Kai M, Niinuma T, Kitajima H, et al. TET1 depletion induces aberrant CpG methylation in colorectal cancer cells[J]. PLoS One, 2016,11(12):e0168281.
[11] Mohr F, D?hner K, Buske C, et al. TET genes: new players in DNA demethylation and important determinants for stemness[J]. Exp Hematol, 2011,39(3):272-281.
[12] Ito S, D′Alessio AC, Taranova OV, et al. Role of Tet proteins in 5mC to 5hmC conversion, ES-cell self-renewal and inner cell mass specification[J]. Nature, 2010,466(7310):1129-1133.
[13] Wu H, D′Alessio AC, Ito S, et al. Dual functions of Tet1 in transcriptional regulation in mouse embryonic stem cells[J]. Nature, 2011,473(7347):389-393.
[14] Zhang H, Zhang X, Clerk E, et al. TET1 is a DNA-binding proteinthat modulates DNA methylation and gene transcription via Hydroxylation of 5-methylcytosine[J]. Cell Res, 2010,20(12):1390-1393.
[15] Pei YF, Tao Ran, Li JF, et al. TET1 inhibits gastric cancer growth and metastasis by PTEN demethylation and re-expression[J]. Oncotarget, 2016,7(21):31322-31335.

