XACB/MSCs/Lv-GFP-FGF-2的制備及其對兔激素性股骨頭缺血壞死的治療效果觀察
王健波,彭吾訓,張健,張飛,張槐,趙胤,李青,鄧進(貴州醫科大學,貴陽550000)
股骨頭缺血壞死是以股骨頭嚴重缺少血液供應和骨內壓明顯升高為病理特征的髖關節疾病,其發病機制復雜,影響因素較多[1,2]。目前治療股骨頭缺血壞死的方法有很多,如髓芯減壓、骨移植、關節成形及關節置換等[3],但每一種方法均有不足。目前,以基因轉染技術改造或加強的骨髓基質干細胞(MSCs)為種子細胞的組織工程骨已逐漸用于股骨頭缺血壞死的治療,但移植后MSCs凋亡的機制尚未完全明確[4]。TNF-α在 MSCs的凋亡過程中發揮不可忽視的作用。2016年10月~2017年8月,本研究以異種脫抗原松質骨(XACB)作為構建組織工程骨的支架材料,利用慢病毒為載體介導成纖維細胞生長因子2(FGF-2)基因轉染兔MSCs,并與XACB復合培養,制備了組織工程骨XACB/MSCs/Lv-GFP-FGF-2;現分析其對兔激素性股骨頭缺血壞死的治療作用及其機制。
1 材料與方法
1.1 材料 動物:6周齡新西蘭大白兔5只,雌雄不限,體質量1.0~1.5 kg;3月齡新西蘭大白兔80只,雌雄不限,體質量3.5~4.0 kg;均購于貴州醫科大學動物實驗中心。主要試劑:DMEM培養基(美國Gibco公司),胎牛血清(美國Hyclone公司);Percoll分離液(美國Sigma公司);堿性磷酸酶(ALP)試劑盒(北京索萊寶科技有限公司);成骨誘導培養基(廣州賽業科技有限公司)。主要儀器:CO2孵箱(Thermo forma 31I,美國),倒置相差顯微鏡、熒光顯微鏡(日本Olympus公司),NDl000型核酸蛋白測量儀(美國Nanodrop公司),C1000型PCR擴增儀、iCycler iQ熒光定量PCR儀(美國BIO-RAD公司)。
1.2 組織工程骨XACB/MSCs/Lv-GFP-FGF-2的制備
1.2.1 兔MSCs分離、培養及鑒定 選擇6周齡新西蘭大白兔5只,靜脈麻醉后于股骨及脛骨處用骨髓穿刺針抽取骨髓,采用密度梯度離心法和貼壁法行細胞分離培養。選取第3代MSCs,倒置相差顯微鏡觀察細胞形態,結果顯示細胞呈長梭形、外形均一、排列整齊呈魚群狀。使用流式細胞儀鑒定細胞表型分子CD44表達,結果顯示CD44陽性率>99%。采用成骨誘導分化培養基培養MSCs,并行茜素紅染色及ALP染色。結果均呈陽性,茜素紅染色可見鈣結節被染成橘紅色,ALP染色陽性細胞的細胞膜及細胞質內顆粒染色呈黑色。證實分離出的細胞是MSCs。
1.2.2 兔MSCs轉染 ①慢病毒介導FGF-2基因轉染MSCs:取生長狀況良好的第3代兔MSCs隨機分為病毒轉染組、空病毒轉染組、空白對照組,依據前期預試驗確定的MOI值(50),病毒轉染組加入載有FGF-2基因的慢病毒液,空病毒轉染組加入未載有FGF-2基因的慢病毒液,空白對照組加慢病毒稀釋液,使用倒置熒光顯微鏡觀察轉染細胞綠色熒光蛋白(GFP)表達情況。結果顯示,病毒轉染組、空病毒轉染組熒光顯微鏡下可見大量的GFP,空白對照組未見GFP。②穩轉細胞株篩選:根據前期預試驗結果對轉染細胞加入嘌呤霉素進行篩選,獲得穩轉細胞株。采用Western blottting法檢測各組FGF-2蛋白相對表達量(條帶灰度值),結果顯示病毒轉染組、空病毒轉染組及空白對照組FGF-2蛋白相對表達量分別為0.757±0.034、0.457±0.015、0.428±0.012,病毒轉染組明顯高于空病毒轉染組及空白對照組(P均<0.05)。采用qRT-PCR法檢測各組FGF-2 mRNA相對表達量(采用2-ΔΔCt法計算),結果顯示病毒轉染組、空病毒轉染組及空白對照組FGF-2 mRNA相對表達量分別為32.016±3.902、3.531±0.638、1.023±0.007 ,病毒轉染組明顯高于空病毒轉染組及空白對照組(P均<0.05)。證實嘌呤霉素篩選得到的病毒轉染組細胞株可穩定表達FGF-2,病毒轉染組、空病毒轉染組分別獲得穩轉細胞MSCs/Lv-GFP-FGF-2、MSCs/Lv-GFP。③細胞株與XACB復合培養:分別調整病毒轉染組、空病毒轉染組及空白對照組的細胞密度為5×106/mL,將預處理的XACB置入6孔板中。分別加入各組細胞懸液約100 μL/孔,與完全培養基進行復合培養,分別獲得組織工程骨XACB/MSCs/Lv-GFP-FGF-2、XACB/MSCs/Lv-GFP、XACB/MSCs。培養第6天,電鏡下觀察細胞株附著、分布、生長情況。結果顯示病毒轉染組XACB/MSCs/Lv-GFP-FGF-2細胞株伸出偽足,向周圍伸展,帖附于XACB并且生長良好。
1.3 XACB/MSCs/Lv-GFP-FGF-2對兔股骨頭缺血壞死的治療作用及其對股骨頭組織TNF-α表達的影響
1.3.1 模型制備及分組處理 選擇3月齡新西蘭大白兔80只,參照Wu等[5]的方法,采用內毒素與甲基強的松龍制備兔激素性股骨頭缺血壞死模型。建模后8周行MRI檢查,T1像示股骨頭關節軟骨下呈點狀、片狀低信號,T2像示股骨頭關節軟骨下呈點狀、片狀高信號,判定激素性股骨頭缺血壞死模型建立成功[6]。選擇建模成功的激素性股骨頭缺血壞死兔60只隨機分為A、B、C、D、E組,各12只。各組均靜脈注射3%戊巴比妥鈉麻醉,無菌操作下髖關節外側切口,顯露股骨頭,于股骨頭頸交界處開口行髓芯減壓,A組不植骨、B組植入自體松質骨、C組植入XACB/MSCs、D組植入XACB/MSCs/Lv-GFP、E組植入XACB/MSCs/Lv-GFP-FGF-2。植入后縫合傷口,術后使用抗生素預防感染。實驗過程中如有死亡動物則立刻補齊,保證每組可利用樣本均為12只。
1.3.2 股骨頭大體形態觀察 術后3、6、12周,各組分別隨機選擇4只兔處死,于無菌條件下取出股骨頭,先觀察股骨頭表面情況,再沿股骨頭冠狀面剖開,觀察股骨頭缺血壞死區修復情況。
1.3.3 股骨頭組織TNF-α表達檢測 ①免疫組化法:將各組不同時期的股骨頭組織分為兩部分,一部分保存于液氮中;另一部分標本用EDTA脫鈣液脫鈣后,常規脫水,石蠟包埋,制成5 μm厚度的切片,常規行免疫組織化學染色。TNF-α抗原表達陽性的細胞被染成棕黃色,細胞排列不整、形態紊亂。采用Image-Pro Plus圖像計數軟件隨機選擇5個視野,計數100個細胞內TNF-α陽性細胞數,計算TNF-α陽性表達率,取平均值。②Real-time PCR法:取各組不同時期保存于液氮中的股骨頭組織,液氮中研磨呈粉狀后,采用TRIzol法提取總RNA。按逆轉錄試劑盒(上海生工生物工程有限公司)說明書逆轉錄合成 cDNA。TNF-α及內參基因β-actin引物均采用Primer Premier軟件設計合成。TNF-α上游引物:5′-TAGTAGCAAACCCGCAAG-3′,下游引物:5′-AAGAGAACCTGGGAGTAGATG-3′;β-actin上游引物:5′-ATCAGCAAGCAGGAGTAT-3′,下游引物:5′-CAATCTCGTCTCGTTTCTG-3′。PCR反應總體系20 μL: 2×qPCR Master Mix 10 μL、上下游引物各0.8 μL、cDNA 2 μL、雙蒸水6.4 μL。PCR反應條件:95 ℃預變性30 s,95 ℃變性10 s,60 ℃退火30 s,循環40次。采用 2-ΔΔCt法計算TNF-α mRNA相對表達量。
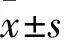
2 結果
2.1 各組股骨頭大體形態比較 所有股骨頭無脫位、塌陷及骨折。術后3周,A組缺損區與周圍骨組織界限清晰,由肉芽組織填充;B、C、D組缺損區移植骨吸收不完全,缺損區界限清晰,由肉芽組織填充,周圍見少量新骨形成;E組移植骨未完全吸收,缺損區界限清晰,周圍見新骨形成。術后6周,A組缺損區由肉芽組織填充,仍無明顯新骨形成;B組移植骨吸收不全,缺損區界限清晰,由肉芽組織填充,周圍有新骨形成;C、D組缺損區仍清晰可見,邊緣可見明顯新骨形成,中央由肉芽組織填充;E組大部分缺損區已被新骨填充,界限模糊,移植骨已基本被吸收。術后12周,A組缺損區幾乎由結締組織填充,周圍見少許新骨形成;B組缺損區移植骨與周圍正常骨界限較清晰,可見新骨形成;C、D組缺損區移植骨完全被吸收,周圍大量新骨形成,中央可見少量結締組織填充;E組移植骨與周圍正常骨組織界限不清,骨修復程度接近正常松質骨。
2.2 各組股骨頭組織TNF-α陽性表達率比較 術后3、6、12周,B、C、D、E組股骨頭組織TNF-α陽性表達率均逐漸降低(P均<0.05)。術后3周,E組股骨頭組織TNF-α陽性表達率低于A、B、C、D組(P均<0.05);術后6、12周相同時間點,股骨頭組織TNF-α陽性表達率A組>B組>C、D組>E組(P均<0.05)。見表1。
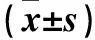
表1 各組股骨頭組織TNF-α陽性表達率比較
注:與同組術后3周比較,aP<0.05;與同組術后6周比較,bP<0.05;與A組同時間點比較,cP<0.05;與B組同時間點比較,dP<0.05;與C組同時間點比較,eP<0.05;與D組同時間點比較,fP<0.05。
2.3 各組股骨頭組織TNF-α mRNA相對表達量比較 術后3、6、12周,B、C、D、E組股骨頭組織TNF-α mRNA相對表達量均逐漸降低(P均<0.05)。術后3周,E組股骨頭組織TNF-α mRNA相對表達量低于A、B、C、D組(P均<0.05);術后6、12周相同時間點,股骨頭組織TNF-α mRNA相對表達量A組>B組>C、D組>E組(P均<0.05)。見表2。
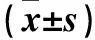
表2 各組股骨頭組織TNF-α mRNA相對表達量比較
注:與同組術后3周比較,aP<0.05;與同組術后6周比較,bP<0.05;與A組同時間點比較,cP<0.05;與B組同時間點比較,dP<0.05;與C組同時間點比較,eP<0.05;與D組同時間點比較,fP<0.05。
3 討論
股骨頭缺血壞死的發病機制包括多種理論體系,如血管內凝血及骨壞死學說、脂肪栓塞學說、骨質疏松與顯微骨折學說及骨內壓增高理論等[7,8],其病理變化為骨細胞壞死。以MSCs 為種子細胞,結合基因轉染技術與組織工程技術是目前治療股骨頭缺血壞死的研究熱點[9]。MSCs是骨髓基質系統中的一類多能干細胞,免疫原性弱,可誘導分化為骨、軟骨、脂肪、肌腱、神經、肌肉等組織,是細胞工程和基因工程的理想載體細胞。MSCs不僅可以攜帶目的基因,還可發揮細胞替代和細胞轉化的特殊作用[10~12]。bFGF 不僅具有廣泛的生物學效應,可促進成骨細胞、成軟骨細胞蛋白質的合成和細胞分化增殖,協同其他骨生長因子成骨;還能促進毛細血管生長,有利于新骨形成和替代[13,14]。研究發現,轉染后的MSCs在形態上與轉染前無明顯差別,并可成功表達bFGF[15,16]。本研究利用慢病毒為載體介導FGF-2基因轉染兔MSCs,結果顯示轉染后的MSCs可大量表達GFP,FGF-2蛋白相對表達量及mRNA相對表達量均明顯升高,證實嘌呤霉素篩選得到的病毒轉染組細胞株可穩定表達FGF-2。自體骨移植在修復過程中主要為軟骨下骨和關節軟骨提供結構性支撐,以防止塌陷[17]。XACB具備良好的生物相容性及合適的力學強度,具有天然的多孔結構和合適的孔隙率,利于復合種子細胞及骨誘導因子,便于血管組織的長入和軟骨分化形成[18]。本研究將病毒轉染組細胞株與XACB進行復合培養,得到XACB/MSCs/Lv-GFP-FGF-2,電鏡結果顯示其細胞株伸出偽足,向周圍伸展,帖附于XACB并且生長良好;證實成功獲得組織工程骨XACB/MSCs/Lv-GFP-FGF-2。
本研究激素性股骨頭缺血壞死模型股骨頭組織病理學以骨髓細胞壞死、骨髓內脂肪細胞增多為主要表現,符合股骨頭缺血壞死病理變化,適合用于股骨頭缺血壞死治療的相關研究。本研究結果顯示,術后3周,E組可見少量新骨形成,其余各組均未見新骨形成。術后6周,A組缺損區由肉芽組織填充,仍無明顯新骨形成;B、C、D組缺損區仍清晰可見,邊緣可見新骨形成;E組大部分缺損區已被新骨填充,移植骨已基本吸收。術后12周,A組僅有少量新骨形成,B、C、D組均未完全修復,E組缺損區修復接近正常松質骨。說明XACB/MSCs/Lv-GFP-FGF-2移植治療兔激素性股骨頭缺血壞死的效果較好。Samara等[19]研究顯示,大量炎癥因子參與股骨頭缺血壞死的發展過程,如IL-1、IL-2、IL-4、IL-6、IL-10和TNF-α。TNF-α是參與骨重建的促炎因子之一[20]。本研究結果顯示,術后3周,E組股骨頭組織TNF-α陽性表達率及mRNA相對表達量均明顯低于A、B、C、D組;術后6、12周相同時間點,股骨頭組織TNF-α陽性表達率及mRNA相對表達量A組>B組>C、D組>E組。說明XACB/MSCs/Lv-GFP-FGF-2治療兔激素性股骨頭缺血壞死的機制可能與其降低股骨頭組織TNF-α表達有關。分析原因,轉染FGF-2基因的MSCs在股骨頭缺血壞死早期即可促進成骨細胞合成和毛細血管生長,并下調TNF-α表達,從而減輕炎癥反應。
綜上所述,本研究成功制備了組織工程骨XACB/MSCs/Lv-GFP-FGF-2;其治療兔激素性股骨頭缺血壞死的效果較好,作用機制可能為抑制股骨頭組織TNF-α表達。
參考文獻:
[1] Kamal D, Traistaru R, Kamal CK, et al. Macrophage response in patients diagnosed with aseptic necrosis of the femoral head presenting different risk factors[J]. Rom J Morphol Embryol, 2015,56(1):163-168.
[2] DePasse JM, Palumbo MA, Haque M, et al. Complications associated with prone positioning in elective spinal surgery[J]. World J Orthop, 2015,6(3):351-359.
[3] Thiel GSV, Mather RC. The treatment of osteonecrosis in the hip.oper techn sports med[J]. Operat Tech Sport Med, 2015,23(3):222-230.
[4] Zhang F, Cui J, Lv BO, et al. Nicorandil protects mesenchymal stem cells against hypoxia and serum deprivation-induced apoptosis[J]. Int J Mol Med, 2015,36(2):415-423.
[5] Wu X, Yang S, Duan D, et al. Experimental osteonecrosis induced by a combination of low dose lipopolysaccharide and highdose methylprednisolone in rabbits[J]. Joint Bone Spine, 2008,75(5):573-578.
[6] 馬煥芝,曾炳芳,李曉林,等.甲基強的松龍聯合內毒素誘導兔股骨頭缺血性壞死的實驗研究[J].中國修復重建外科雜志,2008,22(3):265-270.
[7] Gangji V, Hauzeur JP, Schoutens A, et al. Abnormalities in the replicative capacity of osteoblastic cells in the proximal femur of patients with osteonecrosis of the femoral head[J]. J Rheumatol, 2003,30(2):348-351.
[8] Suh KT, Kim SW, Roh HL, et al. Decreased osteogenic differentiation of mesenchymal stem cells in alcohol-induced osteonecrosis[J]. Clin Orthop Relat Res, 2005,431(431):220-225.
[9] Bordone L, Toti P, MeJames AW, et al. Proliferation, osteogenic differentiation, and fgf-2 modulation of posterofrontal/sagittal suture-derived mesenchymal cells in vitro[J]. Plast Reconstr Surg, 2008,122(1):53.
[10] James AW, Xu Y, Wang R, et al. Proliferation, osteogenic differentiation, and fgf-2 modulation of posterofrontal/sagittal suture-derived mesenchymal cells in vitro[J]. Plast Reconstr Surg, 2008,122(1):53-63.
[11] Maegawa N, Kawamura K, Hirose M, et al. Enhancement of osteoblastic differentiation of mesenchymal stromal cells cultured by selective combination of bone morphogenetic protein-2 (BMP-2) and fibroblast growth factor-2 (FGF-2)[J]. J Tissue Eng Regen Med, 2007,1(4):306-313.
[12] Gulati P, Muthuraman A, Jaggi AS, et al. Neuroprotective effect of gadolinium: a stretch-activated calcium channel blocker in mouse model of ischemia-reperfusion injury[J]. Naunyn Schmiedebergs Arch Pharmacol, 2013,386(3):255-264.
[13] Geraghty S, Kuang JQ, Yoo D, et al. A novel, cryopreserved, viable osteochondral allograft designed to augment marrow stimulation for articular cartilage repair[J]. J Orthop Surg Res, 2015,10(1):66.
[14] Marektrzonkowska N, Kwieczyńska A, Reiwergostomska M, et al. Arterial hypertension is characterized by imbalance of pro-angiogenic versus anti-angiogenic factors[J]. PLoS One, 2015,10(5):e0126190.
[15] Kraus TM, Imhoff FB, Reinert J, et al. Stem cells and bFGF in tendon healing: effects of lentiviral gene transfer and long-term follow-up in a rat Achilles tendon defect model[J]. Bmc Musculoskelet Disord, 2016,17(1):1-7.
[16] Zhang JC, Zheng GF, Wu L, et al. Bone marrow mesenchymal stem cells overexpressing human basic fibroblast growth factor increase vasculogenesis in ischemic rats[J]. Braz J Med Biol Res, 2014,47(10):886-94.
[17] 呂波,董文,劉武清.異種脫蛋白松質骨支架在脊柱橫突間融合中應用的可行性[J].中國組織工程研究,2015,43(19):6946-6952.
[18] Mohanty SP, Singh KA, Kundangar R, et al. Management of non-traumatic avascular necrosis of the femoral head-a comparative analysis of the outcome of multiple small diameter drilling and core decompression with fibular grafting[J]. Musculoskelet Surg, 2017,101(1):59-66.
[19] Samara S, Kollia P, Dailiana Z, et al. Predictive role of cytokine gene polymorphisms for the development of femoral head osteonecrosis[J]. Dis Markers, 2012,33(4):215-221.
[20] Wu X, Xu W, Feng X, et al. TNF-a mediated inflammatory macrophage polarization contributes to the pathogenesis of steroid-induced osteonecrosis in mice[J]. Int J Immunopathol Pharmacol, 2015,28(3):351-361.

