葛根素對MC3T3-E1成骨前體細胞增殖能力的影響及其機制
馮倩,俞鵬,程嵩奕,曾祥偉,楊瑞,楊婧,趙鳳鳴,朱家鵬,詹秀琴(南京中醫藥大學醫學與生命科學學院,南京003;南京中醫藥大學第一附屬醫院)
葛根素是提取自中藥葛根中的一種異黃酮類物質,具有抗癌及改善心腦血管疾病、糖尿病及骨質疏松等作用[1]。研究發現,低濃度葛根素可能通過下調miR-204及其宿主基因TRPM3表達等多種途徑提高成骨細胞增殖能力[2,3]。絲裂原活化蛋白激酶(AMPK)是細胞內的一類絲氨酸/蘇氨酸蛋白激酶,目前已知的AMPK信號通路有三條,包括經典的AMPK信號途徑、ERK信號通路和非經典的AMPK信號途徑(JNK/SAPK途徑和p38/AMPK途徑),三種信號通路往往同時發揮作用,與細胞增殖、分化以及能量代謝密切相關[4]。因AMPK多在磷酸化后發揮生物學效應,故磷酸化的AMPK(p-AMPK)表達水平對信號通路的調控具有重要意義。研究發現,激活AMPK/微管相關蛋白1輕鏈3(LC3)信號通路可通過誘導細胞自噬而促進肺動脈平滑肌細胞、鼻黏膜上皮細胞及多巴胺能神經元[5~7]增殖。目前葛根素對成骨細胞增殖的影響及其是否與AMPK/LC3信號通路有關鮮見報道,為此我們于2017年9~11月進行了如下研究。
1 材料
細胞:MC3T3-E1成骨前體細胞購于中國科學院上海細胞生物學研究所。細胞常規培養于含有10%胎牛血清的α-MEM完全培養基中,5% CO2、37 ℃孵箱中培養,待細胞融合度達90%時,0.25%胰酶消化,按1∶3比例進行傳代培養。主要試劑:α-MEM 完全培養基(上海中喬新舟生物科技有限公司),葛根素標準品(中國藥品生物制品檢定所),β-雌二醇(國藥集團化學試劑有限公司),CCK-8 試劑盒(日本同仁化學研究所),兔抗鼠p-AMPK、LC3多克隆抗體、內參β-actin一抗、Anti-Rabbit IgG二抗(美國Cell Signaling Technology公司),BCA 試劑盒(北京索萊寶科技有限公司),顯色劑(美國BIO-RAD公司),siRNA-AMPK質粒(上海吉瑪制藥技術有限公司)。主要儀器:超凈工作臺(蘇州佳寶凈化工程設備有限公司),多功能酶標儀(美國BioTek公司),凝膠成像儀(美國BIO-RAD公司)。
2 方法與結果
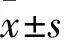
2.1 葛根素促進細胞增殖能力的最佳作用濃度及作用時間篩選 取對數生長期MC3T3-E1細胞,以5×103個/孔接種于96孔板中,37 ℃、5% CO2細胞培養箱中培養。待細胞貼壁后,將細胞隨機分為空白對照組、葛根素組和雌激素組,空白對照組每孔加入α-MEM完全培養基200 μL,葛根素組每孔加入葛根素與α-MEM完全培養基混合液200 μL,調整葛根素終濃度分別為0.1、1、10 μmol/L,雌激素組每孔加入雌激素與α-MEM完全培養基混合液200 μL,調整雌激素終濃度為0.01 μmol/L,每組設置6個復孔。分別于作用24、36、48 h時每孔加入10 μL CCK-8試劑,將細胞板避光置于細胞培養箱中培養30 min,采用多功能酶標儀檢測450 nm波長處的光密度(OD)值。結果顯示,葛根素組不同濃度作用24、36、48 h的細胞增殖能力均高于空白對照組、低于雌激素組(P均<0.05);0.1 μmol/L葛根素作用48 h細胞增殖能力均高于同濃度作用24、36 h及1、10 μmol/L葛根素作用48 h(P均<0.05)。見表1。后續實驗葛根素組均選擇葛根素濃度為0.1 μmol/L、作用時間為48 h。
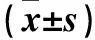
表1 各組細胞增殖能力
2.2 葛根素對細胞自噬的影響 取對數生長期MC3T3-E1細胞,以5×105個/孔接種于6孔板中。待細胞貼壁后,分為空白對照組、葛根素組和雌激素組,各組每孔均加入α-MEM完全培養基2 mL。葛根素組每孔加入葛根素,調整葛根素終濃度為0.1 μmol/L;雌激素組每孔加入雌激素,調整雌激素終濃度為0.01 μmol/L;每組設置3個復孔。作用48 h,每孔加入1 mL胰蛋白酶消化并吸至1.5 mL EP管中,1 000 r/min離心5 min,去上清;每管加入500 μL戊二醛,置于4 ℃冰箱中固定12 h;鋨酸再次固定,醋酸鈾染色,乙醇梯度脫水,樹脂包埋,0.1 μm厚度切片。檸檬酸鉛染色,透射電鏡下觀察各組細胞器結構。結果顯示,空白對照組細胞器、細胞核和染色體形態正常;葛根素組和雌激素組細胞質內可見較多環狀結構物質,該物質具有自噬體特異性的雙層膜結構。表明葛根素與雌激素可誘導MC3T3-E1細胞發生自噬。
2.3 葛根素對細胞p-AMPK、LC3-Ⅱ/LC3Ⅰ表達的影響 取對數生長期MC3T3-E1細胞,參照2.2的方法進行接種及分組處理,提取總蛋白并采用BCA法進行蛋白定量。取樣本25 μg進行SDS-PAGE凝膠電泳,轉膜并剪膜后,加封閉液室溫封閉1 h。TBST漂洗5 min×3次。分別加入p-AMPK、LC3一抗(稀釋比例均為1∶1 000)4 mL,4 ℃過夜,TBST漂洗5 min×3次。加入膜與HRP結合的二抗(稀釋比例均為1∶2 000),室溫下置于搖床孵育1 h,TBST漂洗5 min×3次。將顯色液加于濾膜正面并顯影,調整曝光時間,選擇最佳條帶。采用Bandscan分析軟件分析條帶灰度并進行半定量分析。以目的基因條帶灰度值與管家基因β-actin條帶灰度的比值計算蛋白相對表達量,并計算LC3-Ⅱ/LC3-Ⅰ。結果顯示,葛根素組、雌激素組p-AMPK及LC3-Ⅱ/LC3-Ⅰ均明顯高于空白對照組,雌激素組均明顯高于葛根素組(P均<0.01)。見表2。
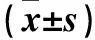
表2 各組細胞p-AMPK、IC3-Ⅰ、IC3-Ⅱ、LC3-Ⅱ/LC3-Ⅰ比較
注:與空白對照組比較,*P<0.01;與雌激素組比較,#P<0.01。
2.4 干擾AMPK對葛根素作用后MC3T3-E1細胞自噬及LC3-Ⅱ/LC3-Ⅰ表達的影響
2.4.1 細胞分組處理 取對數生長期MC3T3-E1細胞,以5×105個/孔接種于6孔板,每組3個復孔。細胞融合至70%時,隨機分為空白對照組、陰性對照組、葛根素組和AMPK干擾組。各組每孔均加入轉染試劑與α-MEM完全培養基混合液2 mL。陰性對照組采用Lipofectamine2000脂質體轉染法轉染無意義陰性序列;葛根素組及AMPK干擾組每孔加入葛根素,調整終濃度為0.1 μmol/L,AMPK干擾組采用Lipofectamine2000脂質體轉染法轉染siRNA-AMPK質粒。各組均培養4 h,更換為α-MEM完全培養基。
2.4.2 細胞自噬情況 各組轉染48 h,參照2.2的方法觀察細胞自噬情況。結果顯示,空白對照組和陰性對照組細胞器、細胞核、染色體形態正常;葛根素組細胞質內可見較多環狀結構物質,該物質具有自噬體特異性的雙層膜結構;AMPK干擾組僅見一處自噬體特異性結構,較空白對照組和陰性對照組無明顯區別。表明干擾AMPK表達可抑制葛根素介導的MC3T3-E1細胞自噬。
2.4.3 細胞LC3-Ⅱ/LC3-Ⅰ表達 各組轉染48 h,參照2.3的方法檢測細胞LC3-Ⅱ/LC3-Ⅰ。結果顯示,葛根素組LC3-Ⅱ/LC3-Ⅰ明顯高于空白對照組、陰性對照組、AMPK干擾組(P均<0.01),空白對照組、陰性對照組、AMPK干擾組LC3-Ⅱ/LC3-Ⅰ比較差異無統計學意義(P>0.05)。見表3。
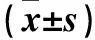
表3 各組細胞LC3-Ⅰ、LC3-Ⅱ及LC3-Ⅱ/LC3-Ⅰ比較
注:與空白對照組及陰性對照組比較,*P<0.01;與葛根素組比較,#P<0.01。
3 討論
骨質疏松癥是以單位體積內骨組織量減少為特征的一類骨代謝病,成骨細胞增殖能力下降是誘發骨質疏松的重要原因[8]。骨質疏松癥在老年人和絕經后婦女人群中高發,多與雌激素缺乏有關[9]。近年研究發現,葛根素具有類雌激素樣作用,在促進成骨細胞增殖、改善骨質疏松方面具有良好的調節作用,但是其具體機制尚未明了[10]。本研究結果顯示,不同濃度葛根素均可促進MC3T3-E1細胞增殖,并呈時間依賴性,其中以0.1 μmol/L葛根素作用48 h效果最佳。
自噬是將自身細胞器包裹,并通過溶酶體降解的過程,生理狀態下可以發揮提供能量、維持細胞器穩態的作用。一旦損傷超過了細胞的承受能力,細胞將通過自噬進行調控性自殺[11]。LC3參與細胞自噬過程,細胞中新合成的LC3被加工成細胞質可溶形式的LC3-Ⅰ,泛素化修飾后與細胞膜上的磷脂酰乙醇胺結合,轉化為細胞膜結合形式的LC3-Ⅱ。LC3-Ⅱ定位于前自噬體和自噬體,是自噬標志物,而LC3-Ⅱ/LC3-Ⅰ與自噬水平呈正相關,可反映細胞自噬水平[12]。目前自噬對成骨細胞增殖水平的影響存在爭議。自噬相關蛋白7 (Atg7) 是一類自噬組成蛋白,可促使LC3-Ⅰ與磷脂酰乙醇胺共價結合,形成LC3-Ⅱ。有研究發現,Atg7敲除小鼠較正常小鼠的骨量降低,成骨細胞增殖能力下降[13]。此外,在成骨細胞分化的過程中,形態學轉變可導致細胞內質網和線粒體數量逐漸減少,而抑制細胞自噬后則不會,表明成骨細胞自噬在一定程度上有助于骨骼穩態和骨形成。本研究結果顯示,MC3T3-E1細胞經0.1 μmol/L葛根素作用48 h后,透射電鏡下可見明顯有自噬體特異性的雙層膜結構,表明低濃度葛根素可通過促進成骨細胞自噬而增強其細胞增殖能力。
成骨細胞的自噬過程涉及多條信號通路。有研究顯示,抑制ERK信號通路可降低大鼠成骨細胞的自噬水平,延緩糖尿病誘導的骨質疏松癥,推測自噬對成骨細胞的不同影響可能與激活自噬的途徑有關[14]。AMPK/LC3通路是近年來自噬相關通路的研究熱點。研究發現,外源性H2S可以通過AMPK/LC3通路誘導自噬,降低糖尿病心肌病患者的氧化應激水平[15]。血府逐瘀湯可以通過AMPK/LC3通路上調缺氧-復氧心肌細胞自噬水平,從而增強細胞增殖能力,減少心肌細胞凋亡,發揮抗缺血再灌注損傷作用[16]。葛根素是否通過AMPK/LC3通路誘導細胞自噬從而產生保護作用目前鮮見報道。本研究結果顯示,MC3T3-E1細胞經0.1 μmol/L葛根素作用48 h后LC3-Ⅱ/LC3-Ⅰ及p-AMPK蛋白表達水平上升,而干擾AMPK表達后的成骨細胞電鏡下自噬體數量減少、LC3-Ⅱ/LC3-Ⅰ明顯降低。表明在葛根素調控自噬參與成骨細胞增殖的過程中,AMPK/LC3通路可能發揮了正向調控作用。但細胞自噬是一個動態過程,且成骨細胞的增殖、分化、礦化對骨質疏松均會產生影響[17],需進一步深入研究其中的分子機制。
綜上所述,葛根素可增強MC3T3-E1細胞增殖能力;激活AMPK/LC3信號通路介導的自噬水平是其可能的機制之一,可為臨床治療骨質疏松癥提供新的治療靶點。
參考文獻:
[1] 曾祥偉,馮倩,張瑩瑩,等.葛根素對炎癥相關疾病研究進展[J].中國藥理學通報,2018,34(1):8-11.
[2] Zhan XQ, Zeng XW, Zhang YY, et al. Puerarin promotes the viability and differentiation of MC3T3 E1 cells by miR 204 regulated Runx2 upregulation[J]. Mol Med Rep, 2017,16(5):6262-6268.
[3] 張瑩瑩,周建斌,曾祥偉,等.葛根素對成骨細胞增殖能力及靶向Runx2的miRNA的影響[J].中國藥理學通報,2016,32(10):1457-1462.
[4] 馮倩,曾祥偉,楊瑞,等.骨髓間充質干細胞成骨分化相關信號通路及其與BMP-2關系的研究進展[J].山東醫藥,2017,57(48):97-99.
[5] Zhou Y, Wang Y, Wang X, et al. The protective effects of Κ-Opioid receptor stimulation in hypoxic pulmonary hypertension involve inhibition of autophagy through the AMPK-MTOR pathway[J]. Cell Physiol Biochem, 2017,44(5):1965-1979.
[6] Wang XH, Zhang ZH, Cai XL, et al. Lipopolysaccharide induces autophagy by targeting the AMPK-mTOR pathway in Human Nasal Epithelial Cells[J]. Biomed Pharmacother, 2017,96:899-904.
[7] Wen Z, Zhang J, Tang P, et al. Overexpression of miR 185 inhibits autophagy and apoptosis of dopaminergic neurons by regulating the AMPK/mTOR signaling pathway in Parkinson′s disease[J]. Mol Med Rep, 2018,17(1):131-137.
[8] Diepenhorst N, Rueda P, Cook AE, et al. G protein-coupled receptors as anabolic drug targets in osteoporosis[J]. Pharmacol Ther, 2017,7258(17):30265-30266.
[9] Almeida M, Laurent MR, Dubois V, et al. Estrogens and androgens in skeletal physiology and pathophysiology[J]. Physiol Rev, 2017,97(1):135-187.
[10] An J, Yang H, Zhang Q, et al. Natural products for treatment of osteoporosis: the effects and mechanisms on promoting osteoblast-mediated bone formation[J]. Life Sci, 2016,147:46-58.
[11] Keulers TG, Schaaf MBE, Rouschop KMA. Autophagy-dependent secretion: contribution to tumor progression[J]. Front Oncol, 2016,6:251.
[12] Dancourt J, Melia TJ. Lipidation of the autophagy proteins LC3 and GABARAP is a membrane-curvature dependent process[J]. Autophagy, 2014,10:1470-1471.
[13] Piemontese M, Onal M, Xiong J, et al. Low bone mass and changes in the osteocyte network in mice lacking autophagy in the osteoblast lineage[J]. Sci Rep, 2016,6:24262.
[14] Zhang WL, Meng HZ, Yang RF, et al. Melatonin suppresses autophagy in type 2 diabetic osteoporosis[J]. Oncotarget, 2016,7(32):52179-52194.
[15] Yang F, Zhang L, Gao Z, et al. Exogenous H2S protects against diabetic cardiomyopathy by activating autophagy via the AMPK/mTOR Pathway[J]. Cell Physiol Biochem, 2017,43(3):1168-1187.
[16] Shi X, Zhu H, Zhang Y, et al. XuefuZhuyu decoction protected cardiomyocytes against hypoxia/reoxygenation injury by inhibiting autophagy[J]. BMC Complement Altern Med, 2017,17(1):325.
[17] 曾祥偉,馮倩,張瑩瑩,等.葛根素對MC3T3-E1細胞增殖、分化和礦化及TRPM3 mRNA表達的影響[J].中國藥理學通報, 2017,33(7):977-982.

