兒茶素及表兒茶素對老化啤酒中晚期糖基化終末產物的抑制作用
陳媛媛,李艷麗,羅 慶,唐詩淼,馮年捷,趙今月,4,鐘曉凌,吳 茜*
(1.湖北工業大學 生物工程與食品學院,湖北 武漢 430068;2.三峽食品藥品檢驗檢測中心,湖北 宜昌 443005;3.湖北工業大學 材料與化學工程學院,湖北 武漢 430068;4.隨州市二月風食品有限公司,湖北 隨州 431518)
非酶糖基化(nonenzymatic glycosylation,NEG)是一系列復雜的非酶促反應,又稱美拉德反應(Maillard reaction),是還原糖和游離氨基酸殘基在非酶促條件下反應形成Schiff堿和Amadori產物等早期糖基化產物,進而經過氧化、重排、交聯等過程,形成不可逆的非酶糖基化終產物advanced glycosylation end products,AGEs),也是食品加工、儲藏和運輸過程中發生的重要反應之一[1]。非酶糖基化反應在生物體內廣泛而緩慢地進行著,其可導致蛋白質功能降低和老化,進而使機體組織發生衰老和病變。AGEs是一組具有熒光性和非熒光性結構的復雜異質產物如Nε-羧甲基賴氨酸(Nε-carboxymethyl lysine,CML),Nε-羧乙基賴氨酸(Nε-carboxyethyl lysine,CEL),戊糖苷,精氨嘧啶(argpyrimidine,ArgP),乙二醛賴氨酸二聚體和甲基乙二醛賴氨酸二聚體等[2])。外源性AGEs(食品中)是內源性AGEs(體內)的重要來源,外源性AGEs約有10%進入血液循環,其中1/3通過腎臟排出,剩余2/3通過共價鍵與組織結合蓄積在體內,進而誘發各種疾病(如阿爾茨海默病、動脈粥樣硬化或糖尿病及其眾多并發癥[3])。
隨著經濟全球化發展,啤酒運輸儲存周期加長。已有研究表明,因含有多種氨基酸及碳水化合物,啤酒老化過程中會形成種類繁多的α-二羰基化合物并富集大量AGEs。RAKETE S等[4]研究表明,在50℃老化2周的啤酒中乙二醛為4.98 μmol/L,甲基乙二醛為2.2 μmol/L,N-甲酰脯氨酸含量為3.08μmol/L,N-羧甲基脯氨酸為0.37μmol/L(乙二醛和甲基乙二醛為產生AGEs的中間體,N-甲酰脯氨酸和N-羧甲基脯氨酸為AGEs代表物)。目前,工業上主要采用二氧化硫抑制羰基化合物的形成,從而抑制AGEs,提高啤酒的抗老化能力,但二氧化硫帶有刺激性氣味,會影響啤酒的口感[5]。其他常見的AGEs抑制劑如氨基胍(aminoguanidine,AG)、二甲雙胍、替尼司坦、維生素B6和肌肽等也都存在一定的副作用,如AG引起胃腸道功能紊亂、破壞肺功能以及引起血管炎等[6]。因此,尋找安全高效的天然AGEs抑制劑已成為本領域研究的熱點。已有研究表明,白藜蘆醇等類黃酮化合物對模擬生理條件下非酶糖化反應有較強的抑制作用[7]。
原花青素廣泛存在于植物界,是目前國際上公認的最有效的天然抗氧化劑,具有很強的生物學活性,如降血糖、抗癌、抗衰老和預防心血管疾病等。原花青素具有較強的抗氧化活性,因此對AGEs具有潛在的抑制作用。自然界中的原花青素由不同數量的(+)-兒茶素(catechin,CC)、(-)-表兒茶素(epicatechin,EC)及其衍生物結合而成,因單體連接方式的不同,可分為A-型(C2-O-C7或C2-O-C5連接)和B-型(C4-C8或C4-C6連接)兩種[8]。由于聚合度、縮合鍵位以及聚合物立體構象不同,原花青素的抗氧化活性各不相同。大多數實驗都是基于模擬體系進行的研究,然而,在真實食品體系中對原花青素抑制AGEs的報道甚少,本研究對此進行了初探,利用啤酒老化體系來研究不同構象原花青素單體對啤酒老化過程中產生AGEs的抑制作用,這對于保障啤酒銷售過程中的安全和消費者的健康至關重要,從而進一步促進了我國啤酒產業的發展。
1 材料與方法
1.1 材料與試劑
啤酒(清爽8度330 mL聽裝):華潤雪花啤酒(中國)投資有限公司;兒茶素、表兒茶素、甲酸(色譜純)、甲醇(色譜純)、三氟乙酸(色譜純):美國Sigma-Aldrich公司;氨基胍鹽酸鹽:上海麥克林生化科技有限公司;牛血清白蛋白(bovineserumalbumin,BSA):上海源葉生物科技有限公司;碳酸氫鈉、福林酚、考馬斯亮藍G-250、磷酸(85%)、乙醇、葡萄糖、麥芽糖、磷酸二氫鈉、沒食子酸:中國醫藥集團總公司;疊氮鈉:天津市福晨化學試劑廠;羧甲基賴氨酸(純度98%):加拿大TRC公司。實驗所用試劑無特殊說明,均為分析純。
1.2 儀器與設備
ME55電子天平:梅特勒-托利多儀器(上海)有限公司;CT15RE離心機:日本日立公司;XW-80A微型渦旋混合儀:上海瀘西分析儀器廠有限公司;UV-1601紫外可分光光度計:北京瑞麗分析儀器有限公司;SB-5200DT超聲波清洗劑:寧波新芝生物科技股份有限公司;RF5301熒光分光光度計:日本島津公司;TSQ ENDURA高效液相色譜-串聯質譜(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)聯用儀:美國Thermo公司;RE-111旋轉蒸發儀:瑞士Buchi公司。
1.3 實驗方法
1.3.1 樣品的配制
750 mL啤酒經超聲波清洗儀除去氣泡后,加入0.146 g疊氮鈉(3 mmol/L,抑菌劑)。準確稱取0.025 g的CC或EC,用超聲后的啤酒分別定容至50mL,作為CC或EC母液,質量濃度為0.50mg/mL。將母液用啤酒稀釋成不同質量濃度的反應液,最后使反應液中CC或EC質量濃度分別為0.01mg/mL、0.05 mg/mL、0.10 mg/mL、0.20 mg/mL和 0.30 mg/mL,反應液總體積為5 mL。本實驗用加入相同濃度AG的反應液作為陽性對照組,不加原花青素不加熱反應液作為空白組,不加原花青素反應液作為對照組,每組設置3個平行。將反應液分別裝入10 mL帶蓋玻璃瓶中,在50℃培養箱分別避光孵育,分別于2 d和5 d進行檢測。
1.3.2 兒茶素及表兒茶素對啤酒老化過程中熒光性AGEs生成的抑制效果
取0.4 mL反應液需迅速置于冰水浴中,以防止反應繼續進行,再加入相應pH(pH 4.5)的磷酸鹽緩沖液(phosphate buffer solution,PBS)(以防止熒光猝滅效應)稀釋20倍。稀釋后的反應液用熒光分光光度計(激發波長為370nm,發射波長為440nm,入射和出射狹縫寬度為5nm,電壓為700V)測定其熒光吸收強度。用上述方法測得的熒光強度,取平均值后用以下公式對抑制率進行計算:式中:F樣品為加入原花青素且加熱反應液稀釋后的熒光強度;F對照為不加原花青素且加熱反應液稀釋后的熒光強度;F空白為不加原花青素且不加熱反應液稀釋后的熒光強度。
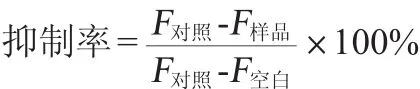
1.3.3 兒茶素及表兒茶素對老化啤酒中蛋白含量的影響
采用李志江[9]的方法,進行適當的修改。取25℃、6 000 r/min條件下離心15 min的上清液,加入5 mL考馬斯亮藍G-250蛋白試劑,充分混合均勻,放置2~3 min,用紫外分光光度計在波長595 nm處進行比色。
1.3.4 兒茶素及表兒茶素對老化啤酒中總酚含量的影響
采用趙曉娟等[10]的方法,進行適當的修改。取0.05 mL離心后反應上清液于帶塞試管中,加入0.45 mL pH 4.5的PBS,將其稀釋10倍后加入2.5 mL 10%福林酚溶液,充分混勻,再依次加入1 mL 15%碳酸鈉溶液和1 mL蒸餾水,混勻后避光反應1h。反應液用紫外分光光度計在波長760nm處進行比色,參比溶液將1mL樣品替換成1mLpH4.5的PBS。
1.3.5 兒茶素及表兒茶素對老化啤酒色度的影響
將離心后反應上清液注入10 mm玻璃比色皿中,以蒸餾水為空白調零,在波長為430 nm處測量其吸光度值,換算成EBC色度公式[11]如下:
色度(EBC)=10×1.27×A430nm-1.2
1.3.6 兒茶素及表兒茶素對啤酒老化過程中CML生成的HPLC-MS/MS分析檢測[12-14]
稱取1.0 mg標準品,置100 mL棕色容量瓶中,用去離子水配制成10 μg/mL的標準儲備液,于4℃下保存。檢測時用去離子水稀釋標準溶液,配制成不同質量濃度的CML標準工作液。通過逐級稀釋得到不同質量濃度的標樣溶液,CML標樣質量濃度分別為:0.01 μg/mL,0.05 μg/mL,0.10μg/mL,0.25μg/mL、0.50μg/mL。過水相濾膜,待HPLCMS/MS分析檢測。
取0.5 mL反應液加入0.5 mL硼氫化鈉溶液(0.2 mol/L,pH 13~14)還原,得到乳濁劑,樣品在4℃還原10 h后,在4℃、15000r/min條件下離心60min,收集上清液。取0.5mL上清液通過預活化后的PCX固相萃取柱(預活化條件:依次3 mL蒸餾水和3 mL蒸餾水沖洗柱芯),再依次用3 mL蒸餾水3 mL甲醇沖洗。用甲醇(含5%氨水)洗脫出目標化合物,旋轉蒸發儀除去甲醇后復溶于2 mL 0.1%的甲酸水溶液中,分析前通過0.22 μm有機系濾膜過濾,待HPLC-MS/MS分析檢測。
高效液相色譜條件:流動相A為0.02%三氟乙酸水溶液,流動相B為乙腈,進樣量10 μL,流速為0.2 mL/min,柱溫30℃,梯度洗脫條件為0~0.5 min為90%A,0.5~4.0 min為90%~60%A,運行時間為14 min。
質譜條件:正離子電噴霧離子化(electrospray ionizaion,ESI+);離子源溫度為300 ℃;毛細管電壓為4 kV;一級質譜四級桿溫度和二級質譜四級桿溫度均為100℃;多反應監測(multiple reaction monitoring,MRM)模式的設置為m/z205.0→m/z84.22,m/z205.0→m/z130.11。
1.3.7 分子對接
在ZINC數據庫(http://zinc.docking.org)中下載兒茶素和表兒茶素的分子結構模型(ID:119983和119988)。CML的晶體結構由Sybyl 2.1.1軟件畫出。再用Tripos力場和Gasteiger-Huckell電荷優化分子的幾何結構。用Sybyl 2.1.1軟件對CML分別與兒茶素和表兒茶素進行了分子對接。在對接過程中,考慮了化合物的20個構象,取對接打分最高的進行進一步分析。
1.3.8 統計數學分析
采用SPSS v21.0軟件進行相關性和顯著性分析,所有樣品進行3次測定(n=3),結果用平均值±標準偏差(X±SD)表示,兩組數據間顯著性差異表示為P<0.05。繪圖通過OriginPro 8.0軟件完成。
2 結果與分析
2.1 兒茶素及表兒茶素對啤酒老化過程中熒光性AGEs生成的抑制效果
不同原花青素低聚體對啤酒老化產生AGEs抑制效果如圖1所示,CC、EC及AG對AGEs的抑制效果隨著質量濃度的增大而增大,呈劑量依賴性且有顯著性影響(P<0.05)。老化2 d抑制率達到最大,CC可達到(62.27±2.80)%,EC可達到(54.99±0.441)%。由圖1A可知,老化2 d后,CC對老化啤酒中AGEs的生成的半抑制濃度(half maximal inhibitory concentration,IC50)為(0.211±0.015)mg/mL,EC的IC50為(0.270±0.022)mg/mL,AG的IC50為(0.497±0.009)mg/mL。由圖1B可知,CC對啤酒中AGEs的生成的IC50為(0.289±0.008)mg/mL,EC的IC50為(0.329±0.018)mg/mL,AG的IC50為(0.552±0.010)mg/mL。結果表明,在啤酒分別老化2 d和5 d后,CC及EC比陽性對照AG抑制同期老化產生的AGEs的作用要強。并且,CC的抑制作用比EC強。對于多酚類物質抑制AGEs機制,國外有研究報道[20]稱,多酚類物質具有清除自由基的能力,抑制了AGEs形成的中間階段,即多酚類物質捕獲美拉德反應中間產物—Amadori產物(如α-二羰基化合物),從而阻止了AGEs的形成。
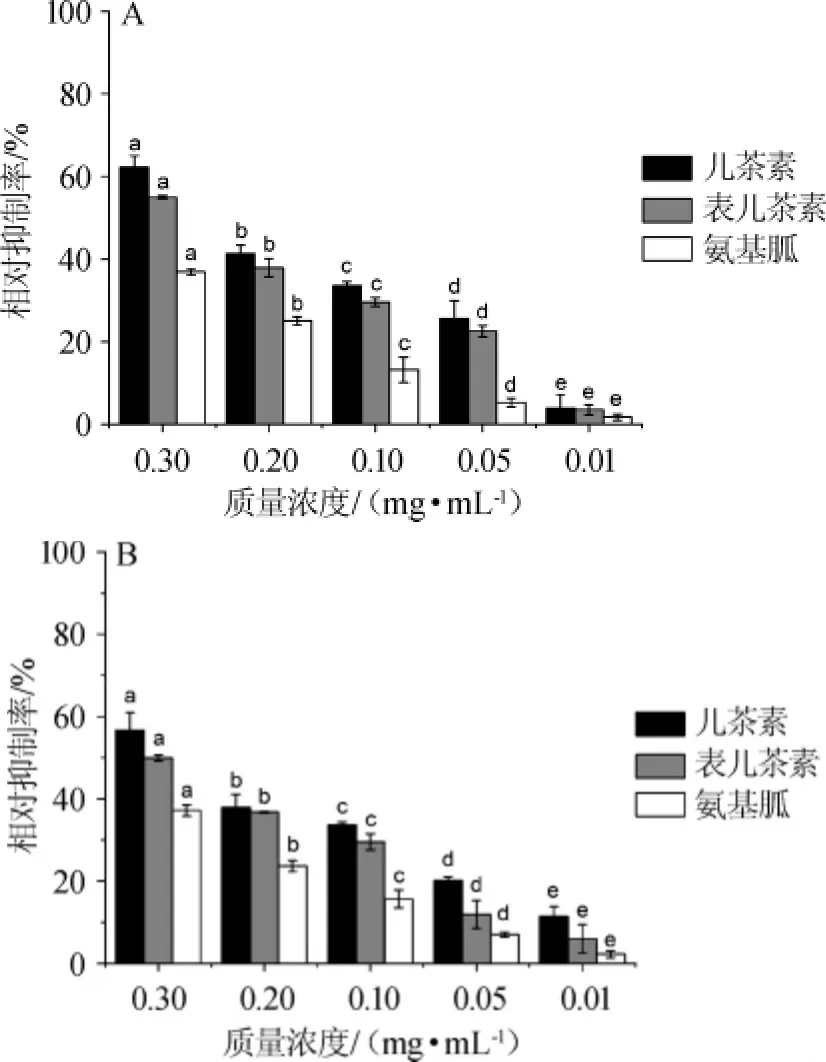
圖1 不同含量的兒茶素及表兒茶素對啤酒老化2 d(A)及5 d(B)過程中AGEs生成的抑制效果Fig.1 Inhibitory effect of different concentrations of CC and EC on AGEs production during beer aging process for 2 d(A)and 5 d(B)
2.2 兒茶素及表兒茶素對老化啤酒中蛋白含量的影響
由表1可知,加入高濃度的原花青素老化啤酒的蛋白含量會稍大于加入低濃度原花青素的,是由于測量樣品數較大,每個樣品反應的時間有差異。反應時間過長,則染液蛋白復合物會形成可見的沉淀,吸光度值會降低,會影響實驗的精確性[15]。隨著啤酒的老化,美拉德反應的加劇,啤酒中的蛋白一部分成為糖化蛋白,一部分與多酚耦合形成絮狀沉淀,但是總含量不變,因此不同濃度的原花青素對老化啤酒中蛋白的含量沒有顯著性影響(P>0.05)。

表1 不同含量的兒茶素及表兒茶素對啤酒老化過程中蛋白含量的影響Table 1 Effects of different concentrations of CC and EC on protein contents during beer aging process
2.3 兒茶素及表兒茶素對老化啤酒中總酚含量的影響

表2 不同含量的兒茶素及表兒茶素對啤酒老化過程中總酚含量的影響Table 2 Effects of different concentrations of CC and EC on total phenols contents during beer aging process
大麥和酒花是啤酒中多酚的重要來源,其中80%左右來源于大麥,20%左右來源于酒花[16]。由表2可知,啤酒中本身含有的總酚含量為(0.211±0.001)mg/mL,隨著添加的CC和EC質量濃度的增大,啤酒中總酚含量隨之增大,且有顯著性差異(P<0.05)。添加量為0.30 mg/mL時,啤酒的總酚含量達到最大,第0、2、5天加入CC老化啤酒總酚含量最高分別可達(0.564±0.035)mg/mL、(0.558±0.024)mg/mL、(0.560±0.019)mg/mL。第0、2、5天加入EC老化啤酒總酚含量最高可達(0.561±0.021)mg/mL、(0.564±0.025)mg/mL、(0.556±0.006)mg/mL。
2.4 兒茶素及表兒茶素對老化啤酒色度的影響
由表3可知,隨著啤酒的老化,不加抑制劑的啤酒色度由最初(0.756±0.034)EBC增加至(4.185±0.008)EBC,這是由于啤酒在老化過程中美拉德反應加劇,顏色加深。加入原花青素后,啤酒色度隨抑制劑濃度的增大而增大,且有顯著性變化(P<0.05)。第5天時,加入了CC的老化啤酒,色度達到最大(6.534±0.007)EBC,是最初色度的1.5倍,因為其水溶液在加熱條件下溶液通過縮合形成無定型鞣質,鞣質在溶液中容易被氧化,顏色變暗[17],增加了啤酒的色度。而陽性對照AG添加量對啤酒色度無顯著性影響(P<0.05)。
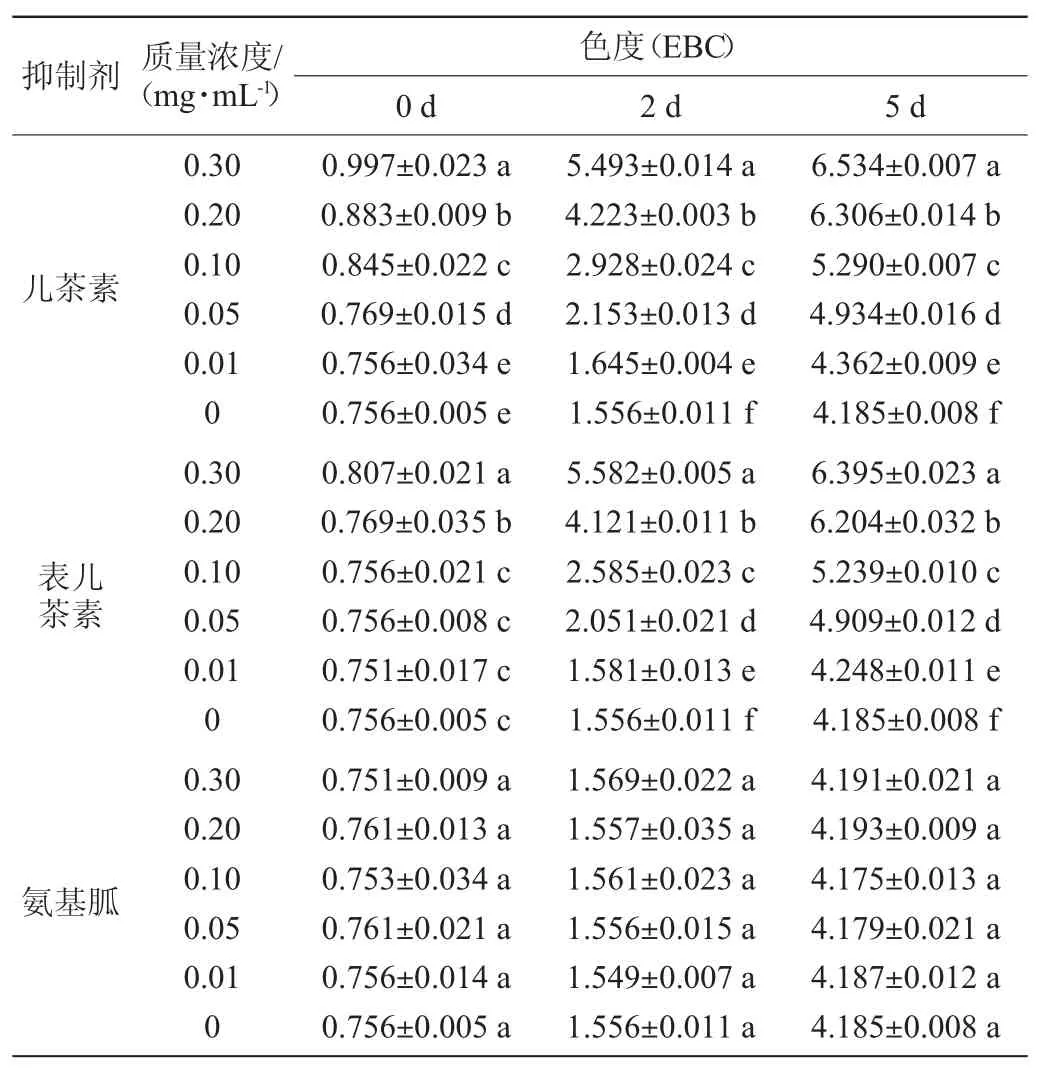
表3 不同含量的兒茶素及表兒茶素對老化啤酒色度的影響Table 3 Effects of different concentrations of CC and EC on the chromaticity during beer aging process
2.5 兒茶素及表兒茶素對啤酒老化過程中CML生成的抑制
經計算得Nε-羧乙基賴氨酸標準曲線,回歸方程為y=-211 445.3+3 782 080x,相關系數R2=0.999 7,CML的質譜圖見圖2。由圖2可知,經二級質譜解析,得到定性和定量離子碎片m/z=84.2和130.1。由圖3可知,隨著原花青素質量濃度的增大,對CML抑制效果越好,且EC的抑制效果要好于CC的抑制效果。CC對其抑制率最大可達(8.67±0.23)%,EC對其抑制率最大可達(9.68%±0.83)%。
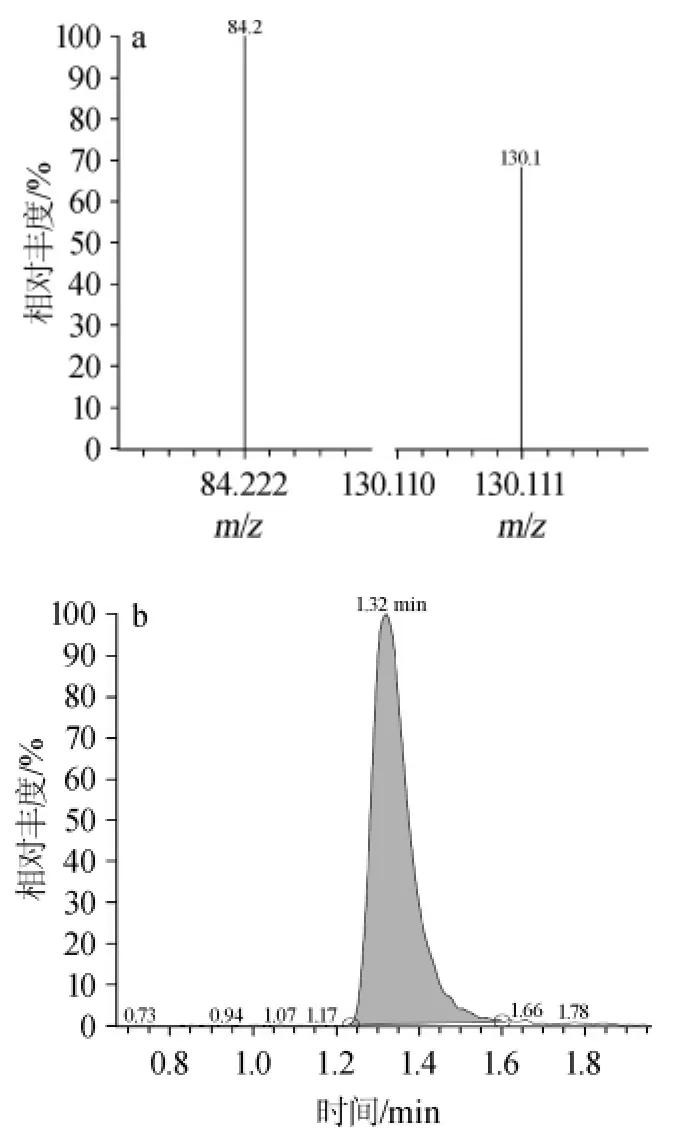
圖2 應用HPLC-MS/MS法檢測Nε-羧甲基賴氨酸的離子質譜圖(A)及色譜圖(B)Fig.2 Ion mass spectrogram(A)and chromatogram(B)for Nε-carboxy methyl lysine analysis by HPLC-MS/MS
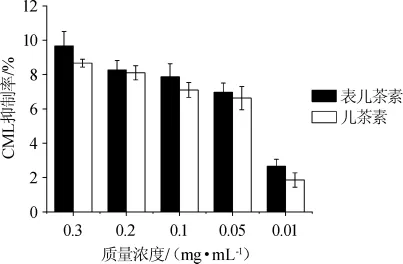
圖3 不同的兒茶素及表兒茶素對老化啤酒中Nε-羧甲基賴氨酸的抑制效果Fig.3 Inhibition effects of different concentrations of CC and EC on Nε-carboxy methyl lysine during beer aging process
2.6 分子對接
CC/EC與CML的分子對接結果如圖4所示,經軟件計算CML與CC對接打分為1.006 9,CML與EC對接打分為1.514 2,說明表兒茶素與CML結合時所需的自由能更低,更易與CML結合,以致EC抑制CML的效果比CC好。
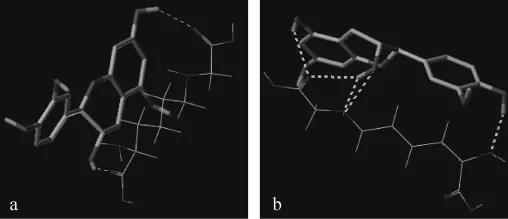
圖4 兒茶素及表兒茶素與Nε-羧甲基賴氨酸分子對接結果Fig.4 Molecular docking results between CC and Nε-carboxyethyl lysine,EC and Nε-carboxy methyl lysine
3 討論
啤酒在長期儲存的過程中會發生老化,不僅影響了啤酒的風味,同時會產生AGEs,危害人體的健康。原花青素是一種天然抗氧化劑,但作為食品添加劑的應用報道較少。WU Q等[18]研究發現,在模擬生理環境條件下,對低聚原花青素與AG的抑制效果進行了比較,相同質量濃度(1 mg/mL)時,低聚原花青素抑制率為(111.26±0.43)%,AG抑制率為(57.20±1.96)%,低聚原花青素的抑制效果明顯高于AG。
綜合上述實驗結果可得,在模擬啤酒老化過程中,加入原花青素對老化過程中產生熒光性AGEs的作用呈劑量依賴性,且在老化第2天和第4天后,原花青素的抑制效果都要比AG好,并且兒茶素的抑制效果要稍好于表兒茶素的效果。在YOKOZAWA T等[19]的研究中得到了相似的結果,CC和EC抑制BSA-葡萄糖(果糖)反應體系中的熒光性AGEs的能力高于AG(pH7.4,37℃孵育14 d),并且CC的抑制效果要好于EC。說明原花青素是代替AG的良好天然AGEs抑制劑。本實驗對原花青素對啤酒非生物穩定性作出探討,在老化過程中,原花青素對啤酒蛋白含量無顯著影響,對啤酒總酚含量呈劑量依賴性,原花青素含量越高啤酒顏色越深。用分子對接闡述了CC和EC對與CML的結合情況,結果得出,EC抑制CML的效果比兒茶素強是由于在與CML結合時所需的自由能更低。本實驗研究了原花青素抑制啤酒老化過程中產生的AGEs,為原花青素作為食品添加劑提供了新思路,同時也可以提高對天然產物的開發和利用。
4 結論
本實驗探究了原花青素抑制啤酒老化過程中產生AGEs的情況,不同濃度的原花青素加入啤酒中,老化2 d和5d后,對啤酒中熒光性AGEs抑制效果CC>EC>AG。對啤酒蛋白含量無顯著影響(P>0.05),對啤酒總酚和色度有顯著性影響(P<0.05),且呈劑量依賴性。對CML的抑制效果為EC>CC。
[1]SARAH N,MIRELA P,LUCIAN G.Early glycation products of endothelialplasma membrane proteins in experimental diabetes[J].Biochimica Biophysica Acta Biomembr,2006,1762(1):94-102.
[2]ROJAS A,MORALES M A.Advanced glycation and endothelial functions:A link towards vascular complications in diabetes[J].Life Sci,2004,76(7):715-730.
[3]GRILLO M A,COLOMBATTO S.Advanced glycation end-products(AGEs):involvement in aging and in neurodegenerative diseases[J].Amino Acid,2008,35(1):29-36.
[4]RAKETE S,KLAUS A,GLOMB M A.Investigations on the Maillard reaction of dextrins during aging of Pilsner type beer[J].J Agric Food Chem,2014,62(40):9876-9884.
[5]林智平,馮景章,顧國賢.提高麥汁還原力對啤酒風味穩定性的影響[J].食品與發酵工業,2003,29(11):51-54.
[6]GRZEBYK E,PIWOWAR A.Inhibitory actions of selected natural substances on formation of advanced glycation end products and advanced oxidation protein products[J].BMC Complem Altern Med,2016,16(1):381-390.
[7]SHEN Y X,XU Z M,SHENG Z W.Ability of resveratrol to inhibit advanced glycation end product formation and carbohydrate-hydrolyzing enzyme activity,and to conjugate methylglyoxal[J].Food Chem,2017,216(1):153-160.
[8]AMBIGAIPALAN P,DE CAMARGO A C,SHAHIDI F.Phenolic compounds of pomegranate byproducts(outer skin,mesocarp,divider membrane)and their antioxidant activities[J].J Agric Food Chem,2016,64(34):6584-6604.
[9]李志江.考馬斯亮藍G250染色法測定啤酒中蛋白質含量[J].釀酒,2008,35(1):70-72.
[10]趙曉娟,李敏儀,黃桂穎,等.Folin-Ciocalteu法測定蘋果醋飲料的總多酚含量[J].食品科學,2013,34(8):31-35.
[11]董小雷,崔云前,周廣田.啤酒分析檢測技術[M].北京:化學工業出 版社,2008:140-143.
[12]WU Q,LI S,FU X,et al.Spectroscopic studies on binding of lotus seedpod oligomeric procyanidins to bovine serum albumin[J].J Appl Spectrosc,2014,80(6):884-892.
[13]ASSAR S H,MOLONEY C,LIMA M,et al.Determination of Nepsilon-(carboxymethyl)lysine in food systems by ultra performance liquid chromatography-mass spectrometry[J].Amino Acids,2009,36(2):317-326.
[14]YOON S R,SHIM S M.Inhibitory effect of polyphenols inHouttuynia cordata on advanced glycation end products(AGEs)by trapping methylglyoxal[J].LWT-Food Sci Technol,2015,61(1):158-163.
[15]杜 芳.啤酒泡沫蛋白的分離鑒定及啤酒生產中硅膠應用的研究[D].濟南:齊魯工業大學,2013.
[16]王志堅.啤酒中的多酚物質[J].食品工業,2003(4):16-18.
[17]徐 勤.鞣質的研究進展[J].華夏醫學,2004,17(1):113-115.
[18]WU Q,CHEN H,LV Z,et al.Oligomeric procyanidins of lotus seedpod inhibits the formation of advanced glycation end-products by scavenging reactive carbonyls[J].Food Chem,2013,138(2):1493-1502.
[19]YOKOZAWA T,NAKAGAWA T.Inhibitory effects of Luobuma tea and its components against glucose-mediated protein damage[J].Food Chem Toxicol,2004,42(6):975-981
[20]WU J W,HSIEH C L,WANG H Y,et al.Inhibitory effects of guava(Psidium guajavaL.)leaf ex-tracts and its active compounds on the glycation process of protein[J].Food Chem,2009,113(1):78-84.

