鋰離子電池高溫熱模擬及熱行為
黃文才,胡廣地,張 琦,周鵬凱
(西南交通大學汽車研究院,四川 成都 610031)
鋰離子電池在高溫情況下,受到環境溫度和對流傳熱系數的影響,表面溫度升高,會引發內部的多種化學反應,造成產熱量大于散熱量,使溫度發生急劇變化,導致發生安全問題。S.Al Halaj等[1]建立簡單的一維熱模型,計算18650型電池內部的溫度變化,以集中質量模型為參考并通過絕熱加速量熱儀(ARC)計算電池在不同放電倍率下熱失控時的溫度,證明模型的可行性。T.D.Hatchard等[2]研究電池在熱失控時熱輻射的影響,認為電池在爐箱試驗工況下不能忽略熱輻射,針對圓柱形鋰離子電池,以集中質量模型為基礎,建立熱失控模型,使用該模型仿真爐箱試驗中的溫度變化情況;張志杰等[4]對不同放電倍率下鋰離子動力電池的溫升特性進行數值分析,發現在高倍率下持續放電,會引起電池溫度升高,以致超過安全工作的溫度上限,會對電池的性能和使用壽命產生很大的影響。
目前,基于數值模擬方法對鋰離子電池熱安全性進行研究,對象大多為圓柱形電池,以集中質量模型為主,考慮方形鋰離子電池和分層模型的較少。分層模型比集中質量模型復雜,同時,當前方形鋰離子電池的應用越來越廣泛。
本文作者對三維方形三元鋰離子電池進行分層建模,采用電化學耦合原理,加入副反應方程研究爐箱加熱工況下電池溫度變化及內部反應特征。通過實驗操作和模擬分析,得到鋰離子電池在高溫下表面溫度分布和內部副反應的特征,從環境溫度和對流強度來分析鋰離子電池的性能。
1 模型的建立和數值求解
1.1 建立三維鋰離子單體分層模型
實驗用IHP41188236型方形鋰離子單體電池(四川產)主要包括5個部分:正極集流體(鋁)、正極(活性物質為鎳鈷錳酸鋰LiNi0.5Co0.2Mn0.3O2)、隔膜(高強度薄膜化的聚烯烴多孔膜)、負極(活性物質為石墨)和負極集流體(銅)。
1.2 能量守恒方程
鋰離子電池中的熱源反應遵守能量守恒方程見式(1)。
ρ·cp(?T/?t)=▽k·▽T+Q
(1)
式(1)中:ρ為電池材料的密度,kg/m3;cp為電池材料的比熱容,J/(kg·K);T為溫度,K;t為時間,s;k為熱導率,W/(m·K);Q為發生副反應過程中電池內部各項放熱反應的單位體積熱生成速率,W/m3;▽表示散度。電極的物理性能參數和組分體積比例分別列于表1和表2中。
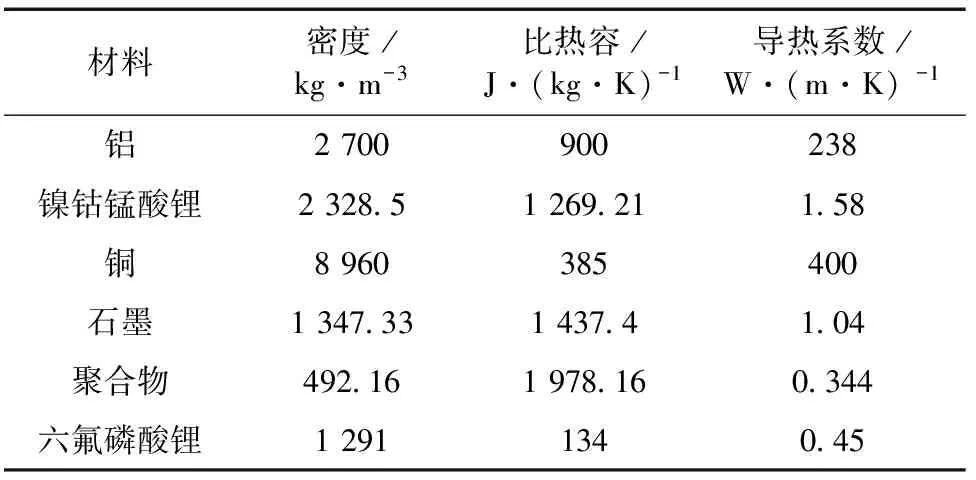
表1 電池材料的物理性能參數
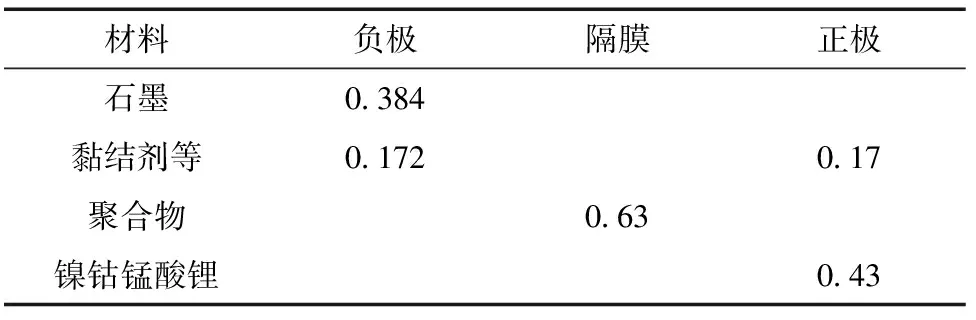
表2 電極和隔膜中的容積組分
1.3 副反應熱源方程
根據G.H.Kim等[5]對三維電池熱濫用模型驗證和總結得出的副反應熱源方程,將副反應方程模塊設置在電池模型的各個計算域中模擬反應熱源,通過設置邊界條件模擬加熱電池,分析觀察電池溫度變化。
1.3.1 固液膜分解反應
固液膜分解反應主要發生在負極和電解液之間,主要放熱原理為[5]:
Qsei=Hsei·Wc·Rsei
(2)
Rsei(T,csei)=Asei·exp(-Ea,sei/RT)·cseimsei
(3)
dcsei/dt=-Rsei
(4)
式(2)—(4)中:下標sei表示固體電解質相界面(SEI)膜;H為反應的單位放熱量,2.57×105J/kg;Wc為碳的含量,1.39×103kg/m3;R為反應速率,s-1;A為反應的指前因子,1.7×1015s-1;Ea為反應活化能,1.4×105J/mol;R為氣體常數,m為反應級數,取1;csei為SEI膜中不穩定鋰所占的比值,初始值csei0值取0.15。
1.3.2 負極與電解反應
負極石墨材料中,嵌入的鋰與電解液直接發生反應放熱,放熱原理為[5]:
Qne=Hne·Wc·Rne
(5)
Rne(T,ce,cne,tsei)
(6)
dtsei/dt=Rne
(7)
dcne/dt=-Rne
(8)
式(5)—(8)中:下標ne表示負極;H為1.710 6 J/kg;A為2.510 13 s-1;m取1;cne為嵌入碳負極的鋰中可以與電解液反應的比例,初始值cne0值取0.75;tsei為SEI膜厚度與活性物顆粒特征尺寸之比,初始值tsei0取0.033。
1.3.3 正極材料與電解液反應
正極材料與電解液發生反應放熱,放熱原理為[5]:
Qpe=Hpe·Wp·Rpe
(9)
Rpe(T,α,ce)
(10)
dα/dt=Rpe
(11)
式(9)—(11)中:下標pe表示正極;H為3.15×105J/kg;Wp為正極活性物質的含量,1.3×103kg/m3;A為6.7×1013s-1;mp1和mp2取1;α為正極轉化率,初始值α0取0.04。
1.3.4 電解液分解反應
電解液開始分解,主要集中在分隔膜區,放熱原理為[5]:
Qe=He·We·Re
(12)
(13)
dce/dt=-Re
(14)
式(12)—(14)中:下標e表示電解液;H為1.6×105J/kg;We為正極活性物質的含量,5×102kg/m3;A為5.14×1025s-1;Ea為2.74×105J/mol;m取1;ce為電解液中未發生分解反應的比例,初始值ce0取1。
能量守恒方程的熱量主要來自副反應方程。
1.3.5 對流換熱方程
高溫加熱熱量傳遞給電池造成電池溫度升高,引起電池的溫升。換熱邊界條件方程可以為:
qconv=h(Tsurf-Tamb)
(15)
式(15)中:qconv為單位面積散熱量,W/m2;h為等效傳熱系數,一般取值為0.1~50.0 W/(m2·K);Tsurf為電池外表面溫度,K;Tamb為加熱環境溫度,K。
1.4 數值模擬求解
本文作者基于COMSOL Multiphysics模擬軟件,采用有限體積法進行模擬分析,對鋰離子電池進行域劃分,將副反應參數[6]通過域微分方程設置成反應熱源,進行迭代求解。
2 結果與討論
2.1 不同環境溫度下的電池溫度變化
當傳熱系數為1.5 W/(m2·K)時,電池分別在環境溫度為350 K和448 K的溫度下加熱,溫度變化見圖1。
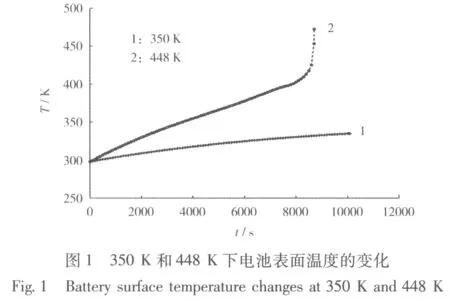
從圖1可知,在350 K的環境溫度下,電池溫度變化緩慢,最后在10 000 s附近趨于穩定;而在448 K的環境溫度下,電池溫度急劇上升,發生熱失控。這是由于電池溫度升高造成電池內部副反應發生,產生了大量的熱量。
2.2 電池內部放熱反應變化
針對上面兩種工況,分析電池內部的放熱反應的變化,研究電池副反應變化機理,如圖2所示。

從圖2(a)可知,電池內部發生了副反應,固液膜的分解反應是最先發生的,溫度達到固液膜分解的臨界點時,固液膜反應產生大量的熱,使電池溫度升高進并促使負極與電解液發生反應,產生熱量,達到一定溫度值后,逐步引發其他副反應的進行。在圖2(a)中,電池內部熱量主要來源于固液膜的分解反應熱Qsei,隨時間的變化急劇上升,其次是負極與電解液的反應熱Qne逐步增加,而正極和電解液的反應熱Qpe與電解液分解反應熱Qe,由于內部溫度沒有達到發生反應的臨界溫度而基本保持不變,趨近于零。從圖2(b)可知,電池內部的副反應幾乎全部發生,首先是固液膜的分解反應產生大量的熱,促使Qpe急劇上升,達到最大,Qne也隨之急劇變化,而Qsei隨著時間的延長先增加、后減少,主要是因為Qpe是造成電池溫度升高的主要原因,是引發電池爆炸的根源。電解液分解熱由于還沒有達到溫度臨界值,相對其他三者的放熱量較小,幾乎可不計,在圖2(b)中縱軸值趨近于0附近,但并不為零。合理選取熱穩定的正極材料,可避免和減少熱安全問題,同時要避免電池在高溫環境下工作,設計合理的熱管理措施,對電池進行冷卻。
2.3 不同傳熱系數對電池溫度的影響
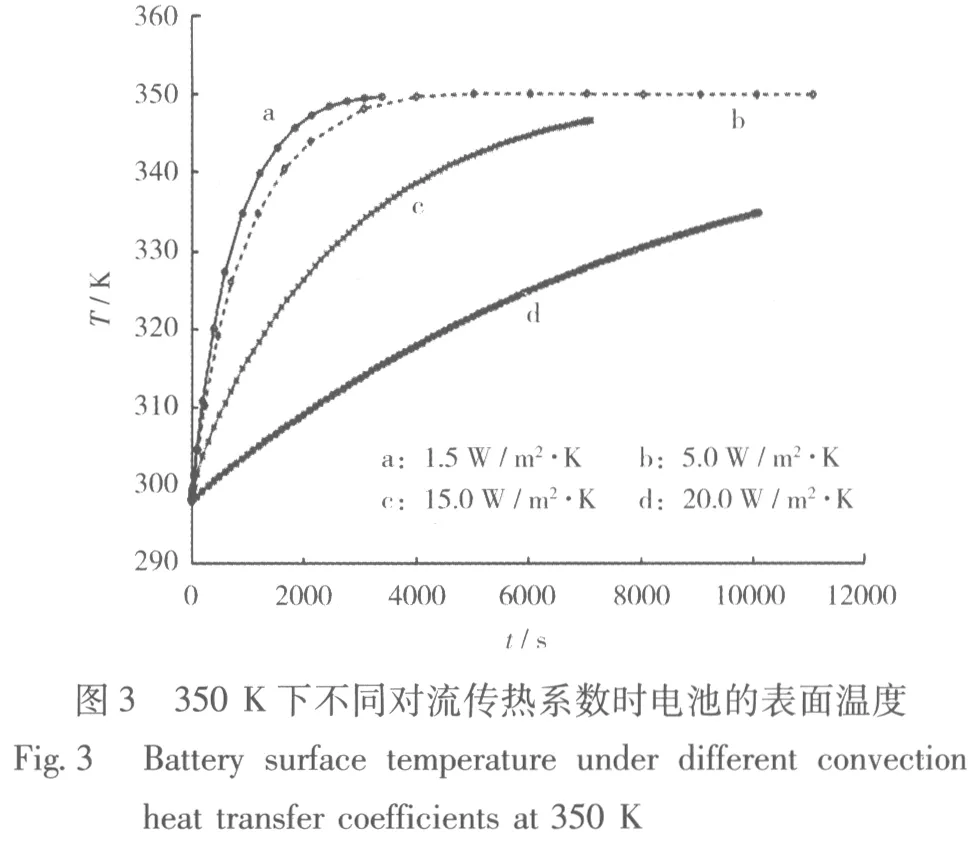
環境溫度加熱將熱量傳遞給電池,造成電池溫度升高。通過數值模擬,分析相同環境下傳熱系數的變化對電池熱行為的影響。當環境溫度為350 K時,不同對流傳熱系數時電池的溫度見圖3。

從圖3可知,當環境溫度為350 K時,不同對流傳熱系數下電池溫度的變化是不同的,熱系數越小,電池溫度達到穩定的時間越長,溫度變化率越小。當h=1.5 W/(m2·K)時,電池達到穩定溫度所需時間最長,約需10 000 s;當h=20.0 W/(m2·K)時,溫度約在2 000 s時就能穩定。
2.4 實驗數據和模擬結果對比
用實驗設備對鋰離子電池進行加熱,當溫度達到所需實驗溫度(350 K和448 K)時,控制溫度不變,在鋰離子電池表面設置多個溫度采集點(如圖4)。
為了保證實驗順利進行,需要準備3只同樣的電池進行輔助實驗。

通過熱電偶數據記錄儀,記錄加熱過程中溫度隨時間變化的數據。當環境溫度350 K和448 K時,電池的溫度變化情況見圖5。
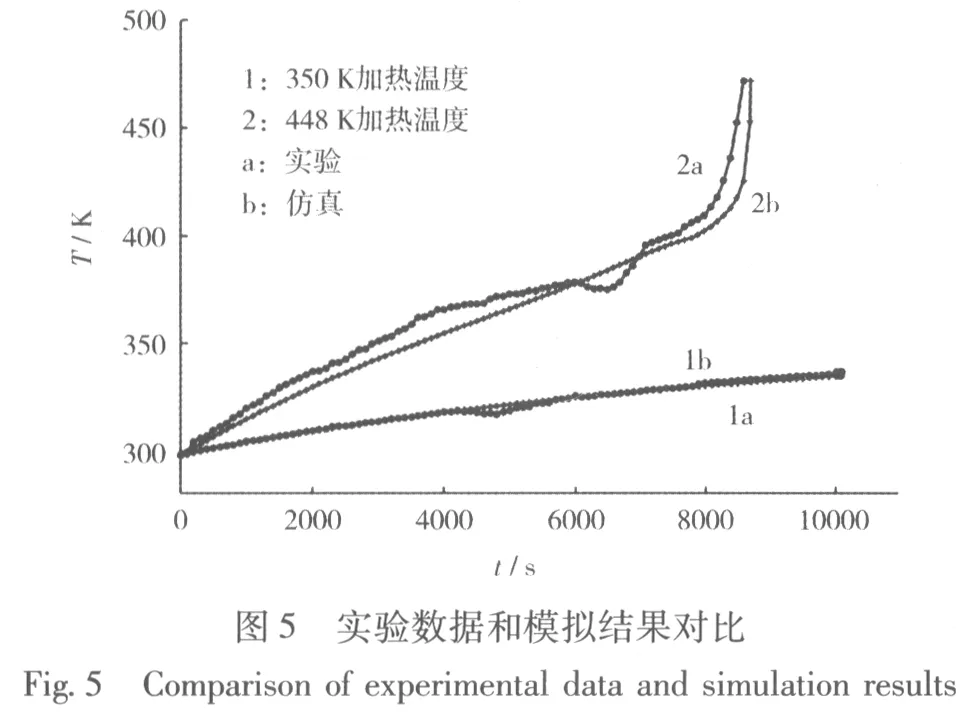
從圖5可知,實驗數據和模擬結果變化趨勢較吻合,說明該實驗建立的模型是比較可靠的。實驗數據與模擬結果還存在部分偏差,主要是由于電池表面的溫度不均勻的,取點位置的溫度差值偏大,電池材料存在部分老化等原因,造成溫度存在部分不穩定變化,引起突變。
3 結論
對鋰離子單體電池進行模擬,分析不同環境溫度工況下鋰離子電池的溫度變化以及內部副反應熱量生成機理,同時分析不同對流傳熱系數對溫度變化的影響。
模擬結果表明:當電池處于不同的環境溫度(350 K和448 K)下,環境溫度越高,電池表面溫度升高越快,當環境溫度達到較高值(448 K)時,會造成電池內部副反應的發生,產生大量的熱量,使電池溫度急劇升高,發生熱失控。
電池在高溫加熱過程中,內部的副反應受到外部環境溫度的影響,若達到臨界溫度值(如環境溫度為448 K時),會促使固液膜分解反應發生,產生大量的熱,造成電池內部各個副反應發生。在環境溫度為350 K時,鋰離子電池內部只是發生部分副反應,產生少量的熱量,不會引發電池熱失控。
不同的對流傳熱系數也是影響電池溫度變化的因素。對流傳熱系數越小,電池溫度變化緩慢,當對流傳熱系數達到一定值時,溫度變化劇烈,也容易造成電池失控。改善鋰離子電池的工作環境以及設計合理的冷卻裝置,對提高鋰離子熱安全性具有至關重要的作用。

