前房放液聯合藥物治療白內障超聲乳化人工晶狀體植入術后早期高眼壓的有效性
劉文龍 董敏
白內障的致盲率較高,同時也是臨床中十分多見的一類眼部疾病。患者接受白內障超聲乳化人工晶體植入術之后,容易出現早期高眼壓,若不能有效控制患者眼壓并緩解其不良癥狀,將導致患者視神經等高眼壓并發癥,容易造成眼部的永久性損傷[1]。常規治療方案中以藥物治療方案為主,但患者的眼壓控制效果有限。本次研究將著重探討白內障超聲乳化人工晶狀體植入術后針對患者早期高眼壓聯合應用藥物治療方案與前房放液治療的可行性及安全性。
1 資料與方法
1.1 一般資料
選擇我院2017年1月至2018年1月期間診治的行超聲乳化人工晶體植入術治療的白內障患者術后出現高眼壓120例(134眼)作為研究樣本,以隨機抽樣法將患者進行分組,每組均為60例,并分別納入至觀察組和對照組當中。觀察組:60例(66眼),男34例,女26例;患者年齡47~89歲,平均年齡(63.2±0.6)歲;術后癥狀出現時間1~3h,平均(1.3±0.4)h;眼壓32.2~44.6mmHg,平均(43.16±4.17)mmHg。對照組:60例(68眼),男32例,女28例;患者年齡44~87歲,平均年齡(62.6±0.4)歲;術后癥狀出現時間1~2.5h,平均(1.4±0.2)h;眼壓31.2~43.7mmHg,平均(40.28±3.95)mmHg。兩組病人的線性資料對比,無統計學意義(P>0.05)。
1.2 方法
對照組患者單獨采取局部藥物治療方案,甘露醇行靜脈滴注1次;馬來酸噻嗎洛爾滴眼液點滴患眼,2滴/次,2次/天;觀察組患者在此基礎上聯合采取前房放液治療,具體方法如下:應用濃度為2%的無菌利多卡因注射液對患眼表面進行局部麻醉,在裂隙燈顯微鏡輔助下應用一次性無菌針頭對角膜緣行切口,緩緩釋放出房水,并觀察患者前房深度。在放液時應確保前房深淺維持不變,例如患者虹膜中央組織出現輕微前突或者角膜存在變形時應停止放液。患者治療前后均在結膜囊內以濃度為0.3%的氧氟沙星抗生素滴眼液進行滴眼治療,每隔5min滴眼一次,共計治療3次。患者前房放液治療均由同一名醫生在發現患者高眼壓后15min內完成治療。
1.3 評價指標
利用眼壓測量儀對兩組患者治療前后的眼壓進行測量與對比;眼壓控制標準:患者的眼痛癥狀完全消失,眼壓≤21mmHg;觀察兩組患者治療后的并發癥情況。
1.4 統計學方法
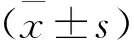
2 結果
2.1 兩組患者治療前后眼壓水平對比
兩組患者治療前眼壓水平均較高(P>0.05);治療3~48h后觀察組患者的眼壓水平下降幅度顯著高于對照組患者,兩組間差異顯著,有統計學意義(P<0.05)。見表1。
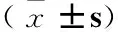
表1 兩組患者治療前后眼壓水平對比
2.2 兩組患者眼壓控制有效率對比
觀察組患者24h、48h眼壓控制有效率分別為63.64%和98.48%,顯著高于對照組患者的45.59%和76.47%,兩組間差異顯著,有統計學意義(P<0.05)。見表2。
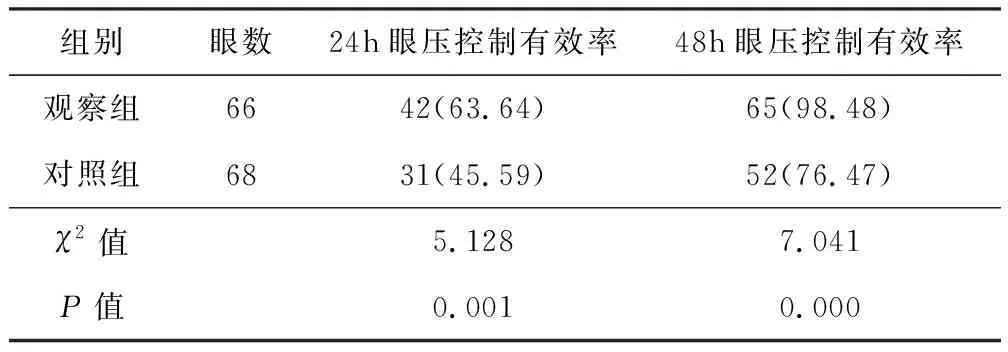
表2 兩組患者眼壓控制有效率對比[n(%)]
2.3 兩組患者并發癥情況對比
兩組患者治療期間均未出現前房出血、眼內感染、黃斑囊樣水腫、人工晶體異位等并發癥。
3 討論
白內障是臨床中的高致盲眼病,同時也是臨床中的常見眼部疾病。近年來隨著臨床醫學技術的不斷進步,以超聲乳化術為基礎的白內障治療方案得到廣泛應用。白內障超聲乳化吸除術具有良好臨床療效及安全性,該技術較為成熟,具有手術用時短、切口小、對組織產生損傷小、術后視力恢復快等優勢。然而白內障患者接受超聲乳化術與人工晶狀體植入術后容易出現高眼壓,這也是該術式十分常見的并發癥,若不能及時有效控制患者眼壓,緩解其臨床癥狀,非常容易導致視神經等相關高眼壓的永久性損傷。
3.1 術后早期高眼壓發病原因
白內障超聲乳化人工晶體植入術后患者早期高眼壓其臨床癥狀集中表現為眼部疼痛,伴隨同側偏頭痛也有部分患者并無顯著眼痛癥狀。通常在手術后第1天檢查中發現患者角膜的上皮出現彌漫性水腫,經檢測眼壓顯著升高。引起術后眼壓升高的原因較多,有報道指出[2],手術中所殘留的部分黏彈物質對小梁網產生阻塞作用,術中的超聲能量將對虹膜與角膜產生損傷。而炎性滲出物制對房角形成阻塞,進而導致眼壓升高。而角鞏膜切口和進入眼內的治療器械對房角組織產生損傷,也是引發小梁網水腫的主要原因,容易導致房水排出量減少,致使眼壓升高。也有研究指出[3],超過50%的患者出現術后高眼壓與患者與術中應用黏彈劑密切相關。本次研究發現,患者手術中黏彈劑殘留是導致術后早期高眼壓的重要原因。引起術中粘彈劑發生殘留的原因較多,例如在術中植入人工晶體之后,在進行換吸黏彈劑時,為了避免發生后囊膜裂口繼續擴大和玻璃體涌入其前房內,導致注吸不充分,而出現黏彈劑殘留[4]。其次是由于手術過程中,采取的連續環形撕囊,使得植入人工晶狀體具有居中性,連續撕囊口將對人工晶狀體的光學面產生覆蓋作用的同時,黏彈劑非常容易滯留在患者人工晶狀體之后的囊袋中。最后是在植入晶狀體時將對虹膜產生刺激,使得瞳孔縮小,引發換吸黏彈劑時不夠充分[5]。
3.2 高眼壓的臨床治療
手術后患者出現高眼壓,此類患者多數均存在顯著的眼痛和頭痛等癥狀。因此臨床醫生在發現患者高眼壓癥狀時,需在最短的時間內實現患者眼壓有效控制,以緩解其不良癥狀,減少對于患者視功能產生的損傷。臨床治療中,常采用的控制患者術后高眼壓的治療藥物包括高滲劑、β受體阻滯劑和碳酸酐酶抑制劑等[6]。應用甘露醇等相關藥物,雖然可以有效控制患者眼壓,然而此類藥物在眼壓控制速度中不甚理想。行甘露醇靜脈滴注30min以后才可以實現降壓效果。在1~2h內可達到最強作用,治療,3~4h后患者眼壓才能夠恢復到治療前的眼壓水平。若靜脈滴注藥物治療后患者眼壓仍不能有效控制,此時患者的頭痛和眼痛癥狀等均會顯著增強,需要增加患者甘露醇的滴注劑量。然而可能增加患者腎衰竭等全身疾病風險。應用噻嗎洛爾滴眼液之后30min能夠發揮降眼壓功效,2h后作用效果最顯著[7]。然而術后高眼壓應該在極短時間內迅速將眼壓水平降到正常范圍之內。白內障超聲乳化術之后患者角膜邊緣通常會存在輔助切口,因此可充分利用好該輔助切口實施房水放液。在進行房水放液之后,應立即將患者眼壓降低到正常范圍內,以確保盡快緩解病人的不良癥狀并保護其視功能[8]。放液之后患者眼壓也有可能發生再次升高的情況,因而通過聯合運用降眼壓藥物具有必要性。行側切口放液治療后,可能出現感染等并發癥。在放液治療過程中,由于患者眼內高壓的影響,房水由切口向外溢出,并不會出現房水倒流等情況。在操作過程中,使針頭不進入到患者前房,通過應用球內外形成的壓力梯度促進房水自然流出。值得注意的是在放液操作過程中,應確保動作緩慢,同時需要密切觀察患者前房的深淺,應保證前房深淺維持不變。諸如虹膜中央組織出現輕度前突或者角膜存在變形情況時,應該停止放液操作。本次研究中,觀察組患者接受前房放液治療機制之前,均采取結膜囊內滴注抗生素滴眼液治療來預防感染,再放液治療后繼續應用抗生素滴眼液進行治療。
3.3 術后高眼壓預防
白內障超聲乳化晶狀體植入手術后發生高眼壓的患者,多數均屬于手術順利完成者,為了降低后發性的白內障產生,目前臨床中在進行白內障超聲乳化手術過程中,通常采取連續光滑撕囊口[9]。撕囊口將對患者人工晶狀體的光學面產生覆蓋,同時可確保人工晶狀體位于袋囊中保持居中性。術中操作可能導致黏彈劑滯留于人工晶狀體之后,因而在手術過程中進行換吸黏彈劑時,應注意吸頭向上下左右移動,來促進晶狀體之后的黏彈劑發生前移,以便于黏彈劑的吸出。盡可能將吸頭直接伸到晶狀體后側的黏彈劑處進行換吸,此項操作有助于防止手術之后患者發生高眼壓[10]。而針對后囊破裂、皮質殘留在囊袋中、玻璃體嵌頓等患者,預防術后高眼壓原則與機制是綜合性的,可結合實際情況選擇科學的后續治療措施,控制患者眼壓水平。
本次研究中,觀察組60例患者通過前房放液治療聯合藥物方案,該組患者治療后的眼壓降低幅度顯著優于同期對照組患者,同時觀察組患者眼壓控制有效率顯著高于對照組,兩組患者治療期間均未發生前房出血和眼內感染等不良并發癥。本次研究結果進一步提示,針對行白內障超聲乳化人工晶狀體植入手術后,發生早期高眼壓的患者聯合采取藥物治療方案與前房放液治療,能夠有效快速的降低患者高眼壓水平,并且具有較高的安全性。該聯合治療方案在術后高眼壓患者的治療中具有較高臨床應用價值。
綜上所述,針對白內障超聲乳化人工晶狀體植入術后出現的早期高眼壓,通過藥物治療方案聯合前房放液治療可有效降低患者高眼壓,具有作用效果良好、起效速度快等優勢,是術后早期高眼壓患者的有效安全治療方案。

