利用蟹殼制備乳酸鈣和甲殼素的技術研究
韓曉梅,王晨笑,楊鑫,王博,桑亞新,孫紀錄,*
(1.河北農業大學食品科技學院,河北保定071001;2.中糧營養健康研究院有限公司營養健康與食品安全北京市重點實驗室,北京102209;3.中糧營養健康研究院有限公司老年營養食品研究北京市工程實驗室,北京102209)
隨著人工養殖技術的發展,我國螃蟹產量逐年遞增,在加工或食用過程中產生大量的蟹殼。長期以來,蟹殼除少量被低值化利用之外,多是作為垃圾扔掉,既浪費資源,又污染環境。實際上,蟹殼中含有豐富的化學物質,其中包括蛋白質、礦物質和甲殼素,礦物質含量約占50%,甲殼素含量約為15%~25%。
甲殼素(chitin)又稱幾丁質,廣泛存在于甲殼類海洋節肢動物中[1]。甲殼素是一種高分子的糖化合物,吸濕性強,能夠吸附重金屬離子,無毒無味,可以作為食品填充劑、穩定劑、脫色劑等,已在醫藥、農業、輕紡、環保等領域廣泛應用[2-4]。在工業上從蟹殼中提取甲殼素,主要過程為在機械攪拌下用鹽酸對蟹殼脫鈣,用堿脫蛋白質[5],目前,甲殼素及其衍生物的制備廣受關注[6-9],如王金香等以華溪蟹蟹殼為原料,采用稀鹽酸脫鈣和稀堿脫蛋白,甲殼素收率為13%[10]。在本文中用堿性電解水(basic electrolyzed water,BEW)代替傳統的堿處理脫蛋白,BEW通過電解稀鹽(通常是NaCl)溶液從陰極產生,其pH值可達12左右,氧化還原電位約為-80 mV。關于BEW的應用,已有諸多研究報道[11],如BEW可以作為去污劑等。BEW和傳統堿液脫蛋白工藝中使用的NaOH溶液在酸堿性方面具有極高的相似性,且電解水對人體健康和環境無害,安全性好,可現場生產,操作簡便,價格低廉[12]。因此研究BEW處理蟹殼對開發一種新型的綠色環保的蟹殼脫蛋白技術工藝具有一定現實意義。
除此之外,蟹殼中的礦物質含量高達50%,主要以碳酸鈣的形式存在,是一種天然的綠色鈣源。然而,碳酸鈣不易被人體吸收利用,而乳酸鈣以其高溶解度、高吸收率和高安全性等優點成為補鈣劑的優選[13],可以作為一種營養增補劑[14]、穩定劑及增稠劑[15]等,還可以用作面包發酵粉的膨松劑和緩沖劑。本研究擬利用乳酸,采用直接中和的方法將蝦蟹殼中的碳酸鈣轉變為乳酸鈣[16-17],使其廣泛應用于工業、食品及醫療行業等,并結合堿性電解水相繼處理脫蛋白質提取甲殼素,從而為綜合利用蟹殼資源提供一條高效途徑。
1 材料與方法
1.1 材料與儀器
蟹殼:河北省黃驊市產梭子蟹;其他試劑:均為分析純。
電解水發生器:河北農業大學食品科技學院食品微生物學實驗室自制;PHS-3DW型pH計:安徽合肥橋斯儀器設備有限公司;3K15型低溫冷凍離心機:SIGMA;FA1004型電子天平:上海良平儀器儀表有限公司;XL-100型馬弗爐:河南市鶴壁億欣儀器儀表有限公司;JJ-1型電動攪拌器:常州國宇儀器制造有限公司。
1.2 試驗方法
1.2.1 蟹殼粉的制備
蟹殼清洗,然后放入50℃電熱鼓風干燥器中干燥12 h,將烘干的蟹殼粉碎,過篩,制備120目蟹殼粉末備用。
1.2.2 乳酸鈣的制備
稱取10 g蟹殼粉置于250 mL錐形瓶中,緩慢加入一定量的乳酸與其發生中和反應。為了防止發生溢液現象,需邊加乳酸邊攪拌。利用恒溫水浴搖床控制反應溫度,當不再有氣泡產生時,則表明反應完全。待反應完全后,將反應溶液加熱升溫至70℃,溶解產生的乳酸鈣,趁熱抽濾得到乳酸鈣母液。利用旋轉蒸發儀于65℃下加熱濃縮,收集濃縮液并冷卻靜置結晶24 h。分離晶體與母液,由于乳酸鈣在水中的溶解度比較大,結晶后母液中仍留有大量的乳酸鈣,需要濃縮后再次結晶,合并晶體。加入適量無水乙醇,洗滌反應生成的乳酸鈣晶體,除去未反應的乳酸及表面附著的其他殘留物。將無水乙醇洗后的乳酸鈣置于電熱鼓風干燥箱進行低溫靜態干燥,干燥溫度為80℃,干燥時間8 h,將樣品粉碎、過篩、包裝得到白色粉末狀乳酸鈣成品。
1.2.3 乳酸鈣制備條件優化
遵循單一因素變量的原則,研究蟹殼粉粒徑大小、反應溫度、反應時間、料液比、乳酸稀釋倍數對乳酸鈣產率的影響,從而設計單因素試驗,確定實現產率最大化的最佳反應條件。
1.2.3.1 蟹殼粉粒徑大小的確定
固定條件:蟹殼粉使用量為10 g,反應溫度為25℃,反應時間為1 h,料液比為1∶10(g/mL),乳酸稀釋倍數為9倍。蟹殼粉粒徑大小分為3個水平:80、120、160目。待反應完全后,經濃縮,洗滌,干燥即得產品,分別測定乳酸鈣產率。
1.2.3.2 乳酸稀釋倍數的確定
固定條件:蟹殼粉使用量為10 g,蟹殼粒徑大小為120目,反應溫度為25℃,反應時間為1 h,料液比為1 ∶10(g/mL)。乳酸稀釋倍數分為4 個水平:4、9、14、19倍。待反應完全后,經濃縮,洗滌,干燥即得產品,分別測定乳酸鈣產率。
1.2.3.3 料液比的確定
固定條件:蟹殼粉使用量為10 g,蟹殼粒徑大小為120目,反應溫度為25℃,反應時間為1 h,乳酸稀釋倍數為9倍。料液比分為4個水平:1∶6、1∶8、1∶10、1 ∶12(g/mL)。待反應完全后,經濃縮,洗滌,干燥即得產品,分別測定乳酸鈣產率。
1.2.3.4 中和反應溫度的確定
固定條件:蟹殼粉使用量為10 g,蟹殼粒徑大小為120 目,反應時間為1 h,料液比為1 ∶10(g/mL),乳酸稀釋倍數為9倍。中和反應溫度分為4個水平:25、40、55、70℃。待反應完全后,經濃縮,洗滌,干燥即得產品,分別測定乳酸鈣產率。
1.2.3.5 中和反應時間的確定
固定條件:蟹殼粉使用量為10 g,蟹殼粒徑大小為120目,反應溫度為25℃,料液比為1∶10(g/mL),乳酸稀釋倍數為9倍。中和反應時間分為4個水平:1.0、1.5、2.0、2.5 h。待反應完全后,經濃縮,洗滌,干燥即得產品,分別測定乳酸鈣產率。
1.2.4 乳酸鈣產品的理化指標檢測
對于使用乳酸處理蟹殼粉制得的乳酸鈣產品,依據GB 1886.21-2016《食品安全國家標準食品添加劑乳酸鈣》,分別測定其乳酸鈣含量、加熱減量及砷、鉛、鎂的含量。
1.2.5 堿性電解水后繼處理蟹殼粉脫蛋白質提取甲殼素
蟹殼粉經乳酸處理脫礦物質后剩余的殘渣經過濾、干燥后備用。取10 g殘渣放入堿性電解槽中,加入不同濃度NaCl(1%和0.1%)水溶液1 L,靜置10min測定初始pH值。接通電源電解,將電壓設定為20 V,隨著堿性電解水產生,其對蟹殼粉脫蛋白質作用也同步進行。連續處理期間,不間斷攪拌,并按照一定時間間隔測定電解液pH值,6 h后停止電解,抽濾除去電解液,然后,將蟹殼粉殘渣洗滌至中性,5 000 r/min離心10min,于60℃干燥8 h,稱重測定樣品的收率、灰分含量及蛋白質含量。
1.2.6 NaOH后繼脫蛋白從蟹殼中提取甲殼素
蟹殼粉經乳酸處理脫礦物質后的殘渣經過濾、干燥后備用。取10 g殘渣,加入一定量的2 mol/LNaOH溶液,于70℃下反應4 h,以除去所有蛋白質。過濾,將蟹殼粉殘渣洗滌至中性,5 000 r/min離心10min,于60℃下干燥8 h,即得甲殼素粗品。
以乳酸和NaOH聯合處理提取的甲殼素做參照,計算經乳酸和堿性電解水聯合處理蟹殼后蛋白質的含量及脫除率。
1.2.7 灰分含量測定方法
參照國標GB 5009.4-2016《食品安全國家標準食品中灰分的測定》的方法,測定甲殼素產品的灰分含量。
1.2.8 蛋白質含量及蛋白質脫除率測定方法
蛋白質脫除率測定的原理:由于蟹殼中的甲殼素同樣含有氮元素,單純使用凱氏定氮法并不能準確地計算出樣品中蛋白質的含量,因此,本研究利用凱氏定氮法測定堿性電解水處理后的樣品及傳統無機酸堿法提取的甲殼素中的含氮量,通過前者樣品中的氮含量減去后者甲殼素中的氮含量,即為蛋白質中的氮含量,然后乘以蛋白質轉換系數,即可計算出樣品中的蛋白質含量及蛋白質脫除率。
凱氏定氮法:稱取充分混勻的固體樣品0.1 g,精確至0.001 g,移入定氮瓶中,加入0.2 g硫酸銅,6 g硫酸鉀及10 mL濃硫酸,用消化爐消化3 h至液體呈藍綠色并澄清透明后,取下冷卻,用凱氏定氮儀蒸餾滴定,記錄試驗數據。
蛋白質含量ω及蛋白質脫除率η,分別按式(1)、(2)計算:
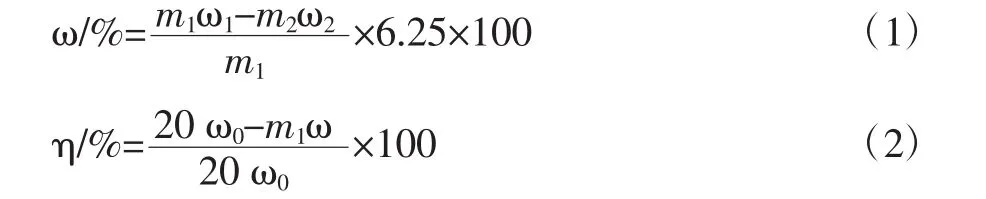
式中:m1為堿性電解水處理蟹殼脫蛋白后殘渣樣品的質量,g;m2為傳統無機酸堿法處理蟹殼提取甲殼素的質量,g;ω0為20 g蟹殼樣品中蛋白質含量,%;ω1為堿性電解水處理蟹殼脫蛋白后殘渣樣品的含氮量,%;ω2為傳統無機酸堿法處理蟹殼提取甲殼素的含氮量,%。
2 結果與分析
2.1 乳酸鈣制備條件優化
控制單一因素變量,研究蟹殼粒徑大小、反應溫度、反應時間、料液比、乳酸稀釋倍數對乳酸鈣產率的影響,從而確定實現產率最大化的最佳反應條件,試驗結果如圖1所示。


圖1 乳酸鈣制備的條件優化Fig.1 Conditional optimization for preparation of calcium lactate
乳酸鈣提取的單因素試驗結果表明,蟹殼粒徑的大小與中和反應溫度對乳酸鈣提取的影響沒有明顯差異,選擇120目蟹殼在25℃下與乳酸中和提取乳酸鈣,隨著乳酸稀釋倍數的增加,乳酸濃度越低,提取的乳酸鈣產量越低,乳酸適宜的稀釋倍數為9倍稀釋,此時乳酸的濃度為1.14 mol/L,料液比為1∶10(g/mL)時,乳酸鈣的產量明顯增加,繼續增加乳酸的量時則達到一個相對平衡的狀態,由圖1中反應時間對乳酸鈣產量的影響從而確定中和反應的時間為2 h。
綜合以上分析的結果,以蟹殼作為原料采用直接中和的方法制備乳酸鈣的最優條件為:120目蟹殼粉20 g,9倍稀釋的乳酸(1.14 mol/L)以 1 ∶10(g/mL)的料液比于25℃下與蟹殼中的鈣鹽發生中和反應,反應時間為2 h,經過濃縮、結晶、洗滌、重結晶后,最終的得到的乳酸鈣的最高產量為0.89 g/g蟹殼粉。
2.2 乳酸鈣產品的質量評價
利用乳酸中和蟹殼中的鈣鹽從而實現脫礦物質及制備乳酸鈣,對乳酸鈣的各項指標進行檢測,試驗結果如表1所示。
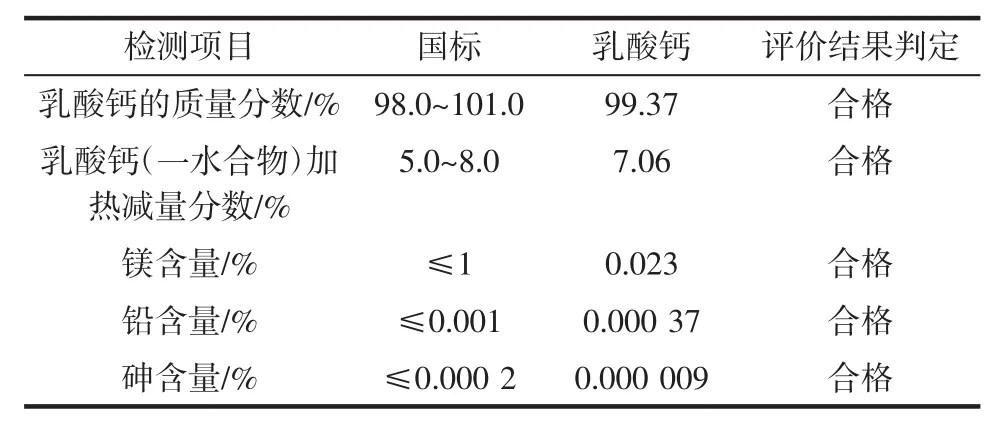
表1 乳酸鈣各項產品指標Table 1 The product indicators of the calcium lactate
表1結果表明,制備的乳酸鈣質量分數達到99.37%,加熱減量分數為7.06%,鎂、鉛和砷含量均在國標規定范圍內,乳酸鈣的各項指標均符合國家標準。
2.3 堿性電解水后繼脫蛋白質過程中pH值變化
分別用0.1%和1%的NaCl溶液制備堿性電解水,在堿性電解槽中加入一定量乳酸脫礦物質后的蟹殼殘渣,連續電解,保持OH-的不斷產生,使得蟹殼粉中的蛋白質得以持續脫除。定時測定電解過程(脫除過程)中的pH值變化,結果如圖2。

圖2 不同濃度NaCl制備的堿性電解水在連續處理蟹殼粉過程中的pH值變化Fig.2 The pH changes of BEW prepared with different concentrations of NaCl during the continuous treatment for crab shell powder
由圖2可見,在用堿性電解水處理蟹殼脫蛋白過程中,分別用1%和0.1%的NaCl溶液制備的堿性電解水,在相同的反應時間下電解液的pH值均有所上升,且在第1個小時之內上升最快并逐漸趨于穩定,其中由1%NaCl制備的的堿性電解水在脫蛋白過程中pH值變化趨勢更顯著,從7.07上升到12.84,而由0.1%NaCl制備的堿性電解水在相同的脫蛋白時間下其pH值從7.08上升到12.18。從圖中可以明顯看出利用1%NaCl制備的堿性電解水能夠在較快的時間內達到較高的堿度,并且在電解水電解過程中伴隨著產熱,有利于堿性電解水對蟹殼的脫蛋白質作用。
2.4 堿性電解水后繼脫蛋白質提取甲殼素
蟹殼經過乳酸脫礦物質后,取脫礦物質后的樣品10 g,分別用1%NaCl和0.1%NaCl溶液制備的堿性電解水脫蛋白,并用NaOH處理作對照,研究乳酸和堿性電解水聯合處理提取甲殼素的效果,試驗結果如表2所示。

表2 乳酸和堿性電解水聯合處理蟹殼提取的甲殼素常規指標Table 2 Standard test results for chitin extracted by lactic acid and BEW treatment from crab shell powder
數據表明,用1%NaCl溶液制備的堿性電解水對乳酸脫礦物質后的樣品進行脫蛋白,蛋白質含量由52%減少到7.53%,蛋白質脫除率為90.54%,測得甲殼素的灰分含量為0.81%,表明用乳酸和堿性電解水聯合處理能較好的實現脫礦物質和脫蛋白提取甲殼素,并且,高濃度的NaCl溶液制備的堿性電解水脫蛋白質程度更高。
3 結論和討論
為了實現蟹殼中鈣源與甲殼素的綜合利用,研究了乳酸與堿性電解水聯合處理對礦物質和蛋白質的脫除程度的影響,并對制備的乳酸鈣進行檢測,經過乳酸鈣制備條件的優化,9倍稀釋的乳酸(1.14 mol/L)以1∶10(g/mL)的料液比于25℃下與蟹殼中的鈣鹽發生中和反應,反應時間為2 h,最終乳酸鈣的最高產量為0.89 g/g蟹殼粉,礦物質脫除率為94.37%,Zakaria等利用副干酪乳桿菌A3發酵螯蝦廢料,5 d后礦物質脫除率為61.0%[18];Rao M S等用酸調節發酵體系的pH,并維持在6.0,結果發現植物乳桿菌脫除蝦殼中礦物質達88%[19],由此可見,相對于乳酸菌發酵法而言,利用乳酸脫礦物質效果更好,礦物質脫除程度更高。并且制備的乳酸鈣質量分數達到99.37%,加熱減量分數為7.06%,鎂、鉛和砷元素含量以及水溶解試驗、游離酸和游離堿試驗、揮發性脂肪酸試驗均符合國家標準。然后將乳酸脫礦物質后的殘渣用1%NaCl溶液制備的堿性電解水脫蛋白,蛋白質含量由52%減少到7.53%,蛋白質脫除率為90.54%,灰分含量為0.81%,該試驗結果要優于W.J.Jung等從蟹殼中篩選出的產蛋白酶菌株粘質沙雷氏菌-FS3的脫礦物質和脫蛋白效果[20]。并且1%NaCl溶液制備的堿性電解水較0.1%NaCl溶液制備的堿性電解水脫蛋白程度更高。試驗表明,用乳酸和堿性電解水聯合處理能較好的實現脫礦物質和脫蛋白質制備乳酸鈣和甲殼素,實現蟹殼資源的有效利用。
[1]Yang S F,Zhang H C,Shi Y X,et al.The new technologies in chitin/chitosan preparation[J].Advanced Materials Research,2013,666:143-150
[2]孟凡欣,吳麗艷,徐盼菊,等.蝦殼甲殼素提取工藝優化及其輔助降血糖活性研究[J].食品研究與開發,2016,37(5):95-100
[3]簡慧蘭.甲殼素/殼聚糖的制備及其在食品工業中的應用[J].南通職業大學學報,2003,17(1):56-58
[4]蔣小姝,莫海濤,蘇海佳,等.甲殼素及殼聚糖在農業領域方面的應用[J].中國農學通報,2013,29(6):170-174
[5]顧正桂,林軍,顧美娟.甲殼素系列產品生產過程的優化及裝置的改進[J].現代化工,2009,29(1):62-65,67
[6]蔚鑫鑫,劉艷,吳光旭.小龍蝦殼中甲殼素的提取及殼聚糖的制備[J].湖北農業科學,2013,52(13):3120-3123
[7]許慶陵,曾慶祝.蝦殼甲殼素及殼聚糖提取工藝的研究[J].中國食品添加劑,2013(6):104-109
[8]權靜.蟹殼制備殼聚糖的工藝研究[J].廣州化工,2012,40(15):105-107
[9]Mohammed M H,Williams P A,Tverezovskaya O.Extraciton of chitin from prawn shells and conversion to low molecular mass chitosan[J].Food Hydrocolloids,2013,31(2):166-171
[10]王金香,王蘭.華溪蟹幾丁質的提取與殼聚糖的制備[J].食品工業科技,2005,26(3):109-111
[11]Sun J L,Zhang S K,Chen J Y,et al.Efficacy of acidic and basic electrolyzed water in eradicating Staphylococcus aureus biofilm[J].Canadian Journal of Microbiology,2012,58(4):448-454
[12]Tanaka N,Fujisawa T,Daimon T,et al.The effect of electrolyzed strong acid aqueous solution on hemodialysis equipment[J].Artificial Organs,1999,23(12):1055-1062
[13]江敏,李鑒,梁潔玲,等.牡蠣殼合成L-乳酸鈣的工藝研究[J].食品科技,2008,33(3):123-125
[14]Daengprok W,Garnjanagoonchorn W,Mine Y.Fermented pork sausage fortified with commercial or hen eggshell calcium lactate[J].Meat Science,2002,62(2):199-204
[15]白海濤.雞蛋殼制備食品級乳酸鈣的新工藝研究[D].西安:西北大學,2006
[16]Rubilar O E,Healy M G,Healy A.Bioprocessing of avian eggshells and eggshell membranes using lactic acid bacteria[J].Journal of Chemical Technology&Biotechnology,2006,81(6):900-911
[17]Lee Y K,Kim S D.Preparation and characteristics of calcium lactate from black snail[J].Journal of Food Science&Nutrition,2003,8(2):166-172
[18]Zakaria Z,Hall G M,Shama G.Lactic acid fermentation of scampi waste in a rotating horizontal bioreactor for chitin recovery[J].Process Biochemistry,1998,33(1):1-6
[19]Rao M S,Stevens W F.Chitin production by Lactobacillus,fermentation of shrimp biowaste in a drum reactor and its chemical conversion to chitosan[J].Journal of Chemical Technology&Biotechnology,2005,80(9):1080-1087
[20]Jo G H,Jung W J,Kuk J H,et al.Screening of protease-producing Serratia marcescens FS-3 and its application to deproteinization of crab shell wastefor chitin extraction[J].Carbohydrate Polymers,2008,74(3):504-508

