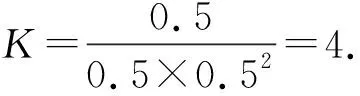高中化學圖像題解題思路及典型例析
刁文忠
(安徽省太和第一中學 236600)
一、圖形題——坐標曲線圖
其過程分為看圖、析圖、用圖三個步驟.其中看圖是基礎,析圖是關鍵,用圖是目的.看圖的關鍵是:首先看軸(縱、橫坐標的含義);其次看點(始點、交叉點、拐點、終點);再次看線(線的變化趨勢和走向);還要看輔助線(如等壓線、等溫線等);最后看量的變化(如溫度、濃度變化).析圖是要把學過的化學原理、概念及規律等與圖中的曲線、相關點聯系起來.用圖是利用原理,結合圖像,分析圖像中所描述含義,作出判斷.


解析從選項上看涉及的是溫度和壓強對化學平衡的影響,然后采用“定一議二”,找出等壓線和等溫線,當壓強不變時,由題干可知反應是放熱反應,升高溫度平衡逆向移動,A%增大,可以排除C、D,然后再看當溫度不變時,由于m+n>p,增大壓強平衡正向移動,A%減小,再排除A,答案B.
二、表格題——數據表格分析題
此類題常以表格形式傳遞有關的原理、概念等信息,因考查學生在析圖的過程中獲取信息并解決問題的能力,成為常考的題型.此類題目的信息比較隱蔽,它要求學生仔細分析表格的信息,把表格轉變成文字,找出所要考的知識,結合概念和原理答題,要盡量用課本上的術語表述,條理要清楚.
例2 為改善空氣質量降低空氣中的碳氧化物、氮氧化物的含量,各地采取各種措施控制碳、氮氧化物排放.
(1)汽車尾氣中的CO(g)和NO(g)在的催化劑作用下可被凈化.已知部分化學鍵的鍵能見表1.
表1

汽車尾氣的凈化過程中NO(g)和CO(g)發生反應的熱化學方程式為:
(2)汽車尾氣內燃機工作時,N2和O2會發生反應

在T1、T2溫度下,將nmol NO置于密閉容器中,N2的體積分數隨時間的變化如圖1所示,則反應的ΔH________.(填“>”或“<”)
(3)某一密閉體積可變的容器(容器與活塞之間的摩擦力不計)中,現將2 mol CO和3mol H2放入容器中,將活塞至A、B點并用鉚釘固定(如圖2所示),此時體積V為2 L,

在不同時間段,T1、T2溫度下 (CO)見表2.

圖1 圖2
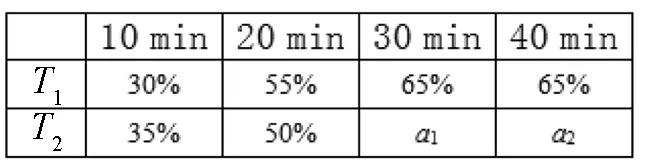
①由表中可知T1______(填“=”、“>”或“<”)T2;30 min時,α1=________,此溫度下平衡常數為______.
②40 min時,拔出鉚釘,T2溫度下活塞紋絲不動(容器密封良好),如果將6 mol CO通入容器中,此時v(正)________(填“=”、“>”或“<”)v(逆).
(4)消除CO污染還可以利用CO在一定條件下與甲醇反應生成醋酸,現將bmol·L-1Ba(OH)2溶液與amol·L-1的醋酸在常溫下等體積混合,反應充分后,混合液中存在c(CH3COO-)=2c(Ba2+),此刻混合液中醋酸的電離常數(用a和b的代數式表示)Ka=________.
解析(1)由ΔH等于斷鍵吸收的能量與形成化學鍵所吸收的差值,ΔH=(632×2+1072×2-946-750×4)kJ·mol-1=-538 kJ·mol-1.
(2)根據“先拐先平數值大”知,T1 為放熱反應,ΔH>0. 參考文獻: [1]馬建峰.化學教學論[M].北京:科學出版社,2015. [2]逯明鋒.“模型”設計實例的研究[J].數理化學習,2015(4):14.